2. 201321 上海市质子重离子医院放射治疗科 ;
3. 200032 上海, 复旦大学医学院复旦大学附属肿瘤医院放射治疗科
2. Department of Radiation Oncology, Shanghai Proton and Heavy Ion Center, Shanghai, 201315 ;
3. Department of Radiation Oncology, Fudan University Shanghai Cancer Center, Fudan University Shanghai Medical School, Shanghai 200032, China
调强X射线放射治疗(IMXT)是初诊无远处转移的鼻咽癌的标准放射治疗技术,但约10%的患者在完成根治性IMXT或IMXT联合化疗后仍出现局部复发。鼻咽癌局部复发的治疗多受复发肿瘤病灶的解剖学部位、侵及范围及肿瘤首程放疗时周围正常组织和危及器官(organs at risks,OARs)的照射剂量所限制。虽然体积较小的复发肿瘤可考虑手术或腔内近距离放射治疗,但绝大多数局部复发病灶由于体积较大或侵及范围较广而无法采用上述手段。 目前,再程IMXT仍为局部晚期复发鼻咽癌挽救治疗最主要的技术。然而,再程IMXT后的严重不良反应,尤其是重复高剂量放疗直接导致的黏膜坏死和(或)大出血,可直接危及患者生命。因此,局部复发性鼻咽癌的治疗极具挑战,且迫切需要更有效更安全的新型放射治疗技术。上海市质子重离子医院(复旦大学附属肿瘤医院质子重离子中心)自2015年5月起首次以束流调强碳离子放射治疗(intensity modulated carbon-ion therapy,IMCT)技术治疗局部复发鼻咽癌。本研究采用IMCT技术治疗局部复发鼻咽癌患者,将其近期疗效和不良反应与2012年5月—2014年5月在复旦大学附属肿瘤医院完成再程IMXT挽救性治疗患者的结果进行比较。
资料与方法1. 患者资料:上海市质子重离子医院自2015年5月—2016年1月采用IMCT技术完成了23例复发鼻咽癌患者的治疗,其中14例患者根据本院随访标准流程完成了至少3个月的随访,8例患者完成了至少6个月的随访。对照组为2012年5月至2014年5月在复旦大学附属肿瘤医院完成再程IMXT挽救性治疗的患者,共47例。所有患者的病理分型均属世界卫生组织(WHO) Ⅱ/Ⅲ型,首程放疗均采用了总剂量>66 Gy的IMXT常规分割放射,并根据AJCC第7版分期标准对复发肿瘤进行再分期。两组病例的详细情况见表 1。IMCT组T分期晚期患者多于IMXT组(P=0.079)。
|
|
表 1 患者的一般情况 Table 1 Characteristics of patients |
2. 定位、靶区勾画及计划:患者采仰卧位,头颈肩热塑膜固定,在同一体位下行定位CT扫描及MRI扫描,并将MRI图像和CT定位图像通过骨性标志融合以帮助勾画靶区,使用德国西门子Syngo离子放射治疗计划系统(IMCT)和Pinnacle治疗计划系统(IMXT)优化剂量分布以达到临床要求。大体肿瘤体积(GTV)包括鼻咽部复发肿瘤及转移颈淋巴结。对IMCT患者,临床肿瘤靶区(CTV)为GTV+3 mm及可能的高危区域,给予45~5175 GyE/22~27次,18~225 GyE/次;CTV增量boost为GTV+3 mm,给予50~575 GyE/22~27次,20~25 GyE/次,PTVs为CTVs外放1 mm摆位误差外加粒子放射剂量不确定误差边界,要求95%的等剂量线包括95%的CTVs,90%的等剂量线包括90%的PTVs,使用西门子IONTRIS粒子放射治疗系统、笔形扫描技术给予碳离子束调强放射治疗,典型剂量学分布示于图 1。对IMXT患者,靶区设计依患者具体病情和主治医生而略有不同,总体上,主要针对GTV外加一定的安全边界给予总剂量54~66 Gy/27~33次放射,20~21 Gy/次,中位剂量66 Gy/33次,采用固定角度调强放射技术。所有患者均不对颈淋巴结区域行预防照射,同时勾画重要的正常组织及危及器官并给予剂量限定,如脑干(D max 30 GyE)、视神经和视交叉(D max 30 GyE)、脊髓(D max 2.0 GyE)等。
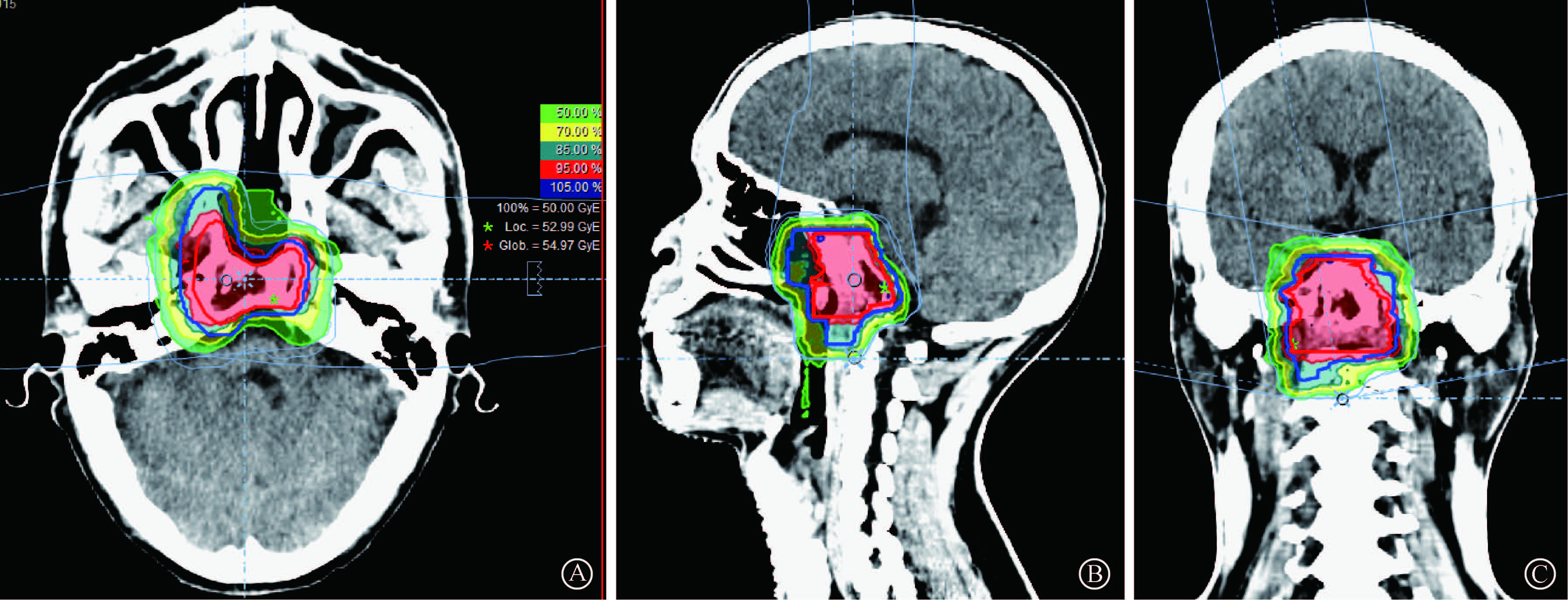
|
图 1 1例rT3N0M0局部复发鼻咽癌患者的碳离子放疗计划剂量分布图 A.横断面;B.矢状位;C.冠状位 Figure 1 A typical IMCT treatment plan of a patient with rT3N0M0 locally recurrent NPC A.Transverse view;B.Sagittal view;C.Coronal view |
3. 疗效及不良反应评价标准:近期疗效评价根据RECIST11标准[1];急性不良反应根据CTC AE 403标准,主要记录血液学改变、黏膜反应、神经损伤,后期不良反应根据RTOG标准评估。
4. 随访:根据本院放疗后的标准随访流程,治疗后除第1个月行首次随访外,2年内每3个月随访1次,之后3年内每半年随访1次,5年后每年随访1次。随访内容包括查体、不良反应评级和头颈部MRI,并根据临床表现行胸部CT、腹部B超/CT或全身PET/CT检查。
5. 统计学处理:两组病例的一般情况的构成比采用χ2检验。由于IMCT组病例的随访期尚短,本研究仅比较两组病例3个月的近期疗效,即完全缓解率(complete response,CR),以及放疗结束后6个月内发生的严重后期不良反应的发生率和死亡率,均采用χ2检验。当理论频数<5或总观测频数<30时,采用Fisher的概率检验法。P<0.05为差异有统计学意义。
结 果1. 随访情况:14例完成再程IMCT治疗的患者均按计划完成了治疗和定期随访,所有患者均进行了3个月的随访,其中8例患者进行了6个月的随访。完成IMXT再程放射治疗的对照组的随访中位时间19~378个月(中位228个月),IMXT组仅取治疗后6个月的复查结果与IMCT组进行比较。
2. 近期疗效:IMCT组患者目前均存活,出现骨转移和颈部淋巴结复发各1例。IMXT组6个月内2例患者死亡,1例死于其他内科疾病(肺部感染),另1例在放疗结束后38个月死于鼻咽坏死、大出血。两组病例放疗后3个月的完全缓解(CR)率无明显差别。两组病例的近期疗效见表 2。
|
|
表 2 局部复发鼻咽癌IMCT和IMXT再程放疗后近期疗效 Table 2 Early outcomes of patients with LRNPC treated with IMCT vs. |
3. 放疗相关不良反应:调强碳离子放疗(IMCT)组在治疗中仅2例(143%)出现轻度(1级)黏膜相关不良反应,并在治疗后首次(即1个月)复诊时完全恢复;治疗期间或完成治疗后未发现2级或以上的黏膜反应包括黏膜坏死。2例外生型肿瘤患者完成治疗后3个月内出现肿瘤部位坏死,但鼻咽镜检查显示周围黏膜未出现2级或以上的黏膜反应;所有患者未发现其他放疗相关的不良反应,无治疗相关死亡病例。IMXT组治疗中分别有10例(213%)和5例(10.6%)出现2级和3级急性黏膜反应,IMXT治疗后黏膜坏死、伴症状的颞叶坏死及颅神经损伤的发生率分别为18例(383%)、4例(85%)和11例(234%),6个月内的发生率则分别为14例(298%)、2例(43%)及00%。IMCT与IMXT不良反应比较见表 3。
|
|
表 3 IMCT与IMXT治疗的不良反应 Table 3 Treatment induced adverse effects: IMCT vs. |
讨 论
局部复发是鼻咽癌治疗后最主要的失败方式,再程放射是其最主要的挽救性治疗手段。再程放疗剂量需达60 Gy以上方可控制肿瘤。Lee等[2]报道的一项大型回顾性研究中,654例局部早期复发鼻咽癌采用常规二维再程照射>70 Gy、60~70 Gy及<60 Gy的生物学等效剂量(BED)所对应的 5年无局部复发生存率(LFFS)分别为40%、35%及14%。采用X射线调强放射技术(总剂量60~70 Gy)再程放射提高了复发性鼻咽癌的疗效,但对局部晚期患者,疗效仍难令人满意,2年生存率通常不及50%[3-6]。另外,高剂量再程IMXT治疗,即使复发肿瘤得以控制,但再程放疗导致的严重后期不良反应,如鼻咽坏死和(或)大出血,严重的脑(颞叶)坏死和后组颅神经损伤,可直接危及患者的生命。在一项包括239名局部复发性鼻咽癌患者的回顾性分析中,GTV的平均受照射剂量为70 Gy(62~78 Gy),120名死亡患者中的692%(相当于整组患者的347%)的患者死于放射性损伤[6]。目前,复发鼻咽癌再程IMXT挽救性治疗失败的主要原因并非肿瘤局部进展或复发,而是包括鼻咽黏膜坏死或大出血在内的严重不良反应[3-6]。
放射治疗后局部复发的主因,通常包括肿瘤靶区的照射范围不足、肿瘤内存在放射不敏感细胞群或肿瘤处于导致放射敏感性降低的环境(如乏氧)。近年来随着先进的影像学检查手段和IMXT及联合放化疗技术的应用,鼻咽癌IMXT后的局部复发率也大幅降低至不足10%[7],复发的主要原因与2DRT后的复发也不尽相同,肿瘤靶区受照不全(即靶区遗漏)的可能性大大降低,更可能是因放射不敏感细胞群的大量存在。另外,放疗后出现的鼻咽结构变化、血供较差和纤维化增生,将严重降低再程放射治疗的疗效及正常组织的修复。因此,局部复发鼻咽癌的再程放疗所面临的困境是,一方面,复发肿瘤病灶需较高剂量的照射以达到肿瘤控制;另一方面,肿瘤周围的正常组织和OARs对高剂量再程放疗无法耐受。这种困境对于IMXT后复发的鼻咽癌将可能更加严峻。显然,局部复发性鼻咽癌需要更安全且有效的治疗技术,尤其对IMXT后复发的鼻咽癌患者。
与光子线的深度剂量呈指数型衰减分布不同,质子或重离子射线的剂量集中在射程末端的Bragg峰区,可仅在肿瘤体积形成高剂量区,并控制肿瘤周围正常组织的剂量。峰区的位置可通过调解加速离子的能量精确控制。剂量学研究显示,质子线治疗鼻咽癌较IMXT在肿瘤靶区和OARs的照射剂量分布上均更具优势[8]。
射线对肿瘤的杀灭效应和对正常人体组织的损伤效应不仅与受剂量有关,而且与射线的传能线密度(LET)密切相关。LET越高,生物学效应就越强。常规光子和质子这种低LET射线在多数情况下仅导致肿瘤细胞的DNA单链断裂、亚致死损伤,易出现自然修复,并且依赖于氧含量和细胞周期,乏氧和G0期细胞对放射抗拒。而碳离子这种高LET射线可直接导致肿瘤细胞的DNA双链断裂,受细胞周期的影响较小,对各周期的细胞均有效,几乎不受氧浓度的影响,可更有效地杀灭乏氧肿瘤细胞[9]。因此,碳离子较光子和质子等低LET射线的相对生物学效应(RBE)更高。此外,碳离子射线的LET在人体内的射线路径中是变化的,在路径初程LET值较低,而在射程末端碳离子运动减缓,LET值突然增高,高生物效应局限在Bragg峰区,射程的其他部分生物效应则较低。如此碳离子射线的高RBE区域可集中在肿瘤靶区,而周围OARs则避免了高剂量和射线高LET部分的照射。碳离子的优势也在临床应用中得到了证实,日本国立放射医学研究所(NIRS)发表的的一项Ⅰ/Ⅱ期临床研究[10],以碳离子治疗了36例恶性黑色素瘤、腺样囊性癌、软组织肉瘤等各类对光子放疗不敏感的头颈部肿瘤,5年肿瘤局部控制率高达75%。其中,5例恶性黑色素瘤、9例腺样囊性癌及12例唾液腺/外耳道肿瘤的5年局部控制率分别达100%、90%和100%。这一结果提示,碳离子对类似恶性黑色素瘤和腺样囊性癌这样“放射抵抗”性肿瘤具有良好的疗效。
上述质子重离子射线的物理学和碳离子射线独特的生物学特征,对头颈部肿瘤尤其是曾接受高剂量放疗后出现局部复发的患者同样具有独特的优势。首先,头颈部解剖结构复杂,肿瘤通常临近重要器官或组织,故有效运用质子重离子射线剂量学上的优势,不仅可显著提高部分头颈部肿瘤的疗效,且可降低周围OARs的照射剂量。通常局部复发鼻咽癌患者的重要OARs(如颞叶、颅神经和鼻咽黏膜)已经受到了足量的照射,因此再程治疗中降低OARs的受量,可有效降低治疗相关的不良反应。
质子重离子用于再程放射头颈部肿瘤的安全性,是值得关注的方面。Lin等[11]对16例常规光子放疗(总剂量为50~882 Gy)后复发的鼻咽癌患者,大多数为局部中晚期,采用再程质子放疗,给予594~70.2 GyE总剂量(常规分割)照射,尽管当时未广泛采用MRI等较为先进的影像学技术辅助诊断与靶区勾画,但对肿瘤靶区包括完全的患者,2年的无进展生存率可高达83%,且所有患者均未出现严重的神经系统不良反应,仅2例出现黏膜坏死/骨坏死,治疗后均得以康复。
在美国Berkley Lawrence国家实验室完成的另一项研究,采用氦离子或氖离子治疗了11例复发性鼻咽癌患者,所有患者肿瘤均侵犯了颅底,其中7例伴颅内神经症状。患者首程放射采用2DRT技术,总剂量61~81 Gy。重离子再程照射的剂量为318~623 GyE(中位剂量50 GyE,常规分割)。随访42个月后分析显示,3年的总生存率(OS)为59%,且未出现危及生命的严重不良反应[12]。德国海德堡离子治疗中心(HIT)的学者采用碳离子放射治疗了18例光子或质子治疗失败(含2例二次放疗失败者)的不同病理的头颈部肿瘤颅底复发的患者,给予了42~60 GyE(日分割剂量为3 GyE)的再程IMCT治疗。所有患者均完成了计划的放射治疗,且未出现3级以上的不良反应。患者的两年OS和局部控制率(LC)分别为86%和92%,中位无进展生存时间为24个月[13]。
上海市质子重离子医院迄今已对23例局部复发性鼻咽癌采用了碳离子治疗,其中大多数患者的局部复发病灶分期为rT3 4或rN +期,所有患者首程均接受了>66 Gy的IMXT治疗,IMCT挽救性再程放疗的剂量为 50~60 GyE(日分割剂量2或25 GyE)。本研究报道的14例是再程IMCT后随访时间相对较长的患者(6个月8例,3个月6例)。对照组中接受再程IMXT挽救治疗者亦为根治性IMXT后出现的局部复发,中位随访时间仅228个月时,再程照射后导致的鼻咽黏膜坏死或大出血的发生率已高达383%,且18例患者中的14例(777%)黏膜坏死或大出血出现在治疗完成后的6个月内,不但高于此前多项2DRT后再程IMXT研究中的19%~40%,且大多于放疗结束后短期内发生。造成这一差异的主要原因可能在于,首次IMXT照射中鼻咽黏膜尤其是计划靶区(PTV)内的剂量分布,较2DRT更高,更为均匀。然而,14例完成再程IMCT的患者,近期疗效类似,但无1例在治疗过程中或3~6个月随访中发生2级及以上的黏膜或其他放疗相关的不良反应,且未出现照射区域的肿瘤再次复发/进展或患者死亡。IMXT有2例患者于6个月内死亡,其中1例死于放疗导致的鼻咽坏死大出血。显然,使用再程IMCT治疗鼻咽癌或颅底肿瘤复发,在近期严重不良反应方面较再程IMXT,有着明显的优势。
总之,鼻咽癌IMXT根治后的局部复发,经再程IMXT后治疗失败的主因是严重的治疗相关不良反应(如鼻咽坏死和大出血)。IMCT作为一种先进的放射治疗技术,在局部复发性鼻咽癌的再程放射治疗中显现出一定的优势,可显著降低近期严重不良反应鼻咽黏膜坏死或大出血发生率。虽然IMCT治疗组的患者暂未出现局部进展/复发或死亡,但因随访时间仅3~6个月,IMCT在提高局部复发鼻咽癌的局部控制率及延长患者生存时间方面的优势,尚需更长时间的随访。此外,IMCT治疗局部复发性鼻咽癌的最大耐受剂量(maximal tolerated dose)及其相对应疗效尚未明确。目前,上海市质子重离子医院已开展的两项IMXT治疗鼻咽癌失败后[14-15],采用再程IMCT挽救放疗的前瞻性Ⅰ/Ⅱ期剂量递增研究,将对单一IMCT和IMCT联合同期化疗治疗局部复发鼻咽癌的最大耐受剂量及其疗效予以研究。
利益冲突 本人与本人家属、其他研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 孔琳负责患者治疗方案的制定,临床资料的收集和审查,临床资料的统计分析和论文写作;陆嘉德与孔琳共同负责患者治疗的总体治疗策略,论文的写作方向和指导论文写作;王磊负责部分患者(光子调强放射治疗患者)的临床观察和资料收集;管西寅、胡集祎、高晶、张晓斐、朱颖超负责部分患者(碳离子调强放射治疗患者)的临床观察
| [1] | Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours:revised RECIST guideline (version 1.1)[J]. Eur J Cancer , 2009, 45 (2) : 228-247 DOI:10.1016/j.ejca.2008.10.026 |
| [2] | Lee AWM, Foo W, Law SCK, et al. Reirradiation for recurrent nasopharyngeal carcinoma:factors affecting the therapeutic ratio and ways for improvement[J]. Int J Radiat Oncol Biol Phys , 1997, 38 (1) : 43-52 DOI:10.1016/S0360-3016(97)00244-7 |
| [3] | Hua YJ, Han F, Lu LX, et al. Long-term treatment outcome of recurrent nasopharyngeal carcinoma treated with salvage intensity modulated radiotherapy[J]. Eur J Cancer , 2012, 48 (18) : 3422-3428 DOI:10.1016/j.ejca.2012.06.016 |
| [4] | Qiu S, Lin S, Tham IW, et al. Intensity-modulated radiation therapy in the salvage of locally recurrent nasopharyngeal carcinoma[J]. Int J Radiat Oncol Biol Phys , 2012, 83 (2) : 676-683 DOI:10.1016/j.ijrobp.2011.07.006 |
| [5] | 蓝玉宏, 田允铭, 白力, 等. 初治转移鼻咽癌疗后预后评分模型建立及分层治疗研究[J]. 中华放射肿瘤学杂志 , 2015, 24 (4) : 421-426 Lan YH, Tian YM, Bai L, et al. Post-treatment prognostic score model establishment and stratified therapy for newly diagnosed metastatic nasopharyngeal carcinoma[J]. Chin J Radiat Oncol , 2015, 24 (4) : 421-426 DOI:10.3760/cma.j.issn.1004-4221.2015.04.017 |
| [6] | Han F, Zhao C, Huang SM, et al. Long-term outcomes and prognostic factors of re-irradiation for locally recurrent nasopharyngeal carcinoma using intensity-modulated radiotherapy[J]. Clin Oncol (R Coll Radiol) , 2012, 24 (8) : 569-576 DOI:10.1016/j.clon.2011.11.010 |
| [7] | Lin JC. Adjuvant chemotherapy in advanced nasopharyngeal carcinoma based on plasma EBV load[J]. J Radiat Oncol , 2012, 1 (2) : 117-127 DOI:10.1007/s13566-012-0036-9 |
| [8] | Lewis GD, Holliday EB, Kocak-Uzel E, et al. Intensity-modulated proton therapy for nasopharyngeal carcinoma:Decreased radiation dose to normal structures and encouraging clinical outcomes[J]. Head Neck , 2016, 38 (Suppl 1) : E1886-1895 DOI:10.1002/hed.24341 |
| [9] | Huang YW, Pan CY, Hsiao YY, et al. Monte Carlo simulations of the relative biological effectiveness for DNA double strand breaks from 300 MeV u (-1) carbon-ion beams[J]. Phys Med Biol , 2015, 60 (15) : 5995-6012 DOI:10.1088/0031-9155/60/15/5995 |
| [10] | Mizoe JE, Tsujii H, Kamada T, et al. Dose escalation study of carbon ion radiotherapy for locally advanced head-and-neck cancer[J]. Int J Radiat Oncol Biol Phys , 2004, 60 (2) : 358-364 DOI:10.1016/j.ijrobp.2004.02.067 |
| [11] | Lin R, Slater JD, Yonemoto LT, et al. Nasopharyngeal carcinoma:repeat treatment with conformal proton therapy-dose-volume histogram analysis[J]. Radiology , 1999, 213 (2) : 489-494 DOI:10.1148/radiology.213.2.r99nv29489 |
| [12] | Feehan PE, Castro JR, Phillips TL, et al. Recurrent locally advanced nasopharyngeal carcinoma treated with heavy charged particle irradiation[J]. Int J Radiat Oncol Biol Phys , 1992, 23 (4) : 881-884 DOI:10.1016/0360-3016(92)90663-3 |
| [13] | Combs SE, Kalbe A, Nikoghosyan A, et al. Carbon ion radiotherapy performed as re-irradiation using active beam delivery in patients with tumors of the brain,skull base and sacral region[J]. Radiother Oncol , 2011, 98 (1) : 63-67 DOI:10.1016/j.radonc.2010.10.010 |
| [14] | Kong L, Hu J, Guan X, et al. Phase Ⅰ/Ⅱ trial evaluating carbon ion radiotherapy for salvaging treatment of locally recurrent nasopharyngeal carcinoma[J]. J Cancer , 2016, 7 (7) : 774-783 DOI:10.7150/jca.14399 |
| [15] | Kong L, Hu C, Niu X, et al. Neoadjuvant chemotherapy followed by concurrent chemoradiation for locoregionally advanced nasopharyngeal carcinoma:interim results from 2 prospective phase 2 clinical trials[J]. Cancer , 2013, 119 (23) : 4111-4118 DOI:10.1002/cncr.28324 |
 2016, Vol. 36
2016, Vol. 36


