重离子具有良好的物理剂量分布,同时穿透力强,电离能力强,可造成较重的生物效应而成为肿瘤放射治疗以及空间生物效应的研究热点[1]。重离子(C、O、Mg、Fe、Si等)虽然只占银河宇宙射线的1%,但是贡献的剂量却占总剂量的50%以上,而Fe离子是其中贡献最大者[2]。为进一步提高重离子对肿瘤放射治疗的精确度和评估空间探索的安全性,本研究利用56Fe17+离子束、12C6+离子束、60Co γ射线3种不同LET的射线照射淋巴细胞,比较Fe、C离子束及γ射线对染色体畸变、细胞周期和细胞凋亡的影响,并探讨LET与放射生物学效应的关系。
材料与方法1. 细胞系及试剂:人淋巴细胞系PengEBV购于中国科学院昆明动物研究所,RPMI 1640培养基(美国GIBCO公司),胎牛血清(天津市灏洋生物制品科技有限公司),Annexin VFITC/PI染料细胞凋亡试剂盒、细胞DNA含量检测试剂盒(中国南京凯基生物科技发展有限公司),青链霉素混合液(北京索莱宝科技有限公司),4℃预冷70%乙醇,姬姆萨原液、秋水仙素(青岛莱佛生物工程研究所),KCl低渗液0075 mol/L,甲醇冰醋酸固定液3∶1混合,磷酸盐缓冲液(pH=74)。
2. 主要仪器:重离子加速器(中国科学院兰州近代物理研究所),60Co γ治疗机GWGP80(成都中国核动力研究院),Amnis® Image Stream Mark Ⅱ量化成像分析流式细胞仪(美国Merck Millipore公司),Epics XL流式细胞仪(美国Beckman Coulter公司)。
3. 照射条件:56Fe17+离子束和12C6+离子束由中国科学院近代物理研究所兰州重离子研究装置辐照终端引出。56Fe17+离子束能量为165 MeV/Nu,LET为400 keV/μm,照射剂量率0.26~0.55 Gy/min。12C6+离子束能量为165 MeV/Nu,LET为26 keV/μm,照射剂量率0.30~0.50 Gy/min。γ射线由中国辐射防护研究院附属医院60Co治疗机产生,照射剂量率为0.75 Gy/min,源靶距80 cm,照射野30 cm×30 cm。56Fe17+、12C6+重离子束与60Co γ射线吸收剂量均为0.5、2.0 Gy。
4. 细胞培养:人淋巴细胞系PengEBV于37℃、5%CO2恒温培养箱培养,培养基为含20%胎牛血清和0.1 U/L青链霉素混合液的RPMI 1640培养基。悬浮培养48 h进行传代,取对数生长期细胞进行下一步实验。
5. 染色体畸变分析:56Fe17+、12C6+重离子及60Co γ射线取照射剂量为0、0.5、2.0 Gy的细胞,照后48 h进行收获,收获前4 h加入秋水仙素(浓度为005 μg/ml);终止培养后,经低渗、固定、滴片、风干和姬姆萨染色等步骤制得染色体标本;阅片时观察300个细胞,出现畸变记下x和y轴坐标,并记录染色体畸变类型和数量。主要类型包括:无着丝粒畸变(ace)、着丝粒环(r)、双着丝粒体(dic)和多着丝粒染色体。以0 Gy照射组作为对照组。
6.细胞周期检测:56Fe17+、12C6+重离子及60Co γ射线照射后12、24、48 h分别取照射剂量0、0.5、2.0 Gy的细胞,用流式细胞仪检测细胞周期。以0 Gy照射组作为对照组。样品处理详见细胞DNA含量检测试剂盒说明书。每个实验组设3个平行样品。
7.细胞凋亡检测:56Fe17+、12C6+重离子及60Co γ射线照射后12、24、48 h分别取照射剂量0、0.5、2.0 Gy的细胞,用流式细胞仪检测细胞凋亡率。以0 Gy照射组作为对照组。样品处理详见Annexin VFITC/PI染料细胞凋亡试剂盒说明书。每个实验组设3个平行样品。
8. 统计学处理:实验数据以x±s表示。采用IBM SPSS Statistics V21.0软件进行分析。染色体畸变率属于二项分布,故两均数之间比较采用检验;细胞周期、凋亡两组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
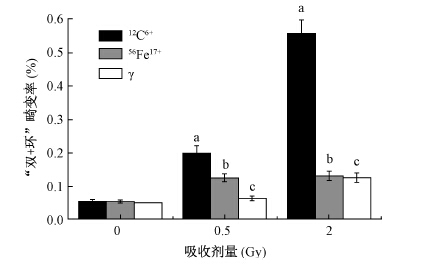
结 果1. 不同品质射线对人淋巴细胞染色体畸变的影响:0.5、2.0 Gy的12C6+重离子、56Fe17+重离子与60Co γ射线照射人淋巴细胞后,48 h诱导的畸变细胞率和“双+环”畸变率逐渐降低,且随着剂量的增加畸变细胞率和“双+环”畸变率逐渐增加。0.5、2.0 Gy的12C6+重离子、56Fe17+重离子与60Co γ射线照射后,畸变细胞率差异有统计学意义(χ2=67.83、322.97、43.46、92.70、12.0.8、61.29,P<0.05,图 1),“双+环”畸变率差异也具有统计学意义(χ2=48.65、205.37、32.68、35.89、4.06、22.84,P<0.05,图 2)。

|
图 1 56Fe17+、12C6+重离子及60Co γ射线照射后48 h畸变细胞率 注:与同一射线0 Gy组比较,aχ2=67.83~322.97,P<0.05; bχ2=43.46~92.70,P<0.05; cχ2=12.0.8~61.29,P<0.05 Figure 1 Percentage of cells with chromosome aberration at 48 h after 56Fe17+,12C6+ion beams and 60Co γray irradiation |
|
图 2 56Fe17+、12C6+重离子及60Co γ射线照射后48 h“双+环”畸变率 注:与同一射线0 Gy组比较,aχ2=48.65~205.37,P<0.05;bχ2=32.68~35.89,P<0.05; cχ2=7.06~22.84,P<0.05 Figure 2 The "d+r" distortion rate at 48 h after 56Fe17+,12C6+ion beams and 60Co γray irradiation |
2. 不同品质射线对人淋巴细胞周期的影响:结果列于表 1。由表 1可知,经0.5、2.0 Gy 56Fe17+重离子照射后12 h,G2期与0 Gy相比,无显著变化(P>0.05),24 h达到最大值(t=-5.98、-9.26,P<0.05),是0 Gy G2期细胞含量的1.72、1.79倍。12C6+重离子照射后在12~48 h均出现细胞周期阻滞(t=-8.27、-8.41、-8.87、-23.99、-9.0.2、-24.11,P<0.05),48 h达到最大,分别是0 Gy的217和422倍。60Co γ射线照射后在12~48 h均出现持续的细胞周期阻滞(t=-13.85、-34.83、-22.01、-80.90、-3.29、-2.81,P<0.05)。56Fe17+、12C6+离子束与60Co γ射线均能诱导人淋巴细胞发生明显的G2期阻滞,12C6+重离子、γ射线及56Fe17+重离子诱导的G2期阻滞程度依次降低。
|
|
表 1 56Fe17+、12C6+重离子及60Co γ射线照射后对细胞周期G2期的影响(%,x±s) Table 1 Effects of 56Fe17+,12C6+ ion beams and 60Co γray irradiation on G2 phase arrest(%,x±s) |
3. 不同品质射线对人淋巴细胞凋亡率的影响:结果列于表 2。由表 2可知,56Fe17+重离子照射后,各剂量组早期凋亡于48 h显著增高(t=-10.92、-19.76,P<0.05)。12C6+重离子照射后各剂量组早期凋亡在24 h达到最大值(t=-10.18、-756,P<0.05),分别是0 Gy的12.7和14.9倍。60Co γ射线照射人淋巴细胞,05 Gy照射后与0 Gy差异无统计学意义(P>0.05),2.0 Gy照射组12~48 h细胞早期凋亡率显著增加(t=-6.28、-2.44、-7.36,P<0.05)。56Fe17+、12C6+离子束与60Co γ射线均能促进细胞凋亡,24 h时2.0 Gy 12C6+重离子、γ射线及56Fe17+重离子诱导的早期凋亡率依次降低。
|
|
表 2 56Fe17+、12C6+重离子及60Co γ射线照射后对早期凋亡率的影响(%,x±s) Table 2 Effects of 56Fe17+,12C6+ ion beams and 60Co γray irradiation on apoptosis induction(%,x±s) |
讨 论
重离子是具有高传能线密度(linear energy transfer,LET)的粒子,与低LET射线(X射线、γ射线)相比较,能在组织内射程末端产生极高的电离密度。传统研究认为,低LET射线造成离散的、简单的单链断裂,而高LET射线可形成团簇损伤,诱导各种复杂、不易修复的单双链断裂、碱基氧化[3]。
重离子等高LET射线可引起更严重的细胞损伤和更复杂的染色体畸变。有研究利用60Co γ射线及LET为29和148 keV/μm的12C6+重离子照射人外周血,发现诱发的淋巴细胞染色体畸变随LET增加而增加[1, 4];Ritter等[5]用Ne粒子和Kr粒子照射V79细胞,也发现淋巴细胞染色体畸变随LET增加而增加。本研究也证实56Fe17+、12C6+离子束诱发的染色体畸变均高于γ射线,这是由于高LET射线电离能力强、粒子径迹特殊,导致高频率的复杂的染色体畸变[6]。但12C6+诱导的畸变细胞率和“双+环”畸变率均高于56Fe17+离子束,这可能与电离事件的饱和机制有关[7]。靶学说观点认为射线必须给靶部位足够的能量才可杀死细胞,稀疏电离辐射的带电离子,其径迹上的电离事件被分散在较长的间距中,同一靶部位发生多于1次的电离事件概率不大,随着LET的增加,径迹上的电离密度增大,靶部位发生的电离事件增多,对细胞的杀伤作用也随之增大[8]。当LET高到一定程度时,致死损伤已经产生,多余的电离事件并不能对杀死细胞作出贡献,而产生“超杀效应”,造成能量的浪费。如果LET射线剂量进一步升高,离子径迹间的几何空间变小,反而不利于电离事件的产生,而使失活效应降低[9]。
电离辐射造成的DNA损伤和染色体畸变,能够激活DNA损伤应答,诱导细胞周期阻滞,这种机制为DNA损伤修复提供时间,避免受损DNA和染色体复制或进入有丝分裂,防止其诱导基因突变和基因组不稳定等[10]。本研究比较了56Fe17+、12C6+离子照射或60Co γ射线照射对人淋巴细胞的影响,发现3种射线均能够诱发明显的G2期阻滞。Brooks等[11]、Rithidech等[12]同样发现,Fe离子照射可造成细胞G2期细胞百分含量上升,大量研究也证实了12C离子束与γ射线均可造成G2期阻滞[13-15],这说明3种射线均可造成细胞损伤从而引起细胞周期阻滞。本研究也比较了高LET 12C6+离子束(26 keV/μm)、56Fe17+离子束(400 keV/μm)和低LET γ射线对细胞周期的影响,发现24 h 2.0 Gy剂量组12C6+重离子、γ射线及56Fe17+重离子造成的阻滞程度依次降低,这可能是高LET射线存在的“超杀效应”,当LET值大于100 keV/μm后,随着LET的增加损伤程度反而降低,因此,56Fe17+离子照射后细胞周期阻滞程度反而低于12C6+。
通常细胞周期阻滞、细胞凋亡是电离辐射造成细胞损伤的应激反应。细胞周期阻滞可引起凋亡,而细胞凋亡也往往伴随有细胞周期阻滞[16]。当DNA损伤发生时,细胞启动调节机制使细胞周期阻滞,待细胞修复这些损伤后,细胞周期恢复运转。当损伤不能被有效修复时可引起细胞的凋亡[17]。细胞凋亡率的高低与时间、照射剂量、射线品质等相关[18]。本研究结果显示,56Fe17+、12C6+离子束和60Co γ射线均能够诱发人淋巴细胞凋亡。有研究报道,12C6+离子束(10.8 keV/μm)诱导的海马组织凋亡率是X射线诱导的10倍[19-20],本研究也发现12C6+离子束凋亡率高于60Co γ射线,这也说明了高LET射线造成的损伤高于低LET射线。本研究还发现,随着LET的增加56Fe17+离子诱导的凋亡率低于12C6+离子,这可能也与上述提到的“超杀效应”相关。另外,p53-p21通路往往与细胞周期阻滞和诱导细胞凋亡有密切的关系,Fournier和TaucherScholz[21]研究结果表明,p21蛋白的表达量不依赖于LET,而Hu等[22]也研究发现,p21基因表达量随着LET的增加而降低,这说明在一定范围内,随着LET的增加细胞凋亡率会下降。
本研究比较不同LET的3种射线对染色体畸变、细胞周期和凋亡的影响,各个检测终点均发现高LET射线存在“超杀效应”,这为进一步研究重离子的损伤机制奠定基础,以进一步提高重离子对肿瘤放射治疗的精确度和评估空间探索的安全性。
利益冲突 研究进行重离子辐射生物效应相关研究,本人与本人家属、其他研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 原雅艺负责淋巴细胞培养、周期凋亡数据的收集及分析、研究论文的撰写;张睿凤、董娟聪负责淋巴细胞培养工作及染色体畸变分析;张忠新负责周期凋亡数据的收集,刘红艳、王超负责照射、染色体畸变实验;段志凯、左雅慧对实验进行指导并对论文进行审查
| [1] | 杜杰, 王治东, 张学清, 等. 重离子12C诱发人淋巴细胞染色体畸变和微核的研究[J]. 中华放射医学与防护杂志 , 2012, 32 (2) : 176-178 Du J, Wang ZD, Zhang XQ, et al. Chromosome aberration and micronucleus formation in human peripheral blood lymphocytes induced by 12C heavy ions[J]. Chin J Radiol Med Prot , 2012, 32 (2) : 176-178 DOI:10.3760/cma.j.issn.0254-5098.2012.02.017 |
| [2] | 魏强, 姜利祥, 刘珊, 等. 空间重离子辐照效应评述[J]. 航天器环境工程 , 2010, 27 (2) : 149-152 Wei Q, Jiang LX, Liu S, et al. A review on space heavy ion irradiation effects[J]. Spa Env Eng , 2010, 27 (2) : 149-152 DOI:10.3969/j.issn.1673-1379.2010.02.004 |
| [3] | Mladenov E, Iliakis G. Induction and repair of DNA double strand breaks:the increasing spectrum of non-homologous end joining pathways[J]. Mutat Res , 2011, 711 (1-2) : 61-72 DOI:10.1016/j.mrfmmm.2011.02.005 |
| [4] | George K, Wu H, Willingham V, et al. High-and low-LET induced chromosome damage in human lymphocytes:a time_course of aberrations in metaphase and interphase[J]. Int J Radiat Biol , 2001, 77 (22) : 175-183 DOI:10.1080/0955300001003760 |
| [5] | Ritter S, Nasonova E, Gudowska NE. Effect of LET on the yield and quality of chromosomal damage in metaphase cells:a time course study[J]. Int J Radiat Biol , 2002, 78 (3) : 191-202 DOI:10.1080/09553000110097217 |
| [6] | Moquet JE, Fernandez JL, Edwards AA, et al. Lymphocyte chromosomal aberrations and their complexity induced in vitro by plutonium-239 alpha-particles and detected by FISH[J]. Cell Mol Biol , 2001, 47 (3) : 549-556 |
| [7] | Suzuki M, Watanabe M, Kanai T, et al. LET dependence of cell death,mutation induction and chromatin damage in human cells irradiated with accelerated carbon ions[J]. Adv Space Res , 1996, 18 (1-2) : 127-136 DOI:10.1016/0273-1177(95)00799-K |
| [8] | 夏寿萱. 放射生物学[M]. 北京: 军事医学科学出版社, 1998 : 16 -20. Xia SX. Radiation biology[M]. Beijing: Military Medical Science Press, 1998 : 16 -20. |
| [9] | 董娟聪, 刘红艳, 党旭红, 等. 12C重离子与γ射线对淋巴细胞Peng-EBV增殖、细胞周期及凋亡影响的比较[J]. 国际放射医学核医学杂志 , 2015, 39 (5) : 385-388 Dong JC, Liu HY, Dang XH, et al. Effects of 12C heavy ion and γ-ray irradiation in cell growth,cell cycle and apoptosis of human peripheral blood lymphocytes[J]. Int J Radiat Med Nucl Med , 2015, 39 (5) : 385-388 DOI:10.3760/cma.j.issn.1673-4114.2015.05.007 |
| [10] | Pang D, Winters TA, Jung M, et al. Radiation-generated short DNA fragments may perturb non-homologousend-joining and induce genomic instability[J]. J Radiat Res , 2011, 52 (3) : 309-319 DOI:10.1269/jrr.10147 |
| [11] | Brooks AL, Bao S, Rithidech K. Induction and repair of HZE induced cytogenetic damage[J]. Phys Med , 2001, 17 (1) : 183-184 |
| [12] | Rithidech KN, Golightly M, Whorton E. Analysis of Cell cycle in mouse bone marrow cells following acute in vivo exposure to 56Fe17+ ions[J]. J Radiat Res , 2008, 49 (4) : 437-43 DOI:10.1269/jrr.07109 |
| [13] | Ghorai A, Bhattacharyya NP, Sarma A. Radiosensitivity and induction of apoptosis by high let carbon ion beam and low let gamma radiation:a comparative study[J]. Scientifica , 2014 (6) : 438030-438030 DOI:10.1155/2014/438030 |
| [14] | Ma J, Ye L, Da M. Heavy ion irradiation increases apoptosis and STAT-3 expression,led to the cells arrested at G2/M phase in human hepatoma SMMC-7721 cells[J]. Mol Cell Biochem , 2009, 328 (1-2) : 17-23 DOI:10.1007/s11010-009-0069-6 |
| [15] | Bae Y, Jung SH, Kim GY. Hip2 ubiquitin-conjugating enzyme overcomes radiation-induced G2/M arrest[J]. Biochim Biophys Acta , 2013, 1833 (12) : 2911-2921 DOI:10.1016/j.bbamcr.2013.07.023 |
| [16] | Cuadrado M, Martinez-Pastor B, Murga M, et al. ATM regulates ATR chromatin loading in response to DNA double-strand breaks[J]. J Exp Med , 2006, 203 (2) : 297-303 DOI:10.1084/jem.20051923 |
| [17] | 蒋满荣.DNA损伤对哺乳动物细胞周期和凋亡的影响[D].上海:中国科学院上海生命科学研究院生物化学与细胞生物学研究所,2004. Jiang MR.Effects of DNA damage on cell cycle and apoptosis of mammalian cells[D].Shanghai:Shanghai Institutes for Biochemistry and Cell Biology,2004. |
| [18] | 谢大兴, 冯永东, 张鹏, 等. 不同剂量X射线对细胞周期检测点和细胞凋亡的影响[J]. 中华实验外科杂志 , 2005, 7 (22) : 798-800 Xie DX, Feng YD, Zhang P, et al. Influence on checkpoints and cell apoptosis induced by different dosage of X-ray[J]. Chin J Exp Surg , 2005, 7 (22) : 798-800 DOI:10.3760/j.issn:1001-9030.2005.07.012 |
| [19] | Koji T, Takashi M, Yukihiro T. Cell cycle checkpoint and apoptosis induction in glioblastoma cells and fibroblasts irradiated with carbon beam[J]. J Radiat Res , 2007, 48 (4) : 317-325 DOI:10.1269/jrr.06081 |
| [20] | Takuya K, Yoshiyuki S, Katsuyuki S. Effectiveness of carbon-ion beams for apoptosis induction in rat primary immature hippocampal neurons[J]. J Radiat Res , 2010, 51 (6) : 627-631 DOI:10.1269/jrr.10050 |
| [21] | Fournier C, Taucher-Scholz G. Radiation induced cell cycle arrest:an overview of specific effects following high-LET exposure[J]. Radiother Oncol , 2004, 73 (2) : 119-122 DOI:10.1093/ije/29.1.65 |
| [22] | Hu Y, Hellweg CE, Baumstark-Khan C. Cell cycle delay in murine pre-osteoblasts is more pronounced after exposure to high-LET compared to low-LET radiation[J]. Radiat Environ Biophys , 2014, 53 (1) : 1-9 DOI:10.1007/s00411-013-0499-0 |
 2016, Vol. 36
2016, Vol. 36


