2. 730000 兰州大学 ;
3. 730030 兰州, 中国科学院近代物理研究所
2. Lanzhou University, Lanzhou 730000, China ;
3. Institute of Modern Physics, Chinese Academy of Sciences, Lanzhou 730000, China
非小细胞肺癌(nonsmall cell lung cancer,NSCLC)是肺癌的主要组织学类型,约占85%。放射治疗是NSCLC综合治疗的重要手段之一。常规的X射线和γ射线等治疗时对正常组织尤其是肺的放射损伤,已成为肺癌放射治疗的剂量限制因素。碳离子束为高LET射线,具有独特放射物理和生物学特性,可望提高肺癌的放疗效果。放疗的疗效与肿瘤细胞对放疗射线的敏感性有关。NSCLC细胞对X射线的敏感性多有报道[14],但重离子对细胞放射敏感性的影响有待进一步研究。本研究分析了12C6+对不同NSCLC细胞生物效应的影响,以期为碳离子束治疗肺癌的临床应用提供基础。
材料与方法1. 细胞培养:肺腺癌A549细胞、鳞癌H520细胞和大细胞癌PGCL3细胞购于美国标准生物品收藏中心(American Type Culture Collection,ATCC),在含10% FBS的DMEM培养基(美国GIBCO公司)中培养。置于90%湿度、37℃ 5%的CO2细胞培养箱中保持指数生长,每2天传代1次。
2. 照射条件:在中国科学院近代物理研究所深层治疗终端(HIRFLCSR),采用300 MeV能量、1 Gy/min 剂量率的12C6+离子对细胞进行照射,展宽布拉格峰为5 mm,照射野为 5 cm×5 cm。分别给予细胞0、2、4、6 Gy 的照射剂量,每个剂量点设置3个平行样。
3. 克隆形成实验:收集对数生长期的细胞,弃上层培养液,加入2 ml PBS重复清洗3次,加入05 ml 025%胰酶,置于湿度90%,37℃,5%CO2细胞培养箱内,对贴壁的细胞消化1 min。当瓶内细胞趋于圆形时,弃胰酶,加入DMEM培养液2 ml,吹打成单细胞悬液。调整细胞浓度后,将细胞分别种在100 mm的培养皿中,每个剂量点分别梯度接种1 000、800 和500个细胞作为3个平行重复,贴壁后进行照射。10 d后,吸掉培养皿上层培养液,5 ml PBS缓慢清洗细胞2~3次,无水乙醇固定20 min,姬姆萨染色30 min。统计≥50个细胞的克隆数,计算细胞存活分数,并采用多靶单击模型拟合存活曲线。公式如下:细胞存活分数=受照射细胞的克隆数/对照细胞的克隆数。
4. 流式细胞仪检测细胞周期分布:取对数生长期细胞照射后,置于湿度90%,37℃,5%的CO2细胞培养箱中。48 h后,2 ml PBS清洗细胞2~3次,细胞消化后制成单细胞悬液,2 000 r/min离心5 min,离心半径10 cm,弃上清,洗净残留培养基。边涡旋振荡,边加入预冷的70%乙醇,充分固定,-20℃下保存过夜。相同方法离心,弃乙醇,PBS清洗并离心2次,室温条件下以1×10 6/ml浓度悬于PI染色液(美国Sigma公司,含5 μg/ml PI、10 kU/ml RNase A和0.005% Triton X-100的PBS)中,避光保存 30 min。流式细胞仪(美国BD公司)检测染色样本,收集10 000个细胞,所采集数据通过Flowjo7.6.1软件分析细胞周期分布。
5. Hoechst 33258染色:收集对数生长期的细胞,倒掉培养瓶上层DMEM培养液,加入2 ml PBS重复清洗3次,消化细胞制成单细胞悬液后调整细胞浓度,种入含洁净无菌盖玻片的6孔板内。待细胞贴壁后进行照射,照射后置于细胞培养箱中。48 h后取出6孔板,弃DMEM培养液,1 ml PBS清洗3次,加入固定液(甲醇∶冰乙酸=3∶1)固定5 min,弃培养液,PBS清洗干净。滴加Hoechst 33258染色液(江苏碧云天生物技术研究所),避光染色20 min,流水冲洗干净。在洁净干燥的载玻片上,滴加抗荧光淬灭剂10 μl,取出盖玻片,并将盖玻片种有细胞的一面朝下盖在载玻片上。荧光显微镜下观察、拍照。被Hoechst 33258浓染的细胞核为凋亡的细胞核,计数并计算凋亡率,凋亡率(%)=(视野内凋亡细胞数/视野内总细胞数)×100%。
6. 实时RTPCR检测DNAPKcs mRNA表达:收集对数生长期细胞,12C6+离子照射后,置于湿度90%、37℃、5%的CO2细胞培养箱中。48 h后,取出细胞,提取细胞内总的RNA,按TRIzol试剂(美国Invitrogen公司)说明书,使用反转录试剂盒,将RNA反转录为cDNA,总体积为20 μl。使用SYBR Green荧光染料(日本TaKaRa公司)作为检测信号,在FTC3000 qPCR仪(德国Eppendorf公司)上进行实时RTPCR扩增。采用二步法进行扩增,PCR 扩增条件:95℃,30 s预热;95℃,5 s;59℃,30 s,共 40个循环。每对引物均由日本TaKaRa公司合成, DNAPKcs上游引物为5′AGGGAAGAAGAGTCTCTGGTGG 3′,下游引物为5′ATTAGGGGATCTGTTGCCTGGC 3′;GAPDH 上游引物为5′ TGCCATCAACGACCCCTTCA 3′,下游引物为5′ TGACCTTGCCCACAGCCTTG 3′。每个PCR 重复3次,所得数据采用相对定量法(△△Ct)进行分析,DNAPKcs 的表达变化以相对量表示,即以0 Gy对照样品的mRNA表达量作为参照定为1,其他样品均为对照样品的倍数。
7. 统计学处理:数据用x±s形式表示。采用SPSS 16.0软件进行分析,组间比较采用t检验。P<0.05为差异有统计学意义。
结果1.12C6+离子照射对NSCLC细胞存活率的影响:随着照射剂量的升高,3种细胞的存活率均呈现下降的趋势(图 1)。相同剂量下,A549细胞的存活率明显高于PGCL3和H520细胞,H520细胞的存活率最低(t=4.329、2.976、3.860,P<0.05)。
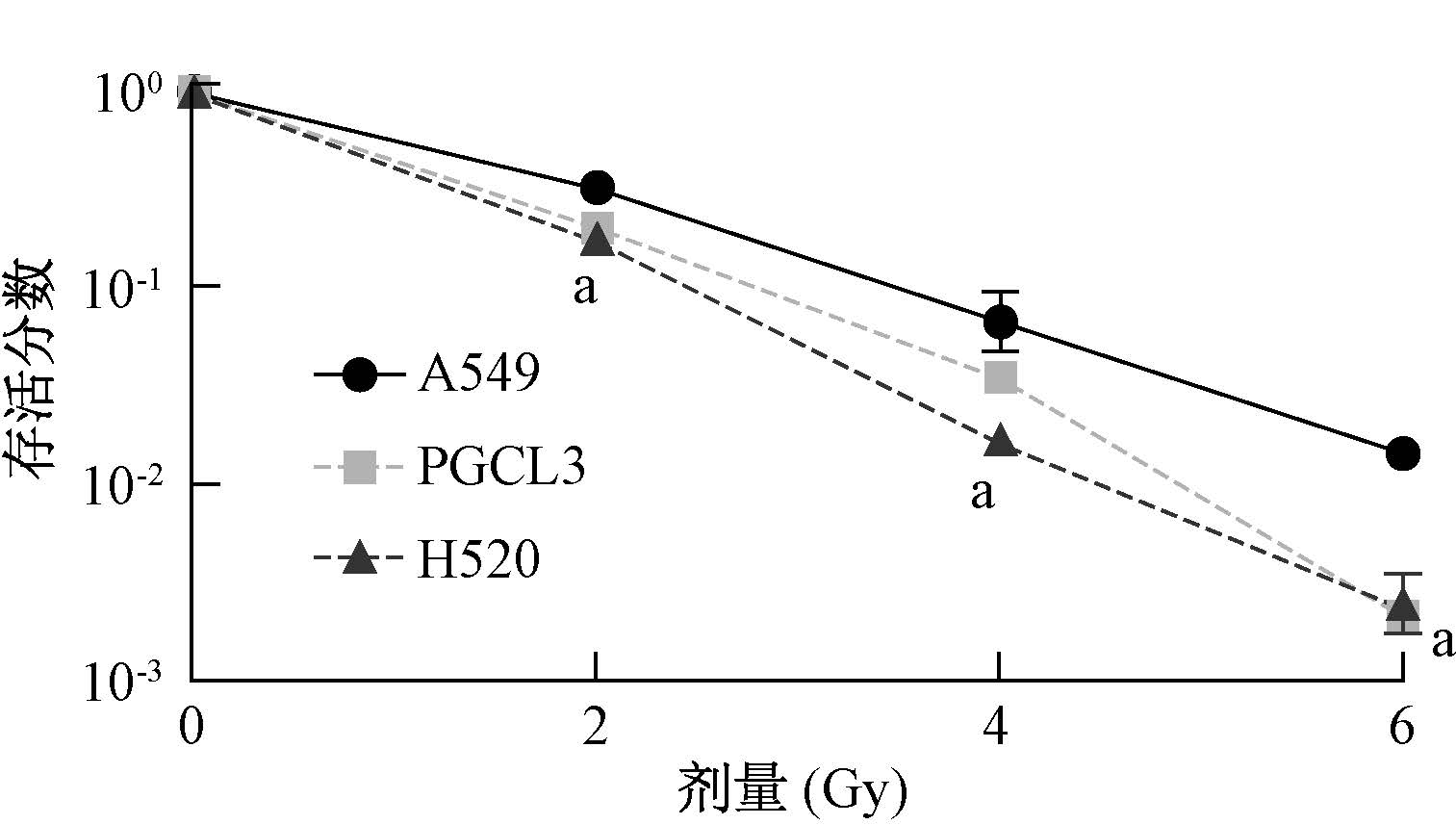
|
图 1 不同剂量12C6+离子照射对细胞存活的影响 注: a H520与同一剂量A549比较,t=4.329、2.976、3.860,P<0.05 Figure 1 Effect of carbon ion radiation on cell survival fraction |
2.12C6+离子照射对NSCLC细胞周期的影响:不同剂量照射后,3种细胞周期分布改变(表 1),均出现了G2/M期阻滞。随着剂量的升高,细胞G2/M期阻滞率均呈现上升的趋势,与剂量成正相关。相同剂量下,A549细胞的G2/M期阻滞率明显低于PGCL3(t=2790、2977,P<0.05)和H520 细胞(t=4813、20738、25654,P<0.05),H520细胞的G2/M期阻滞率最高。
|
|
表 1 不同剂量12C6+离子照射后细胞周期分布的改变(%,x±s) Table 1 Cell cycle distribution of NSCLC cells after carbon ion irradiation(%,x±s) |
3.12C6+离子照射对NSCLC细胞凋亡的影响:通过Hoechst 33258染色实验检测细胞凋亡。显微镜下观察发现,发生凋亡的细胞的细胞核形态已经改变,其共同特征是核固缩、核碎裂等。在离子照射后,细胞凋亡随着照射剂量的增加明显提高。相同剂量下A549细胞发生凋亡的数量最少,凋亡率最低;PGCL3细胞的凋亡率居中;H520细胞的凋亡率最高(图 2)。
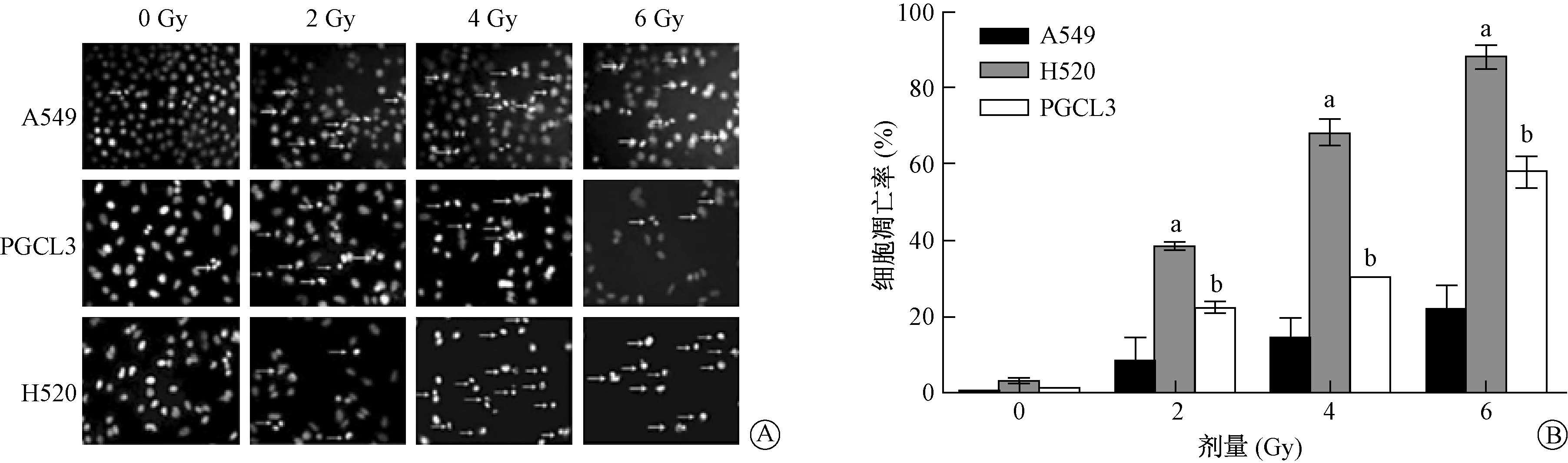
|
图 2 不同剂量12C6+离子照射对细胞凋亡的影响 A. 细胞受照后Hoechst 33258染色结果;B.细胞受照后的凋亡率 注:与同一剂量A549细胞相比,at=8579、14289、15244,P<0.05;t=3.785、5.098、8.105,P<0.05 Figure 2 Effect of carbon ion irradiation on cell apoptosis A. Hoechst33258 staining of A549 cells exposed to carbon ions; B. cell apoptosis induction after carbon ion irradiation |
4. 12C6+ 离子照射对NSCLC细胞DNAPKcs转录水平的影响:细胞受照后DNAPKcs均表达上调,A549细胞最高,其次是PGCL3细胞,H520细胞最低。但随着剂量的升高,DNAPKcs的表达呈下降趋势,与剂量成负相关。2、4 Gy照射后A549细胞DNAPKcs的表达明显高于H520(t=7.782、3.689,P<0.05)和PGCL3(t=3.889、2.814,P<0.05,图 3)。
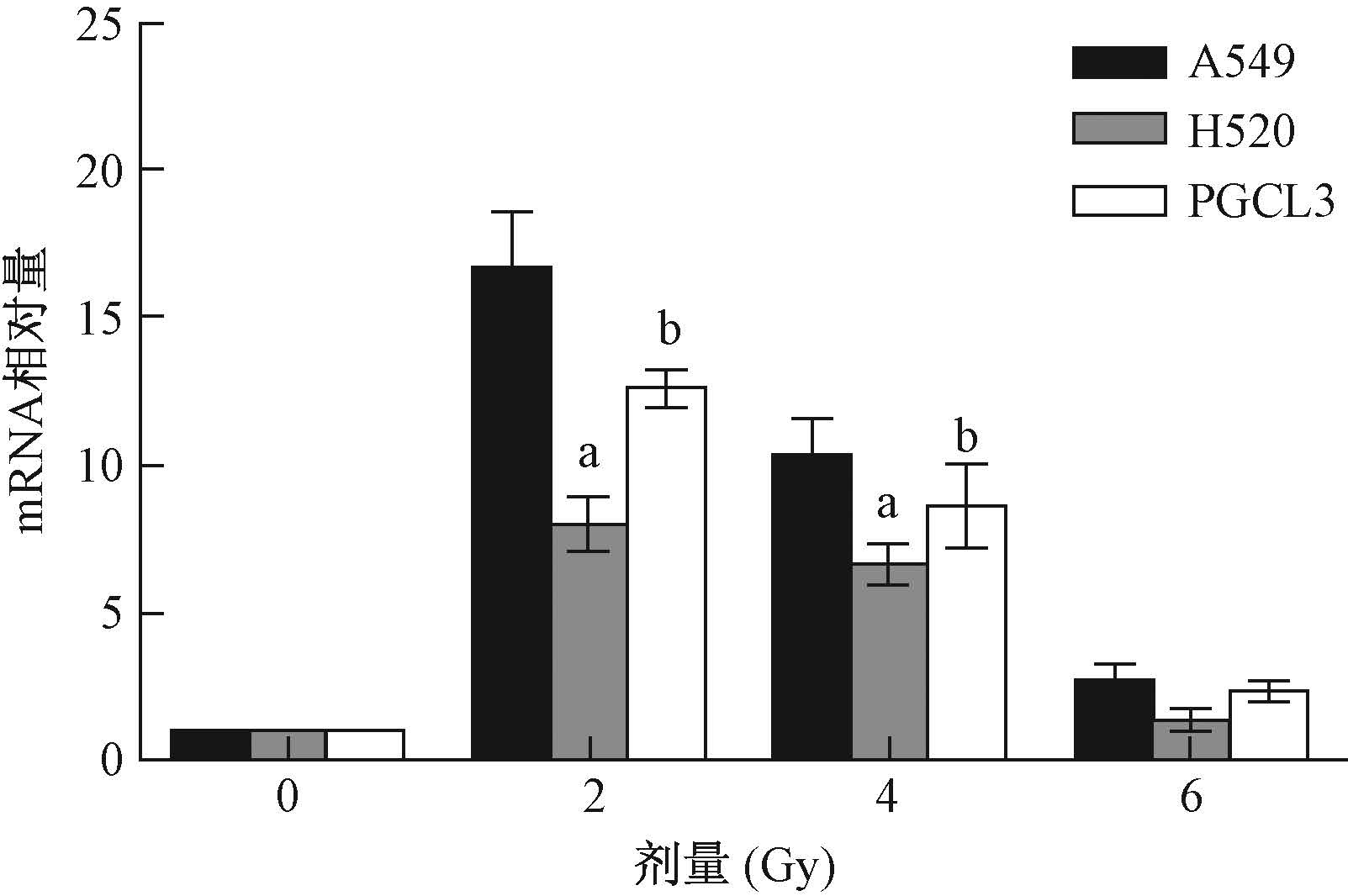
|
图 3 不同剂量12C6+离子照射对细胞内DNAPKcs mRNA表达的影响 注:与同一剂量A549细胞相比,at=7.782、3.689,P<0.05; bt=3.889、2.814,P<0.05 Figure 3 Effect of carbon ion irradiation on the expression of DNAPKcs mRNA of NSCLC cells |
讨论
细胞的放射敏感性是放射肿瘤学的研究焦点之一,探讨细胞放射敏感性的分子遗传机制,以提高肿瘤细胞对射线的敏感性,对于提高肿瘤放疗疗效和保护正常组织不受照射损伤具有极其重要的意义。细胞的放射敏感性可以采用多种指标表示,如细胞存活率、细胞增殖情况和细胞微核频率等。由克隆形成率计算出的细胞存活率是最为常用的一种评价手段,以SF2最为典型,且细胞的照射敏感性与存活率呈负相关[5]。本研究中的细胞存活曲线显示,12C6+离子照射后,3种细胞的存活率与剂量呈负相关,且在相同剂量下,A549细胞的存活率最高,PGCL3 细胞的存活率居中,H520细胞的存活率最低。说明腺癌A549细胞的放射敏感性最低,放射抗性最高;鳞癌H520细胞的放照射敏感性最高,放照射抗性最低;大细胞癌PGCL3细胞的放照射敏感性居中。
早期研究结果显示,电离照射会引起细胞发生G1/S或G2/M期阻滞,G1/S期阻滞阻止受损伤的 DNA进行复制,G2/M期阻滞阻止含有DNA损伤的细胞进行分裂,不同的细胞周期阻滞都起到一种保护作用[6-7]。如果细胞周期在延长后回归正常周期运转,那么DNA 损伤就会得到修复,细胞会减慢增殖;如果细胞周期在G1/S或G2/M期停滞后损伤依旧得不到修复,便会引起细胞的凋亡。X射线照射后诱导肝癌(HepG2)和乳腺癌(MCF7,MDAMB231)细胞产生大量的G2/M期阻滞和细胞凋亡[8-9]。本研究结果表明,碳离子照射后,3种非小细胞肺癌细胞均出现G2/M期阻滞,其阻滞率与剂量呈正相关,剂量越高,处于G2/M期的细胞越多。阻滞率从高到低依次为H520、PGCL3、A549细胞。碳离子照射后,发生凋亡的细胞数量也与剂量呈正相关,剂量越大凋亡的细胞越多,如此之高的凋亡率说明,12C6+离子对细胞所造成的损伤并没有完全修复。
12C6+离子作为高LET射线,引起的复杂DNA损伤和双链断裂(double strand break,DSB)修复蛋白表达水平变化可通过抑制非同 源 重 组(homologous recombination,HR)和非同源末端连接(nonhomologous end joining,NHEJ)修复而影响细胞放射敏感性。DNAPKcs属于PI3K蛋白家族,参与细胞内多种生理生化反应,例如,参与DNA双链断裂(DSBs)修复的非同源末端连接(NHEJ)途径,维持端粒的结构,调节细胞周期阻滞,是参与放射敏感性的相关因子[10-13]。其中,DNAPKcs 参与NHEJ修复途径进行DSBs修复是其生物学最主要任务之一。本研究中,12C6+离子照射上调了3种细胞DNAPKcs的表达,但随着剂量的升高,DNAPKcs mRNA表达呈下降趋势。每种细胞在不同剂量照射后的 DNAPKcs表达变化较大,所以,DNAPKcs与细胞放射敏感性之间存在一定的关系,导致细胞应对高LET 12C6+离子时产生不同生物学反应。上述结果提示:①较低剂量2 Gy照射诱导DNAPKcs的表达较高,所介导的NHEJ修复也相对较多,在离子照射引发的细胞周期阻滞所持续的时间里,修复的DSBs也多,细胞凋亡就少,细胞存活与增殖能力就强,细胞的放射敏感性就低。②较高剂量6 Gy照射诱导DNAPKcs的表达较低,所介导的NHEJ 修复也相对较少,在离子照射引发的细胞周期阻滞后,修复的 DSBs 也少,细胞凋亡就多。所以,DNAPKcs的大量表达介导了NHEJ途径对DNA损伤进行修复,这对于维持基因组的完整性和稳定性是至关重要的,而NHEJ修复途径的缺失将导致细胞出现死亡[14]。
综上所述,12C6+离子照照射后,腺癌A549细胞的放射敏感性最低,鳞癌 H520细胞放射敏感性最高。12C6+离子照射后,上调的 DNA-PKcs 会通过NHEJ途径对DSBs进行修复,这可能是导致 A549 细胞放射敏感性低的原因之一。不同细胞系的12C6+离子放射敏感性及其可能机制的研究,为重离子治疗肺癌的临床研究提供放射生物学基础,为今后开展重离子治疗肺癌的个体化、精准治疗提供理论依据。
利益冲突 本人与其他作者以及基金无任何利益冲突作者贡献声明 张秋宁、王小虎负责论文的设计、撰写和修改;杨震、杨新瑞、张莲兴负责论文实验的操作、数据的初步统计和分析;陈新年、张红负责论文的修改;王涛、郭红云负责实验数据的质量控制和数据分析
| [1] | Lan F, Yue X, Ren G, et al. MiR-15a/16 enhances radiation sensitivity of non-small cell lung cancer cells by targeting the TLR1/NF-κB signaling pathway[J]. Int J Radiat Oncol Biol Phys , 2015, 91 (1) : 73-81 DOI:10.1016/j.ijrobp.2014.09.021 |
| [2] | Kriegs M, Gurtner K, Can Y, et al. Radiosensitization of NSCLC cells by EGFR inhibition is the result of an enhanced p53-dependent G1 arrest[J]. Radiother Oncol , 2015, 115 (1) : 120-127 DOI:10.1016/j.radonc.2015.02.018 |
| [3] | Meng MB, Wang HH, Guo WH, et al. Targeting pyruvate kinase M2 contributes to radiosensitivity of non-small cell lung cancer cells in vitro and in vivo[J]. Cancer Lett , 2015, 356 (2 Pt B) : 985-993 DOI:10.1016/j.canlet.2014.11.016 |
| [4] | 潘牋, 李伟雄, 李俊铭, 等. 不同非小细胞肺癌细胞株中DNA-PKcs的表达及其与放射敏感性的关系[J]. 癌症 , 2009, 28 (7) : 714-717 Pan Y, Li WX, Li JM, et al. Correlation of DNA-dependent protein kinase catalytic subunit expression to radiosensitivity of non-small cell lung cancer cell lines[J]. Chin J Cancer , 2009, 28 (7) : 714-717 DOI:10.3321/j.issn:1000-467X.2009.07.008 |
| [5] | Deschavanne PJ, Fertil B. A review of human cell radiosensitivity in vitro[J]. Int J Radiat Oncol Biol Phys , 1996, 34 (1) : 251-266 DOI:10.1016/0360-3016(95)02029-2 |
| [6] | Nagasawa H, Keng P, Harley R, et al. Relationship between gamma-ray-induced G2/M delay and cellular radiosensitivity[J]. Int J Radiat Oncol Biol Phys , 1994, 66 (4) : 373-379 DOI:10.1080/09553009414551311 |
| [7] | Mitsuhashi N, Takahashi T, Sakurai H, et al. A radioresistant variant cell line,NMT-1R,isolated from a radiosensitive rat yolk sac tumour cell line,NMT-1:differences of early radiation-induced morphological changes,especially apoptosis[J]. Int J Radiat Oncol Biol Phys , 1996, 69 (3) : 329-36 DOI:10.1080/095530096145887 |
| [8] | Sun C, Zhang H, Ma XF, et al. Isoliquiritigenin enhances radiosensitivity of HepG2 cells via disturbance of redox status[J]. Cell Biochem Biophys , 2013, 65 (3) : 433-444 DOI:10.1007/s12013-012-9447-x |
| [9] | Liu X, Sun C, Jin X, et al. Genistein enhances the radiosensitivity of breast cancer cells via G2/M cell cycle arrest and apoptosis[J]. Molecules , 2013, 18 (11) : 13200-13217 DOI:10.3390/molecules181113200 |
| [10] | Dip R, Naegeli H. More than just strand breaks:the recognition of structural DNA discontinuities by DNA-dependent protein kinase catalytic subunit[J]. FASEB J , 2005, 19 (7) : 704-715 DOI:10.1096/fj.04-3041rev |
| [11] | Zhou X, Zhang X, Xie Y, et al. DNA-PKcs inhibition sensitizes cancer cells to carbon-ion irradiation via telomere capping disruption[J]. PLoS One , 2013, 8 (8) : e72641 DOI:10.1371/journal.pone.0072641 |
| [12] | An J, Huang YC, Xu QZ, et al. DNA-PKcs plays a dominant role in the regulation of H2AX phosphorylation in response to DNA damage and cell cycle progression[J]. BMC Mol Biol , 2010, 11 : 18 DOI:10.1186/1471-2199-11-18 |
| [13] | Shang ZF, Huang B, Xu QZ, et al. Inactivation of DNA-dependent protein kinase leads to spindle disruption and mitotic catastrophe with attenuated checkpoint protein 2 Phosphorylation in response to DNA damage[J]. Cancer Res , 2010, 70 (9) : 3657-3666 DOI:10.1158/0008-5472.CAN-09-3362 |
| [14] | Ferguson DO, Sekiguchi JM, Frank KM, et al. The interplay between nonhomologous end-joining and cell cycle checkpoint factors in development,genomic stability,and tumorigenesis[J]. Cold Spring Harbor Symp Quant Biol , 2000, 65 : 395-403 DOI:10.1101/sqb.2000.65.395 |
 2016, Vol. 36
2016, Vol. 36


