放射治疗是食管癌主要治疗手段之一。研究表明,食管癌中存在乏氧微环境。乏氧微环境既增强肿瘤组织血管增生和侵袭、转移能力,也介导放、化疗抵抗,是导致食管癌放疗后局部复发的关键因素之一[1-3]。乏氧环境中,乏氧诱导因子(hypoxia induced factor,HIF-1)过表达,介导下游百余个效应基因的转录[4],使乏氧的肿瘤组织逃避射线杀伤,降低肿瘤细胞中的HIF-1α能增加放射敏感性[5]。有文献报道,黄连素通过抑制HIF-1α,改善微环境,进而增加肿瘤的放射敏感性[6-7]。同时有研究表明,STAT3可以调控HIF-1的表达[8],Stattic是STAT3的特异性抑制剂。因此,提出假设,Stattic通过抑制食管癌细胞内STAT3的表达,下调下游因子HIF-1及血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达,进而抑制肿瘤血管生成和诱导凋亡,增加食管鳞癌放射敏感性。本研究可为Stattic在食管癌放射治疗中的应用提供实验依据。
材料与方法1.药物及试剂:Stattic(美国Sigma公司)用二甲基亚砜(DMSO)配成储存液,4℃冰箱保存,RPMI 1640(美国GIBCO公司)培养基稀释,DMSO(美国Sigma公司)的终浓度为0.1%。
2.细胞培养及处理:人食管癌ECA109细胞购自上海细胞所,用含10%小牛血清的RPMI 1640培养液(含青霉素100 U/ml和链霉素100 μg/ml)培养细胞。细胞常氧环境的培养条件为恒温37℃、5%CO2、20%O2和75% N2,细胞乏氧环境的培养条件为恒温37℃、5%CO2、1% O2和94% N2。取对数生长期细胞进行实验。
3.细胞照射:实验组细胞在室温下用X射线加速器照射,源靶距100 cm,平均剂量率5.66 Gy/min。根据实验需要,选择不同剂量0、2、4、6和8 Gy。照射后置培养箱内培养。
4.四甲基偶氮唑盐比色法(MTT)实验:收集对数期生长细胞,胰酶消化计数,接种于96孔板,每孔100 μl,每孔细胞数约4 000个。置37℃、5%CO2温箱培养使细胞贴壁,培养24 h后,加入不同浓度的Stattic,每种浓度设6个平行样,继续培养24、48和72 h后,小心吸去上清,加入90 μl新鲜RPMI 1640培养液,再加入10 μl MTT溶液(5 mg/ml,即0.5%MTT),继续培养4 h,吸去上清,每孔加入150 μl DMSO,置摇床上低速振荡10 min,使结晶物充分溶解,在酶联免疫检测仪490 nm处测量各孔的吸光度(A)值。实验重复3次,取其平均值。以药物浓度为横坐标,存活分数为纵坐标,绘制药物浓度-效应曲线,推算出Stattic的半数致死剂量(IC50)。
5.克隆形成实验:收集对数期生长期的细胞,胰酶消化计数,稀释后将细胞接种于5块6孔板,每块6孔板接受不同的照射剂量,根据不同的照射剂量(0、2、4、6和8 Gy)分别接种相应数目细胞(200、400、800、2 000和4 000个/孔),每个样均设置3个复孔,常氧或乏氧24 h后行照射,弃上清,PBS洗3次,置37℃、5%CO2温箱培养14 d,克隆形成之后,弃去培养基,PBS洗3次,加无水甲醇1 ml/孔,固定10 min后弃去甲醇,姬姆萨染色15 min后,流动水缓慢洗去染液,通风处晾干,计数细胞集落数(计数≥50个细胞的集落),计算克隆形成率(PE,%)=(克隆数/接种细胞数)×100%。细胞存活分数(SF)=某一剂量照射组的克隆数/(该组细胞接种数×未照射组克隆形成率)。按照单击多靶模型SF=1-(1-e-D/Do)N拟合细胞存活曲线,计算放射敏感性参数SF2、D0、Dq及N值。
6.γ-H2AX免疫荧光染色法检测不同时间点下ECA109细胞中双键断裂情况:取对数生长期细胞,经Stattic(1.0 μmol/L)+照射(1 Gy)处理后0.5、4、12和24 h,对照组为单纯照射(1 Gy)相应的时间点时用免疫荧光固定液固定0.5 h,PBS洗3次,甲醇置-20℃破膜10 min,PBS洗3次,封闭液封闭1 h后,一抗(γ-H2AX稀释至1∶250)4℃孵育过夜,PBS洗3次,FITC标记二抗(二抗稀释到1∶150)室温孵育1.5 h(避光),PBS洗3次,DAPI(用甲醇稀释至1∶35)染核5 min,PBS洗3次,封闭剂封片后使用激光共聚焦显微镜检测。
7.流式细胞术检测细胞凋亡率:实验分为对照组、给药组、单纯照射组、照射给药组。给药组在乏氧环境中予Stattic(1.0 μmol/L)作用24 h,继续孵育24 h,给药照射组在乏氧环境中予Stattic(1.0 μmol/L)作用24 h后给予6 Gy照射,照射后PBS漂洗,继续孵育24 h。将消化后的细胞用PBS洗2次,70%的乙醇2 ml固定,4℃过夜,流式细胞仪送检,分设3个平行样本。
8.Western blot法检测STAT3、HIF-1α、VEGF蛋白的表达:实验依据要求分组,各自处理后收样时通过SDS裂解法抽提细胞总蛋白后,各种蛋白约取22 μg,SDS-PAGE电泳约45 min,HIF-1α转膜350 mA/cm2 恒流电2.5 h,VEGF转膜300 mA/cm2 恒流电1.0 h[0.45硝酸纤维素滤膜(美国Bio Rad公司)]后,10%脱脂牛奶封闭,一抗(STAT3抗体1∶500稀释,HIF-1α抗体1∶500稀释,VEGF抗体1∶250稀释,β-肌动蛋白抗体1∶250稀释)4℃孵育过夜,PBS洗3次,二抗(鼠抗、羊抗)1∶2 000稀释,室温孵育1 h,TBST漂洗5 min×3次,然后用增强化学发光(ECL)试剂盒曝光显影。
9.统计学处理:数据以x±s表示,实验重复3次,每次设≥3个平行样,结果取平均值。实验数据用Graph Pad软件和SPSS 16.0软件按常用的几种模型进行曲线拟合分析,经残差平方和计算后,认为本实验以"单击多靶模型"较合适,即选用SF=1-(1-e-D/Do)N进行曲线拟合分析。组间分析用t检验。P < 0.05为差异有统计学意义。
结果1.Stattic对细胞的药物毒性:ECA109细胞受1.0 μmol/L浓度的Stattic作用24、48和72 h,随着药物浓度的增加及药物作用时间的延长,Stattic对食管癌ECA109细胞的抑制程度增加,呈现出剂量-效应关系以及剂量-时间关系。Stattic作用24 h,Stattic对ECA109细胞的IC50为5.499 μmol/L,IC80为1.708 μmol/L,根据生存率结果选择生存率超过80%的Stattic浓度为0.5和1.0 μmol/L,继续后续实验。
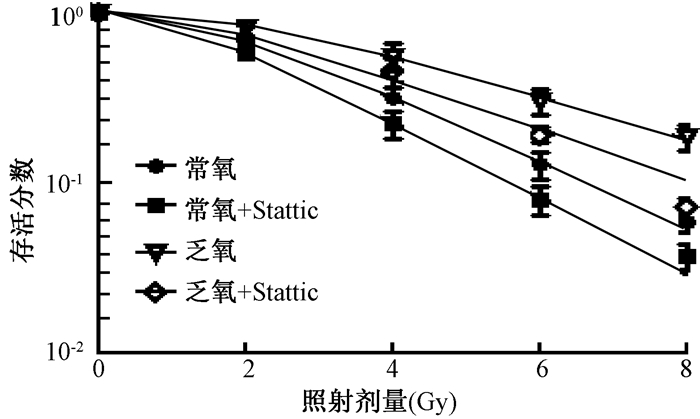
2.Stattic对ECA109细胞的放射增敏作用:1.0 μmol/L Stattic作用常氧或乏氧ECA109细胞24 h后,能提高细胞放射敏感性。通过单击多靶模型拟合细胞的存活曲线(图 1),计算出1.0 μmol/L Stattic的放射增敏比SERDo分别为1.20(常氧)和1.28(乏氧)(表 1),由此可见,Stattic对乏氧的ECA109细胞具有放疗增敏作用。
|
|
表 1 ECA109细胞各组单击多靶模型拟合曲线的生物学参数 Table 1 Theradiosensitization of Stattic in ECA109 cells |
|
图 1 克隆形成实验检测 Figure 1 Clonogenic survival assay |
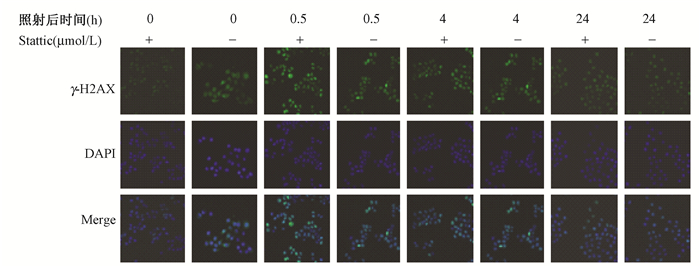
3.γ-H2AX荧光染色:对照组ECA109细胞中仅见4.3%的双键断裂, 照射后0、0.5、4和24 h的双键断裂比例分别为4.3%、8.5%、72%和6.1%,Stattic处理后照射0、0.5、4和24 h的双键断裂比例分别为5.3%、61.5%、75.9%和22.3%,见图 2。Stattic能增加双键断裂,尤其是在照射之后0.5 h最为明显。
|
图 2 不同状态下的ECA109细胞中双键断裂情况 Figure 2 Stattic enhances IR induced generation of DSBs in ECA109 cells |
4.流式细胞仪检测Stattic对ECA109(6 Gy)细胞凋亡的影响:流式细胞术检测显示,乏氧环境下1.0 μmol/L Stattic作用24 h能单独诱导细胞的凋亡(t=3.23,P < 0.05),6 Gy X射线能单独诱导细胞的凋亡(t=9.31,P < 0.05),同时,给药照射组凋亡率高于单纯照射组(t=7.33,P < 0.05,表 2)。
5. 细胞pSTAT3、STAT3、HIF-1α和VEGF蛋白表达结果:结果示于图 3。由图 3可见,乏氧培养0、6、12、24和48 h后,pSTAT3、HIF-1α及VEGF的表达水平显著高于常氧培养组,其中以乏氧24 h蛋白表达量最高,据此乏氧条件下细胞给予Stattic(0.5、1.0 μmol/L)分别作用24 h后,pSTAT3、HIF-1α及VEGF表达量降低,但仍然高于常氧下表达量,Stattic对pSTAT3、HIF-1α和VEGF表达有抑制作用。
|
|
表 2 乏氧环境下Stattic联合6 Gy X射线对ECA109细胞的促凋亡作用(%,x±s) Table 2 Stattic enhances the radiosensitivity of ECA109 cells in hypoxia after radiation to 6 Gy X-rays (%,x±s) |

|
图 3 ECA109细胞不同时间乏氧培养后(A)及Stattic作用后(B)的pSTAT3、STAT3、HIF-1α和VEGF表达变化 Figure 3 Western blot analysis of p-STAT3,STAT3,HIF-1α,and VEGF levels in ECA109 cells at different hypoxia time (A) in hypoxia with or without Static (B) |
讨论
食管癌是最常见的恶性肿瘤之一,我国是食管癌的高发国家,发病率为16.7/10万,居全国各类恶性肿瘤第5位,死亡率为13.4/10万,居第4位[9],严重危害了我国居民的健康。我国食管癌病理以鳞癌为主,占90%以上。大多数食管癌患者发病时已经丧失了手术最佳时机,所以放射治疗是目前食管癌最主要和有效的手段,但5年生存率仅为10%~15%。食管癌细胞的放射抗拒是导致5年生存率低的原因之一。因此,探寻与食管癌放射治疗相关的耐辐射基因及其作用机制,抑制耐辐射基因的表达增加食管癌的放射治疗敏感性,对提升食管癌生存率具有重要的临床意义。
近年来发现,肿瘤细胞的放射敏感性与信号转导和转录活化因子3(signal transducer and activator of transcription 3,STAT3)的激活有关[10-11]。STAT3是信号转导与转录活化蛋白(STAT)家族中的重要成员之一,是重要核转录因子。持续激活的STAT3直接参与了多种癌症的发生发展,通过上调HIF-1、Bcl-2(B-cell lymphoma 2)、Bcl-xL (B-cell lymphoma-extra large)等表达,促进细胞的生长和生存。STAT3 作为肿瘤基因在肿瘤的发生、发展、转移和治疗中都起着重要的调节功能[12]。目前研究表明,GRIM-19通过抑制STAT3表达而促使鼻咽癌细胞放射增敏性[13]、高表达STAT3能增加非小细胞型肺癌细胞及头颈部鳞状上皮癌细胞的抗辐射能力[14-15]、阻断STAT3活性即可增强细胞的放射敏感性[16]。因而通过抑制STAT3表达可促进肿瘤细胞的放射敏感性。Stattic是一种卟啉类非肽小分子,通过与STAT3蛋白的SH2功能区结合,抑制STAT3基因的表达、蛋白的活化、二聚体的形成及向细胞核内移动,从而抑制STAT3的核转运,是STAT3的特异性抑制剂[17]。进一步得出结论:Stattic通过抑制STAT3表达可促进肿瘤细胞的放射敏感性。但对于Stattic干扰STAT3表达后是否可调控HIF-1、VEGF这一机制没有阐明。本研究结果显示,Stattic在乏氧时能抑制食管癌ECA109细胞受照射后的克隆形成率,并增加乏氧培养细胞受照射后的凋亡率,同时Stattic能增加双键断裂,上述结果表明Stattic能增加食管癌ECA109细胞的放射敏感性。而Western blot进一步表明Stattic能抑制pSTAT3、HIF-1α和VEGF的过表达。进而表明,Stattic对乏氧的食管癌ECA109细胞有增敏作用,可能与抑制HIF-1α和VEGF的过表达有关。
综上,本研究表明,Stattic对食管癌ECA109的放疗增敏机制可能与抑制乏氧状态下pSTAT3、HIF-1α及VEGF表达有关。然而,Stattic在乏氧环境中的放射增敏机制较为复杂,可能涉及多条信号通路,此外,Stattic下调pSTAT3、HIF-1α和VEGF表达的是否存在特异性,值得深入探讨与研究。
利益冲突 无作者贡献声明 张曲提出实验思路,进行克隆形成实验及撰写论文等;张弛负责细胞凋亡及γ-H2AX荧光染色实验;杨曦负责数据分析;马建新负责文中图片分析及整理;徐姣珍负责数据整理;肖创映负责MTT实验及修改论文
| [1] | Semenza GL. Hypoxia-inducible factors: mediators of cancer progression and targets for cancer therapy[J]. Cell, 2012, 33 (4) :207–214 . doi:10.1016/j.tips.2012.01.005 |
| [2] | Harada H, Inoue M, Itasaka S, et al. Cancer cells that survive radiation therapy acquire HIF-1 activity and translocate towards tumour blood vessels[J]. Nat Commun, 2012, 17 (3) :783. doi:10.1038/ncomms1786 |
| [3] | Lu XG, Wang XS, Zhang YS, et al. Hypoxia inducible factor-1alpha and vascular endothelial growth factor expression are associated with a poor prognosis in patients with nasopharyngeal carcinoma receiving radiotherapy with carbogen and nicotinamide[J]. Clin Oncol, 2008, 20 (8) :606–612 . doi:10.1016/j.clon.2008.07.001 |
| [4] | Greer SN, Metcalf JL, Wang Y, et al. The updated biology of hypoxia-inducible factor[J]. EMBO J, 2012, 31 (11) :2448–2460 . doi:10.1038/emboj.2012.125 |
| [5] | Xia Y, Choi HK, Lee K. Recent advances in hypoxia-inducible factor (HIF)-1 inhibitors[J]. Eur J Med Chem, 2012, 49 :24–40 . doi:10.1016/j.ejmech.2012.01.033 |
| [6] | Zhang Q, Zhang C, Yang X, et al. Berberine inhibits the expression of hypoxia induction factor-1alpha and increases the radiosensitivity of prostate cancer[J]. Diagn Pathol, 2014, 9 (98) :98–104 . doi:10.1186/1746-1596-9-98 |
| [7] | Zhang C, Yang X, Zhang Q, et al. Berberineradiosensitizes human nasopharyngeal carcinoma by suppressing hypoxia-inducible factor-1 expression[J]. Acta Otolaryngol, 2014, 134 (2) :185–92 . doi:10.3109/00016489.2013.850176 |
| [8] | Xu Q, Briggs J, Park S, et al. Targeting Stat3 blocks both HIF-1 and VEGF expression induced by multiple oncogenic growth signaling pathways[J]. Oncogene, 2005, 24 (36) :5552–5560 . doi:10.1038/sj.onc.1208719 |
| [9] | 赫捷, 邵康. 中国食管癌流行病学现状、诊疗现状及未来对策[J]. 中国癌症杂志, 2011,21 (7) :501–504. doi:10.3969/j.issn.1007-3969.2011.07.001 Hao J, Shao K. The epidemiologysituation, diagnosis and treatment status and future countermeasures of esophageal cancer[J]. Chin J Cancer, 2011, 21 (7) :501–504 . doi:10.3969/j.issn.1007-3969.2011.07.001 |
| [10] | 赵环宇, 张维铭, 陈锦飞. X射线照射联合RNA干扰STAT3基因对人食管癌细胞放射敏感性的影响[J]. 中华放射医学与防护杂志, 2011,31 (2) :180–184. doi:10.3760/cma.j.issn.0254-5098.2011.02.016 Zhao HY, Zhang WM, Chen JF. X-ray combined RNA interference STAT3 gene effects on human esophageal cancer cells radiation sensitivity[J]. Chin J Radiol Med Prot, 2011, 31 (2) :180–184 . doi:10.3760/cma.j.issn.0254-5098.2011.02.016 |
| [11] | Adachi M, Cui CX, Cristina TD, et al. Targeting STAT3 inhibits growth and enhances radiosensitivity in head and neck squamous cell carcinoma[J]. Oral Oncol, 2012, 48 (12) :1220–1226 . doi:10.1016/j.oraloncology.2012.06.006 |
| [12] | Marotta LL, Almendro V, Marusyk A, et al. The JAK2/STAT3 signaling pathway is required for growth of CD44(+)CD24(-) stem cell-like breast cancer cells in human tumors[J]. J Clin Invest, 2011, 121 (7) :2723–2735 . doi:10.1172/JCI44745 |
| [13] | Ho Y, Tsao SW, Zeng M, et al. STAT3 as a therapeutic target for Epstein-Barr virus (EBV)- associated nasopharyngeal carcinoma[J]. Cancer Lett, 2013, 330 (2) :141–149 . doi:10.1016/j.canlet.2012.11.052 |
| [14] | Aggarwal BB, Kunnumakkara AB, Harikumar KB, et al. Signal transducer and activator of transcription-3, inflammation, and cancer: how intimate is the relationship?[J]. Ann NY Acad Sci, 2009, 1171 :59–76 . doi:10.1111/j.1749-6632.2009.04911.x |
| [15] | Aggarwal BB, Sethi G, Ahn KS, et al. Targeting signal-transducer-and-activator-of-transcription-3 for prevention and therapy of cancer: modern target but ancient solution[J]. Ann NY Acad Sci, 2006, 1091 :151–169 . doi:10.1196/annals.1378.063 |
| [16] | Wang X, Crowe P, Goldstein D, et al. STAT3 inhibition, a novel approach to enhancing targeted therapy in human cancers (Review)[J]. Int J Oncol, 2012, 41 (4) :1181–1191 . doi:10.3892/ijo.2012.1568 |
| [17] | Uehara Y, Mochizuki M, Matsuno K, et al. Novel hign-throughput screening system for identifying STAT3-SH2 antagonists[J]. Biochem Biophys Res Commun, 2009, 380 (3) :627–631 . doi:10.1016/j.bbrc.2009.01.137 |
 2016, Vol. 36
2016, Vol. 36


