宫颈癌是全球女性的第3位新发恶性肿瘤。放射治疗作为其主要的治疗手段,在临床治疗中取得了良好效果,但复发患者的5年生存率不足15%[1]。因此,探索宫颈癌放疗抗拒机制,提高放疗敏感性具有重要意义。
高迁移率族蛋白B1(high mobility group box 1,HMGBl)是一种非组蛋白染色体蛋白,其在胃癌、食管癌、乳腺癌、肺癌 中高表达,且与预后呈明显的负相关性[2-5]。有研究表明抑制HMGB1后,乳腺癌侵袭转移能力和放射抗拒性皆降低[6],但也有研究提示在野生型Rb基因表达的乳腺癌中,过表达HMGB1导致了生长抑制和放射增敏[7]。除此之外,本课题组前期采用差异蛋白质组学技术,筛选喉鳞癌放射敏感/抗拒细胞模型中差异表达的蛋白质,发现HMGB1属于明显差异表达的蛋白质之一[8]。然而,HMGB1的表达是否与细胞的放射敏感性相关,且其表达是否受射线调控尚不明确。因此,本研究旨在探索不同剂量射线作用于同一遗传背景放射敏感性不同的细胞后HMGB1的表达变化。
材料与方法1.细胞与试剂:人宫颈癌细胞系HeLa购于中国科学院上海细胞库,人宫颈癌放射抗拒细胞系HeLaR为本室诱导建立。MEM培养液、胎牛血清(FBS)、0.25%胰蛋白酶购自美国Hyclone公司,蛋白裂解液购自美国Thermo公司,BCA蛋白质定量试剂盒、Real-Master—Mix(SYBR Green)试剂购自北京天根生化公司,TRIzol试剂购自美国Invitrogen公司,反转录试剂盒购自美国Promega公司,抗HMGB1抗体购自美国Abcam公司,辣根过氧化酶标记二抗购自北京中杉金桥公司。
2.建立放射抗拒细胞模型:将HeLa细胞培养于75 cm2培养瓶中,待细胞长至60%密度时进行2 Gy X射线照射。待细胞长至80%左右时,消化传代至新的培养瓶。直至细胞长至60%密度时,再次进行照射,如此反复,直至照射总剂量达到72 Gy。将所获得的细胞命名为HeLaR细胞。
3.细胞培养:将HeLa及HeLaR细胞系在含有10%FBS的MEM培养液中,5%CO2、37℃、饱和湿度条件下培养,用0.25%胰蛋白酶消化传代。
4.照射条件:利用德国西门子Primus直线加速器,6 MV X射线,35 cm×35 cm照射野,源靶距100 cm,分别给予不同剂量的X射线单次照射(2、5、10 Gy)。吸收剂量率2 Gy/min。
5.细胞收集:于照射后0、0.5、2、4、6、12、18、24、36、48 h胰酶消化收集细胞,每组细胞各2份,细胞团用PBS清洗2次,分别加入蛋白裂解液和TRIzol,放置于-80℃冰箱备用。
6.克隆形成实验:将HeLa和HeLaR细胞接种于6孔板中,分别接受0、1、2、4、6、8、10 Gy剂量X射线照射,后将细胞置于培养箱中培养14 d。14 d后,将细胞用结晶紫染色,计算克隆形成率(PE)及细胞存活分数(SF)。PE(%)=集落数/接种细胞数×100%,SF=某一剂量照射组的集落数/(该组的细胞接种数×照后0 h PE)。此实验重复3次。剂量-效应关系模型分析采用多靶单击模型。用GraphPad Prism 5软件制作拟合曲线。
7.Western blot免疫印迹:取加了蛋白裂解液的细胞样品提取总蛋白,用二喹啉甲酸(BCA)蛋白定量试剂盒测定蛋白浓度。取40 g蛋白上样量,用10%的SDS-PAGE胶恒压电泳,湿转的方法将蛋白转移到PVDF膜上,用含5%脱脂奶粉的TBST室温封闭2 h,4℃条件下孵育一抗过夜,TBST漂洗10 min×3次,室温孵育二抗2 h,TBST漂洗10 min×3次,用化学发光法显像。
8.实时荧光定量PCR:按TRIzol试剂说明书提取HeLa和HeLaR的mRNA。以1 μg mRNA为模板,Oligo dT为引物,20 μl体系反转录成cDNA。用Real-Master-Mix(SYBR Green)在CFX manage 3.0定量PCR仪(美国BioRad公司)中进行实时PCR分析,每样本平行3孔,PCR反应条件为:95℃,2 min;95℃,5 s;60℃,30 s,39个循环之后,95℃,5 s。HMGB1上下游引物分别为5' ATATGGCAAAAGCGGACAAG 3'和5' GCAACATCACCAATGGACAG 3'。
9.荧光定量PCR数据分析:定量PCR的数据采用比较Ct值的方法。以GAPDH为内参,依据下列公式计算HMGB1 mRNA的表达量(relative quantity,RQ):RQ=2exp(-ΔΔCt),其中,ΔΔCt=目的基因Ct值-内参基因Ct值;采用CFX Manage 3.0自身软件采集数据。HMGB1 mRNA的表达变化以相对量表示,即以照射后0 h对照样品的中的HMGB1 mRNA表达量作为参比对照定为1,其他样品中的均为对照样品的倍数。
10.统计学处理:用SPSS 13.0统计软件分析数据,实验结果以x±s表示。采用独立样本t检验进行分析。P < 0.05为差异有统计学意义。
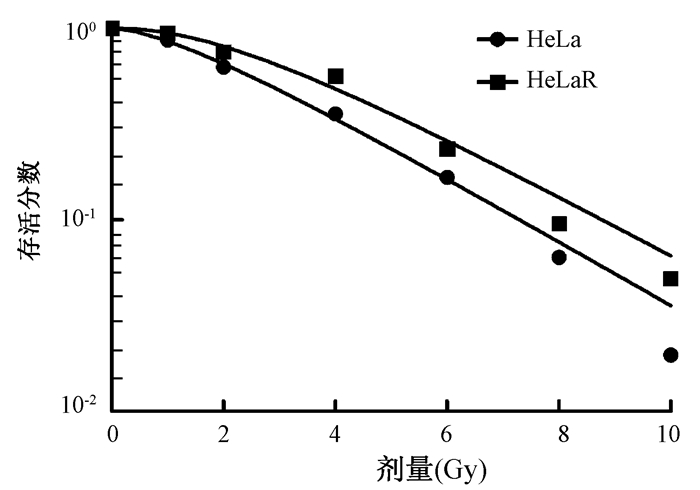
结果1.克隆形成实验:结果如图 1所示。可以看出HeLaR细胞的生存曲线明显高于HeLa细胞,HeLaR细胞放射敏感性明显低于HeLa细胞。
|
图 1 HeLa及HeLaR细胞生存曲线 Figure 1 Survival curves of HeLa and HeLaR cells |
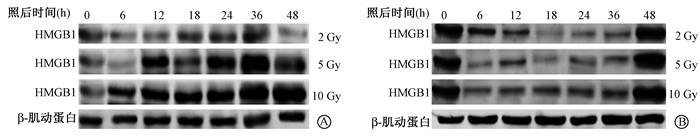
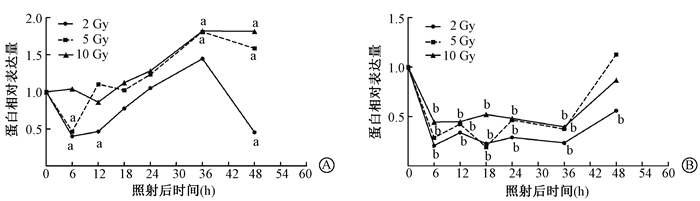
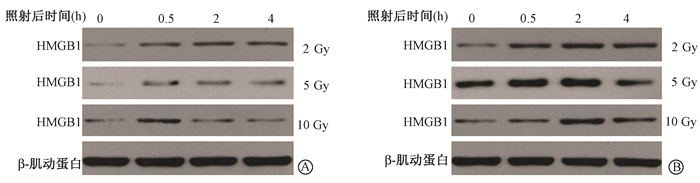
2. X射线照射后HeLa和HeLaR细胞中HMGB1蛋白表达变化:结果见图 2,3。其中,2、5、10 Gy X射线照射后,HeLaR细胞在48 h内均表现为HMGB1蛋白表达量下降,在48 h达到未照射水平,后有增加趋势。与照后0 h比较,2、5、10 Gy照射后6~36 h差异均具有统计学意义(t=3.574~9.754,P < 0.05)。相反,HeLa细胞在照射后6 h,其HMGB1表达逐渐增多,尤其在5和10 Gy表现明显。与照后0 h比较,2 Gy照射后6、12、48 h差异具有统计学意义(t=3.945~ 4.864,P <0.05);5 Gy照射后6、36、48 h差异具有统计学意义(t=-2.875~3.295,P <0.05);10 Gy照射后36、48 h差异具有统计学意义(t=-4.480、-4.517,P < 0.05)。值得指出的是,在照射后6 h,两组细胞中HMGB1蛋白表达均下降,因此,检测了照射后更早期时间点HMGB1的表达。结果见于图 4,5。可以看出,在照射后早期,HeLa和HeLaR细胞中HMGB1的表达量都是升高的,尤其是在2 Gy剂量照射后。
|
图 2 不同剂量X射线照射后不同时间HeLa(A)和HeLaR(B)细胞HMGB1蛋白表达变化 Figure 2 Protein levels of HMGB1 in HeLa(A)and HeLaR(B) cell after different doses of X-ray irradiation |
|
图 3 不同剂量X射线照射HeLa(A)和HeLaR(B)细胞HMGB1蛋白含量变化 Figure 3 Temporal expression of HMGB1 protein in HeLa(A)and HeLaR(B) cell after radiation |
|
图 4 不同剂量X射线照射HeLa(A)和HeLaR(B)细胞后HMGB1蛋白表达变化 Figure 4 Protein levels of HMGB1 in HeLa(A)and HeLaR(B) cell after different doses of X-ray irradiation |
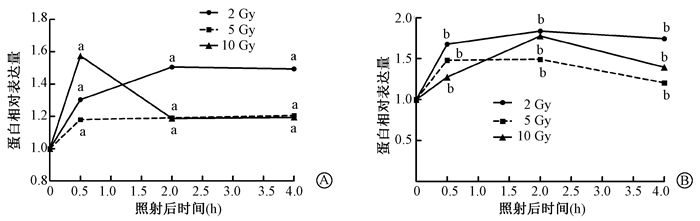
|
图 5 不同剂量X射线分别照射HeLa(A)和HeLaR(B)细胞后HMGB1蛋白含量变化 Figure 5 Temporal expression of HMGB1 protein in HeLa(A)and HeLaR(B) cell after radiation |
3.X射线照射后HeLa和HeLaR细胞HMGB1 mRNA表达变化:结果见图 6。其中2 Gy照射HeLa细胞后,HMGB1的表达整体呈升高趋势,在24 h出现一个高峰,36 h出现一个低谷;5 Gy照射后,HMGB1 mRNA 表达整体呈下降趋势,至48 h下降明显;10 Gy照射后24 h,HeLa细胞出现HMGB1 mRNA表达明显下降。2 Gy照射HeLaR细胞后,HMGB1 mRNA表达呈下降趋势,在照射后6 h即显著下降,随后至36 h急剧升高至0 h水平后又迅速下降;5 Gy照射后,立即出现急剧下降,至6 h后变化平缓,总体呈表达减少趋势;10 Gy照射后,在24 h前表达逐渐下降,至24 h开始上升至未照射水平,36 h后又急剧下降。

|
图 6 不同剂量X射线分别照射HeLa(A)和HeLaR(B)细胞后HMGB1mRNA含量变化 Figure 6 Temporal expression of HMGB1 protein in HeLa(A)and HeLaR(B) cell after radiation |
讨论
HMGB1在多种恶性肿瘤中高表达,并可促进肿瘤生长,但另一方面,在抗肿瘤治疗后HMGB1又可激活树突状细胞启动抗肿瘤T细胞免疫[9]。已有研究发现,敲除哺乳动物细胞中的HMGB1将导致细胞对辐射更敏感,辐射后细胞DNA损伤更加严重,导致细胞死亡或基因突变[10]。本课题组前期研究发现,在乳腺癌MCF-7细胞中,利用小干扰RNA抑制HMGB1的表达,将提高细胞的放射敏感性,同时诱导细胞发生G2/M期阻滞[6]。但是,另有研究认为,HMGB1作为一种抑癌基因,可通过成视网膜母细胞基因(RB)依赖性的方式显著抑制体内和体外乳腺癌的生长、转移和侵袭,增加HMGBl的表达可以诱导RB依赖的细胞凋亡和发生G1期阻滞,并增加MCF-7肿瘤细胞的辐射敏感性[7]。由此可知,HMGB1与肿瘤的放射敏感性相关,但其对宫颈癌细胞放射敏感性的影响尚不明确。
本研究中,3个不同剂量X射线照射后早期,即6 h以内,两组细胞中HMGB1的表达均升高,说明在HMGB1的表达方面,两组细胞对射线的早期反应是一致的。提示在射线照射后早期,HMGB1的表达量对于判断细胞的放射敏感性没有指导意义。在照射6 h以后,两组细胞表现出了完全相反的结果,在HeLa细胞中,HMGB1表达整体升高,且随着照射后时间的延长,其表达量也随之变化;在HeLaR细胞中,HMGB1表达整体降低,与照射后时间也存在联系,该变化与受照剂量无明显联系。研究表明,电离辐射可以增强HMGB1等免疫刺激调控分子的合成[11],并且射线照射后导致细胞释放大量活性氧簇(ROS),而ROS引起的氧化损伤可进一步促进肿瘤细胞HMGB1的表达[12]。HeLa细胞对射线更敏感,射线作用后导致的细胞损伤更严重,如炎症反应。因此,射线作用于HeLa细胞后,HMGB1的表达整体升高。然而,对于辐射抗拒的HeLaR细胞,射线作用后,细胞发生的损伤较轻,电离辐射及细胞损伤对HMGB1表达的刺激作用较弱,HMGB1表达未增高,反而降低。表明HeLaR细胞中可能存在某一机制通过抑制HMGB1的表达而调控宫颈癌细胞放射敏感性,该机制可能与细胞免疫反应及氧化应激有关。
需要指出的是,在两组细胞经照射后36及48 h,HMGB1在蛋白水平及mRNA水平的表达相反,且在重复了3次后仍得出此结果。这一现象可能由以下3个原因导致,首先,真核基因表达的转录和翻译发生的时间和位点存在时空间隔;其次,在转录后,又会有转录后加工,转录产物的降解、翻译,翻译后加工及修饰好几个层面;再次,样品提取时间点无法完全相同,可能在蛋白达到峰值的时候mRNA已经降解了或者在mRNA达到峰值的时候蛋白量还在增加中[13]。因此,从转录水平调控HMGB1表达的因素以及影响HMGB1蛋白翻译后修饰的相关因素,都可能参与HMGB1介导的放射敏感性的调控。
综上所述,HMGB1表达水平可能与细胞的DNA损伤修复能力及细胞损伤水平有关。除此之外,参与调控HMGB1的相关因素,如转录水平及翻译后修饰水平的调控因素,可能参与HMGB1介导的放射敏感性的调控。然而,尚需进一步的体内外实验研究,明确HMGB1作为宫颈癌放射增敏靶点的可能性,并深入探讨HMGB1在不同放射敏感性细胞中表达差异的机制,为临床预测肿瘤患者的个体放射敏感性提供理论依据。
利益冲突 本人与本人家属、其他研究者未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 康红设计研究方案,进行试验,收集数据并起草论文;杨慧、柯少波提供实验技术指导;周福祥、周云峰负责论文修改及总体思路指导
| [1] | Goncalves A, Fabbro M, Lhommé C, et al. A phase Ⅱ trial to evaluate gefitinib as second- or third-line treatment in patients with recurring locoregionally advanced or metastatic cervical cancer[J]. Gynecol Oncol, 2008, 108 (1) :42–46 . doi:10.1016/j.ygyno.2007.07.057 |
| [2] | Zhang J, Zhang R, Lu WW, et al. Clinical significance of hmgb1 expression in human gastric cancer[J]. Int J Immunopathol Pharmacol, 2014, 27 (4) :543–551 . |
| [3] | Chen CG, Tang P, Yu ZT. The expression of high mobility group box 1 is associated with lymph node metastasis and poor prognosis in esophageal squamous cell carcinoma[J]. Pathol Oncol Res, 2012, 18 (4) :1021–1027 . doi:10.1007/s12253-012-9539-3 |
| [4] | Flohr AM, Rogalla P, Meiboom M, et al. Variation of HMGB1 expression in breast cancer[J]. Anticancer Res, 2001, 21 (6A) :3881–3885 . |
| [5] | Sun KK, Ji C, Li X, et al. Overexpression of high mobility group protein B1 correlates with the proliferation and metastasis of lung adenocarcinoma cells[J]. Mol Med Rep, 2013, 7 (5) :1678–1682 . doi:10.3892/mmr.2013.1362 |
| [6] | Ke S, Zhou F, Yang H, et al. Downregulation of high mobility group box 1 modulates telomere homeostasis and increases the radiosensitivity of human breast cancer cells[J]. Int J Oncol, 2015, 46 (3) :1051–1058 . doi:10.3892/ijo.2014.2793 |
| [7] | Jiao Y, Wang HC, Fan SJ. Growth suppression and radiosensitivity increase by HMGB1 in breast cancer[J]. Acta Pharmacol Sin, 2007, 28 (12) :1957–1967 . doi:10.1111/j.1745-7254.2007.00669.x |
| [8] | 张喜梅, 周福祥, 胡柳, 等. 辐射诱导放射抗拒鳞癌细胞株的蛋白质组学差异分析[J]. 中华放射医学与防护杂志, 2011,31 (5) :548–551. doi:10.3760/cma.j.issn.0254-5098.2011.05.010 Zhang XM, Zhou FX, Hu L, et al. Differential proteomic analysis of a squamous cell carcinoma cell line induced by radiation[J]. Chin J Radiol Med Prot, 2011, 31 (5) :548–551 . doi:10.3760/cma.j.issn.0254-5098.2011.05.010 |
| [9] | Shen XK, Hong LZ, Sun HM, et al. The expression of high-mobility group protein box 1 correlates with the progression of non-small cell lung cancer[J]. Oncol Rep, 2009, 22 (3) :535–539 . doi:10.3892/or_00000468 |
| [10] | Lange SS, Mitchell DL, Vasquez KM. High mobility group protein B1 enhances DNA repair and chromatin modification after DNA damage[J]. Proc Natl Acad Sci USA, 2008, 105 (30) :10320–10325 . doi:10.1073/pnas.0803181105 |
| [11] | Schmid TE, Multhoff G. Radiation-induced stress proteins- the role of heat shock proteins (HSP) in anti- tumor responses[J]. Curr Med Chem, 2012, 19 (12) :1765–1770 . doi:10.2174/092986712800099767 |
| [12] | Tang D, Kang R, Zeh HJ, et al. High-mobility group box 1, oxidative stress, and disease[J]. Antioxid Redox Signal, 2011, 14 (7) :1315–1335 . doi:10.1089/ars.2010.3356 |
| [13] | de Sousa Abreu R, Penalva LO, Marcotte EM, et al. Global signatures of protein and mRNA expression levels[J]. Mol Biosyst, 2009, 5 (12) :1512–1526 . doi:10.1039/b908315d |
 2016, Vol. 36
2016, Vol. 36


