抗表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)被认为是对EGFR基因突变的非小细胞肺癌有效的治疗药物。但临床上大多数患者在10~12个月产生对EGFR-TKI的耐药。凋亡素2配体(Apo-2L)也被称为肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL),是近几年发现的肿瘤坏死因子受体超家族(TNFSF)新成员。Apo-2l/TRAIL是唯一已知的特异性凋亡诱导分子,可以选择性地诱导肿瘤细胞凋亡,而对正常细胞无明显的毒性作用。因此,在理论上,Apo-2L结合放疗可提高细胞凋亡作用,促进放射抗拒的肿瘤细胞的凋亡。
研究发现,辐射能增强肿瘤细胞对Apo-2L的敏感性,而且两者之间有相互增敏作用[1-2]。Apo-2L结合辐射诱导乳腺癌细胞凋亡显著优于单纯照射或单独应用Apo-2L。体内实验表明,Apo-2L联合照射可以使乳腺癌转化细胞迅速消失。这种协调机制可能与以下途径有关:首先,辐射可以通过促凋亡蛋白Bax的表达来调节线粒体依赖性细胞凋亡[3],更重要的是,它可以通过P53依赖途径增强Caspase蛋白酶级联反应不断传递和放大凋亡信号[4];此外,它还可以增加死亡受体DR4、DR5的表达,传递死亡介导的信号,增加肿瘤细胞对Apo-2L的敏感性[5]。本研究旨在进一步明确凋亡素2配体作为一种放射增敏剂,对放射诱导肺腺癌H1975细胞凋亡的影响。
材料与方法1. 细胞系与主要试剂:肺癌H1975细胞系是由青岛医科大学附属医院中心实验室馈赠。Apo-2L购于上海Qiaer生物科技有限公司。四甲基偶氮唑盐(MTT)购于河南华美生物工程有限公司。碘化丙啶(PI)染色试剂盒购自美国Becton Dickinson公司,流式细胞仪FACS Calibur购自美国Becton Dickinson公司。
2. 细胞培养:细胞接种于培养瓶中,用含10%胎牛血清的RPMI 1640培养液在37℃、5%CO2培养箱中常规培养、传代,取对数生长期细胞进行实验。
3. IC50测定:选取对数生长期的肺癌H1975细胞按1×105/孔接种于96孔板,加入RPMI 1640稀释的凋亡素2配体,最终浓度分别为12.5、25、50、100、200、400和800 ng/ml,培养24 h后,应用MTT法来测定最佳浓度IC50。
4. 实验分组:分为空白对照组(未经任何处理的肺癌H1975细胞)、药物组(凋亡素2配体228 ng/ml)、单纯照射组(2 Gy)和药物联合照射组。
5. 照射条件:采用美国瓦里安23EX-1直线加速器的6 MV X射线,取对数生长期细胞进行照射,源靶距(SSD)100 cm,吸收剂量率400 cGy/min。照射面积约20 cm×20 cm。
6. 不同浓度不同照射剂量的H1975细胞的辐射增敏比和凋亡率的检测:选取对数生长期的肺癌H1975细胞按1×105/孔接种于96孔板,加入浓度为200和228 ng/ml RPMI 1640稀释的凋亡素2配体,作用于H1975细胞24 h后,均接受不同剂量的照射(照射剂量分别为1、1.5、2、2.5、3、3.5和4 Gy)。24 h后流式细胞仪检测细胞凋亡率,MTT检测计算辐射增敏作用比(SER)。
7. 流式细胞仪分析各实验组的细胞周期及细胞凋亡:用0.25%胰酶消化空白对照组、药物组、单纯照射组、药物联合照射组的细胞,然后用PBS液洗涤3次,统计细胞数,将准备好的细胞稀释成1×106/L悬液,用吸管轻轻吹打,使其成为单细胞悬液,按试剂盒说明进行细胞周期分析及细胞凋亡测定。
8. 统计学处理:结果以x±s表示。采用SPSS 17.0软件分析,采用方差分析和配对t检验进行比较。P<0.05为差异有统计学意义。
结 果1. 凋亡素2配体对肺腺癌H1975细胞系的影响(IC50):采用MTT法分析不同浓度的Apo-2L作用H1975细胞系24 h后的抑制率,结果显示,Apo-2L浓度在0~800 ng/ml之间,细胞抑制率随Apo-2L浓度的增加而增加,呈浓度依赖性。不同药物浓度的细胞抑制率差异有统计学意义(χ2=136.17,P<0.05)。所以,确定Apo-2L实验最佳的浓度为228 ng/ml(IC50)。
2. 不同剂量、不同药物浓度的细胞凋亡率检测:流式细胞仪检测方差分析表明,相同的Apo-2L浓度,不同剂量的细胞凋亡率,随照射剂量增加,凋亡率升高组。因此,不同的照射剂量对肺癌H1975细胞的作用差异有统计学意义(F=5.89、6.97,P<0.05)。同时,相同照射剂量下,228 ng/ml浓度组的凋亡率明显高于200 ng/ml浓度组,差异有统计学意义(t=5.12、6.38、7.89、9.27、11.77、14.12,P<0.05,表 1)。
|
|
表 1 不同照射剂量不同药物浓度的H1975细胞凋亡率比较(%,x±s) Table 1 The apoptosis rate of H1975 cells after radiation and drug administration(%,x±s) |
3. 放射增敏比(SER)分析:放射增敏作用与放射剂量和凋亡素2配体浓度有关。相同药物浓度下,不同放射剂量的放射增敏比随照射剂量增加而增加,其差异有统计学意义(F=26.74,P<0.05)。
同样,相同剂量下,不同Apo-2L浓度,放射增敏比随药物浓度的增加而增加,其差异有统计学意义(t=1.37、1.45、1.67、1.90、2.34、3.72,P<0.05)。因此,放射增敏作用与剂量和药物浓度呈正比,见表 2。
|
|
表 2 不同照射剂量不同药物浓度的增敏比(x±s) Table 2 The radiosensitizer effect of Apo-2L at different irradiation doses and drug concentrations(x±s) |
4. 流式细胞仪分析细胞周期:空白对照组、药物(228 ng/ml)组、单纯照射(2 Gy)组、药物联合照射组中大多数细胞的细胞周期处于G1期、S期。与空白对照组相比,在G0/G1期、S期和G2/M期各实验组之间差异均无统计学意义。同时,检测4组的凋亡率,结果显示,药物联合照射组凋亡率明显增加,差异有统计学意义(F=78.02,P<0.05),见表 3,图 1。
|
|
表 3 流式细胞仪检测各组的细胞周期分布及凋亡率(%,x±s) Table 3 Cell cycle distributions and apoptosis rates of H1975 cells measured by FACS(%,x±s) |
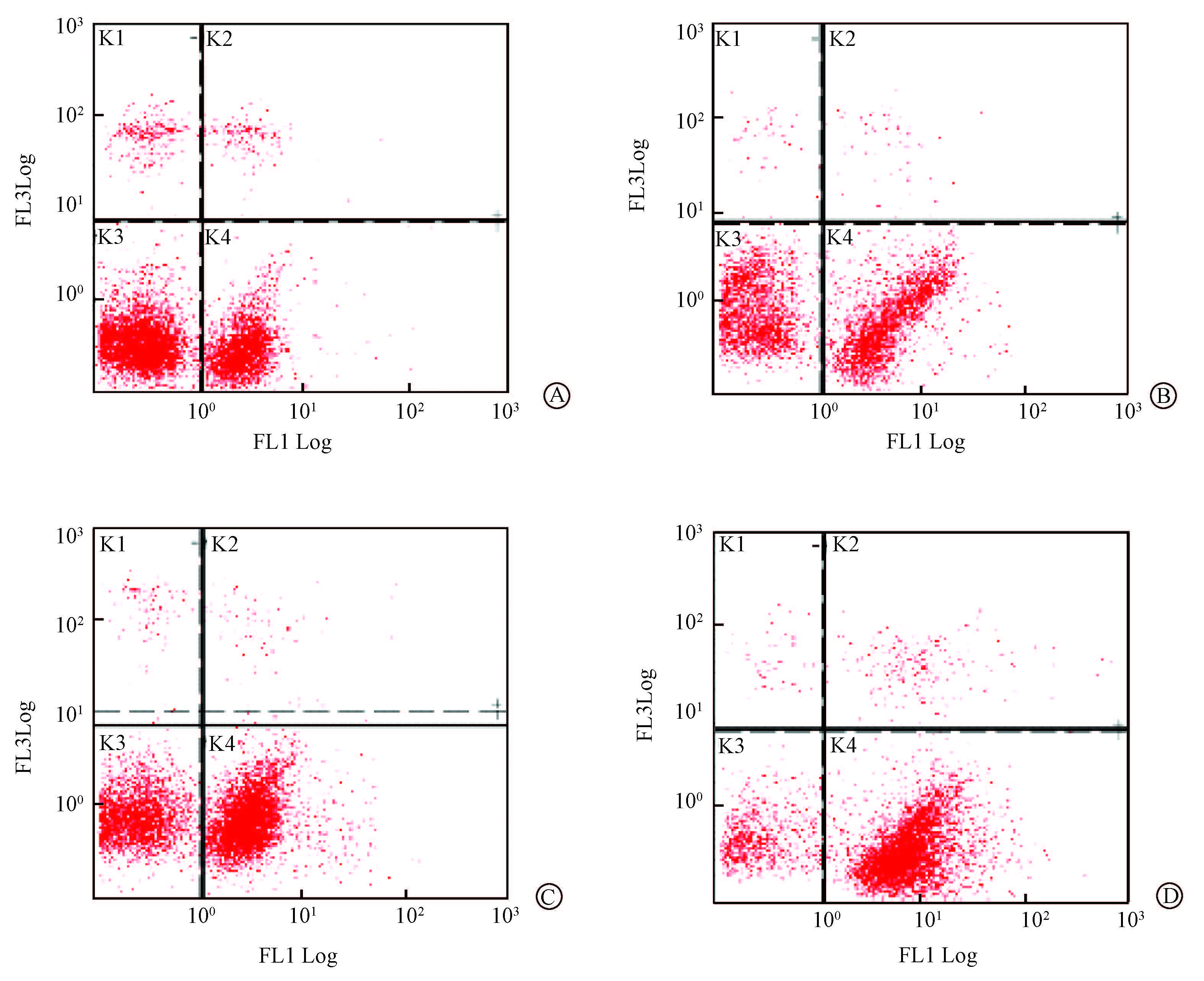
|
A.对照组;B.药物组;C.单纯照射组;D.药物联合照射组 A. Control group; B. Drug group; C. Radiation group; D. Radiation plus drug group 图 1 流式细胞仪检测各组细胞凋亡率 Figure 1 Cell apoptosis in different groups measured by the flow cytometry |
讨 论
肿瘤坏死因子相关凋亡诱导配体(TRAIL)是在1995年发现的TNF家族的新成员,也被称为Apo-2L,广泛表达于诸如脾,前列腺、肝、肾、卵巢和外周血淋巴细胞等的人体正常组织[6]。研究表明,全长膜蛋白TRALL和可溶性TRAIL在体外均能迅速诱导多种肿瘤细胞的凋亡,而正常细胞对TRAIL不敏感。其作用机制可能是由于它的受体选择性表达在多种肿瘤细胞中。TRAIL具有4个受体,即死亡受体DR4、DR5,诱捕受体DcR1、DcR2[7-8]。TRAIL通过与DR4和DR5结合迅速诱导多种来源的转化细胞凋亡。一些病毒可以通过编码诱捕受体,从而逃避免疫机制打击。正常细胞便是通过诱捕受体DcR1和DCR2免受TRAIL的攻击。DcR1、DcR2通过细胞膜外两个与DR4、DR5高度同源的半胱氨酸伪重复序列与TRAIL结合,它们广泛表达在正常组织中,但在肿瘤细胞中不表达。诱捕受体DcR1、DcR2和死亡受体DR4、DR5可以竞争性结合TRAIL。因此,正常组织对TRAIL诱导的细胞凋亡不敏感[9-11]。基于TRAIL/Apo\|2L和TRAIL-受体激动剂这种对肿瘤细胞高选择性作用原理,Apo-2L有望成为一种新的选择性的抗肿瘤治疗药物。发挥与传统的化疗药物和放疗相互协同的抗肿瘤作用。辐射可以使大多数恶性肿瘤细胞对TRAIL和TRAIL-激动性抗体敏感,而两者协同诱导细胞凋亡的作用在大多数肿瘤细胞及其转化细胞中得到证实。尤其是在那些对单一治疗效果差的细胞类型中,TRAIL和TRAIL-激动性抗体的增敏作用更明显。
基于Apo-2L对肿瘤细胞的选择性杀伤的特点,现已成为抗肿瘤药物的研究热点[12-14],而且重组TRAIL与单克隆TRAIL-受体激动抗体在Ⅰ/Ⅱ期临床试验中也体现出良好的安全性[15-18]。但是,即使在高剂量照射的情况下,仍有许多肿瘤细胞对Apo-2L诱导的细胞凋亡有所抗拒[19]。这限制了Apo-2L作为单一治疗药物在临床上得应用。因此,本研究旨在通过照射联合Apo-2L的体外实验进行进一步探讨。
本研究结果表明,凋亡素2配体和射线对肺腺癌H1975细胞系均有抑制作用,且呈时间和浓度依赖性。但是,H1975细胞系在凋亡素2配体作用48 h后,大部分细胞发生分解,这是与实验研究的条件不相符的。因此,本实验选择了作用24 h的H1975细胞系为实验材料,得出IC50为228 ng/ml。同时,凋亡素2配体联合照射显著增强放疗的效果,且放射增敏作用与放射剂量和凋亡素2配体浓度呈正比。高浓度的凋亡素2配体对H1975细胞系有放射增敏作用。
本实验通过流式细胞仪检测细胞凋亡和细胞周期结果显示,凋亡素2配体联合照射可以显著提高细胞凋亡率,其差异有统计学意义,且与药物浓度、照射剂量呈正相关。许多研究表明,在细胞内可以通过启动Caspase-8或Caspase-10直接活化效应Caspase诱导细胞凋亡,也可以经由线粒体途径直接放大凋亡信号诱导细胞凋亡[20-22]。在JurkatT细胞系中,低浓度的重组TRAIL通过tet-启动子调控Bcl-2,使Bcl-2过表达从而抑制细胞凋亡,而高浓度TRAIL可以抑制Bcl-2的过表达,导致细胞凋亡。因此,TRAIL诱导细胞凋亡取决于初始浓度,潜伏时间和线粒体途径上各个Bcl-2家族的成员复杂启动程序。相对于死亡受体介导的细胞凋亡,放疗和化疗诱导的细胞凋亡主要取决于线粒体途径,即促凋亡和抗凋亡的Bcl-2蛋白之间的平衡。因此,凋亡素2配体不仅能提高H1975对放射的敏感性,而且可以促进细胞凋亡。
另外,在本研究中,经过照射联合凋亡素2配体联合作用后,大部分肿瘤细胞处于G1期和S期。根据放射生物学理论,G2期和M期细胞对放射线敏感。根据实验数据推断,凋亡素2配体的放射增敏作用不是通过改变细胞周期分布,有可能是通过降低放射损伤后修复能力、促进凋亡、抑制细胞增殖而实现的。
放射治疗是恶性肿瘤的主要治疗方法之一,但是放疗的效果可能受多种因素的影响,如肿瘤细胞的异质性、放射损伤后不同修复能力辐射敏感等。基于本实验结果可以看出,凋亡素2配体联合照射不仅可以提高H1975细胞的放射敏感性,还能抑制细胞增殖潜力,并降低其放射损伤的修复能力。提示凋亡素2配体是一种很有前途的放射增敏剂,并为凋亡素2配体联合放疗治疗EGFR-TKI耐药的非小细胞肺癌的临床研究提供了实验依据。
利益冲突 本研究未接受其他机构提供的不当利益,与其他单位无利益冲突关系作者贡献声明 刘希光参与研究的酝酿和设计实验,提出修改意见;张红军参与研究的酝酿和设计实验;宋婷婷参与具体实施,数据的分析处理,论文撰写与修改;李敬东参与研究的具体实施、数据的采集与分析
| [1] | Voigt S, Philipp S, Davarnia P, et al. TRAIL-induced programmed necrosis as a novel approach to eliminate tumor cells[J]. BMC Cancer, 2014, 14 :74. doi:10.1186/1471-2407-14-74 |
| [2] | Farooqi AA, Gadaleta CD, Ranieri G, et al. New frontiers in promoting TRAIL-mediated cell death: focus on natural sensitizers, miRNAs, and nanotechnological advancements[J]. Cell Biochem Biophys, 2016, 74 (1) :3–10 . doi:10.1007/s12013-015-0712-7 |
| [3] | Wendt J, von Haefen, Hemmati P, et al. TRAIL sensitizes for ionizing irradiation-induced apoptosis through an entirely Bax-dependent mitochondrial cell death pathway[J]. Oncogene, 2005, 24 (25) :4052–4064 . doi:10.1038/sj.onc.1208580 |
| [4] | Gupta SC, Francis SK, Nair MS, et al. Azadirone, a limonoid tetranortriterpene, induces death receptors and sensitizes human cancer cells to tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) through a p53 protein-independent mechanism: evidence for the role of the ROS-ERK-CHOP-death receptor pathway[J]. J Biol Chem, 2013, 288 (45) :32343–32356 . doi:10.1074/jbc.M113.455188 |
| [5] | Portanova P, Notaro A, Pellerito O, et al. Notch inhibition restores TRAIL-mediated apoptosis via AP1-dependent upregulation of DR4 and DR5 TRAIL receptors in MDA-MB-231 breast cancer cells[J]. Int J Oncol, 2013, 43 (1) :121–130 . doi:10.3892/ijo.2013.1945. |
| [6] | Walczak H, Degli-Esposti MA, Johnson RS, et al. TRAIL-R2: a novel apoptosis-mediating receptor for TRAIL[J]. EMBO J, 1997, 16 (17) :5386–5397 . doi:10.1093/emboj/16.17.5386 |
| [7] | Subbiah V, Brown RE, Buryanek J, et al. Targeting the apoptotic pathway in chondrosarcoma using recombinant human Apo2L/TRAIL (dulanermin), a dual proapoptotic receptor (DR4/DR5) agonist[J]. Mol Cancer Ther, 2012, 11 (11) :2541–2546 . doi:10.1158/1535-7163.MCT-12-0358 |
| [8] | Gottwald L, Piekarski J, Kubiak R, et al. Membrane expression of TRAIL receptors DR4, DR5, DcR1 and DcR2 in the normal endometrium, atypical endometrial hyperplasia and endometrioid adenocarcinoma:a tissue microarray study[J]. Arch Gynecol Obstet, 2013, 288 (4) :889–899 . doi:10.1007/s00404-013-2840-x. |
| [9] | Yu R, Albarenque SM, Cool RH, et al. DR4 specific TRAIL variants are more efficacious than wild-type TRAIL in pancreatic cancer[J]. Cancer Biol Ther, 2014, 15 (12) :1658–1666 . doi:10.4161/15384047.2014.972183 |
| [10] | Gmidène A, Saad A, Avet-Loiseau H. 8p21.3 deletion suggesting a probable role of TRAIL-R1 and TRAIL-R2 as candidate tumor suppressor genes in the pathogenesis of multiple myeloma[J].Med Oncol,2013,30(2):489. DOI: 10.1007/s12032-013-0489-8. |
| [11] | Ho TF, Chang CC. A promising "TRAIL" of tanshinones for cancer therapy[J]. Biomedicine (Taipei), 2015, 5 (4) :23. doi:10.7603/s40681-015-0023-8 |
| [12] | Duiker EW, Dijkers EC, Lambers HH, et al. Development of a radioiodinated apoptosis-inducing ligand, rhTRAIL, and a radiolabelled agonist TRAIL receptor antibody for clinical imaging studies[J]. Br J Pharmacol, 2012, 165 (7) :2203–2212 . doi:10.1111/j.1476-5381.2011.01718.x |
| [13] | Kim SY, Park SE, Shim SM, et al. Bay 61-3606 sensitizes TRAIL-induced apoptosis by downregulating Mcl-1 in breast cancer cells[J]. PLoS One, 2015, 10 (12) :e0146073. doi:10.1371/journal.pone.0146073 |
| [14] | Marini P, Schmid A, Jendrossek V, et al. Irradiation specifically sensitises solid tumour cell lines to TRAIL mediated apoptosis[J]. BMC Cancer, 2005, 5 :5. doi:10.1186/1471-2407-5-5 |
| [15] | Herbst RS, Eckhardt SG, Kurzrock R, et al. Phase Ⅰ dose-escalation study of recombinant human Apo2L/TRAIL, a dual proapoptotic receptor agonist, in patients with advanced cancer[J]. J Clin Oncol, 2010, 28 (17) :2839–2846 . doi:10.1200/JCO.2009.25.1991 |
| [16] | Pan Y, Xu R, Peach M, et al. Evaluation of pharmacodynamic biomarkers in a phase 1a trial of dulanermin (rhApo2L/TRAIL) in patients with advanced tumours[J]. Br J Cancer, 2011, 105 (12) :1830–1838 . doi:10.1038/bjc.2011.456 |
| [17] | Trarbach T, Moehler M, Heinemann V, et al. Phase Ⅱ trial of mapatumumab, a fully human agonistic monoclonal antibody that targets and activates the tumour necrosis factor apoptosis-inducing ligand receptor-1 (TRAIL-R1), in patients with refractory colorectal cancer[J]. Br J Cancer, 2010, 102 (3) :506–512 . doi:10.1038/sj.bjc.6605507 |
| [18] | Ashkenazi A. Directing cancer cells to self-destruct with pro-apoptotic receptor agonists[J]. Nat Rev Drug Discov, 2008, 7 (12) :1001–1012 . doi:10.1038/nrd2637 |
| [19] | Wagner KW, Punnoose EA, Januario T, et al. Death-receptor O-glycosylation controls tumor-cell sensitivity to the proapoptotic ligand Apo2L/TRAIL[J]. Nat Med, 2007, 13 (9) :1070–1077 . doi:10.1038/nm1627 |
| [20] | Wang H, Zhang XY, Sun WJ, et al. Activation of TIM1 induces colon cancer cell apoptosis via modulating Fas ligand expression[J]. Biochem Biophys Res Commun, 2016, 473 (2) :377–381 . doi:10.1016/j.bbrc.2016.02.085. |
| [21] | Ji X, Jiang C, Liu Y, et al. Fas ligand gene transfer effectively induces apoptosis in head and neck cancer cells[J]. Acta Otolaryngol, 2011, 131 (8) :876–881 . doi:10.3109/00016489.2011.562539 |
| [22] | Zhang M, Harashima N, Moritani T, et al. The roles of ROS and caspases in TRAIL-induced apoptosis and necroptosis in human pancreatic cancer cells[J]. PLoS One, 2015, 10 (5) :e0127386. doi:10.1371/journal.pone.0127386. |
 2016, Vol. 38
2016, Vol. 38
