测量辐射吸收剂量的方法很多,如电离室剂量计、热释光剂量计、凝胶剂量计等。化学剂量计是利用辐射在适当的化学体系引起的化学变化与吸收剂量的关系测量物质中的吸收剂量,用于上述剂量计无法使用的场合。荧光剂量计是用荧光法测量射线引起的化学变化。但已有研究表明,在0~20 Gy范围内,用荧光法测量吸收剂量效果并不理想[1-2]。
本实验利用荧光共振能量转移原理[3]设计Alexa Fluor 488[4]和BHQ1双标记的寡核苷酸荧光探针(Alexa Fluor 488-DNA-BHQ1),检测X射线照射后,Alexa Fluor 488-DNA-BHQ1水溶液发出的荧光强度,研究吸收剂量与荧光强度之间的关系,探索Alexa Fluor 488-DNA-BHQ1荧光探针用于吸收剂量测量的可行性。
材料与方法1. 主要试剂和仪器:实验中荧光探针委托上海生工生物工程技术有限公司合成,分子结构式为5′Alexa Fluor 488-AGGGTTAGGG 3′BHQ1;生物学X射线辐照仪(美国Pro Rad Source公司,RS-2000);荧光分光光度计(天津港东公司,F-380);多功能酶标仪(美国BioTek公司,Synergy 2);电离室剂量计(美国 Radical公司,Accu-Dose)。
2. Alexa Fluor 488-DNA-BHQ1荧光探针储存条件:将Alexa Fluor 488-DNA-BHQ1荧光探针加纯水溶解制备浓度为100 μmol/L储存液,-20℃保存。使用时,直接融化后加入超纯水稀释至实验所需浓度。
3. 照射条件与检测条件:使用生物学X射线辐照仪照射(美国Pro Rad Source公司,RS-2000),X射线能量160 kVp,吸收剂量率为1.23 Gy/min,源靶距40 cm。将1 ml的荧光探针稀释液加入直径为60 mm的一次性塑料培养皿中去盖照射,培养皿放置在照射野中央,源靶距为40 cm。照射剂量用电离室剂量计测量。将照射后的样品移入黑色96孔板中,每孔加样量200 μl,使用多功能酶标仪检测,检测条件为:激发波长485 nm/20 nm,发射波长520 nm/20 nm。每次设3个平行样本,每个样本检测3次,实验重复3次。
4. 吸收光谱与发射光谱的检测:储存液解冻后用超纯水稀释成浓度为0.5 μmol/L的实验用液,用X射线照射Alexa Fluor 488-DNA-BHQ1荧光探针水溶液样品,照射剂量50 Gy,放置40 min后,使用荧光分光光度计检测照射后的Alexa Fluor 488-DNA-BHQ1荧光探针水溶液的吸收光谱和发射光谱。
5. 吸收剂量与荧光强度关系:将100 μmol/L的Alexa Fluor 488-DNA-BHQ1水溶液用超纯水稀释,配制成浓度为0.5 μmol/L的实验样品。取1 ml溶液到直径为60 mm的一次性塑料培养皿中,将培养皿去盖放入X射线生物照射仪中进行照射,照射剂量分别为0.1、0.2、0.5、1、2、4、6、8和10 Gy。将照射后的Alexa Fluor 488-DNA-BHQ1荧光探针样品用移液器加入黑色96孔板中。照射20 min后,在室温条件下使用多功能酶标仪检测各孔荧光强度。
6. 不同浓度荧光探针的吸收剂量与荧光强度的关系:将荧光探针储存液用纯水分别配成浓度为0.1、0.5和1 μmol/L的样品。在直径为60 mm的塑料培养皿中加入1 ml各种浓度的Alexa Fluor 488-DNA-BHQ1荧光探针样品,分为3组,每组样品分别照射10、20、30、40、50、60和70 Gy。照射后的样品移入专用检测荧光的黑色96孔板中,每孔200 μl。受照20 min,室温条件下用多功能酶标仪检测荧光强度。
7. 荧光强度随时间变化:配制浓度为0.5 μmol/L的实验用液,加1 ml到60 mm一次性培养皿中,分3皿。去盖照射10 Gy的X射线后移入专用黑色96孔板中,并立即用酶标仪检测荧光强度。在100 min内,每隔20 min检测一次,检测间隔期样品放入4℃冰箱,避光保存。
8. 荧光长期稳定性观察:浓度为0.5 μmol/L的Alexa Fluor 488-DNA-BHQ1荧光探针水溶液1 ml加入60 mm的塑料培养皿中,使用X射线生物辐照仪去盖照射,剂量为10 Gy,每隔1个剂量点设两组,各有3个平行样。辐照后样品加入检测荧光专用黑色96孔板中,每孔200 ml。两组分别在室温(20℃)及4℃冰箱内避光保存。12 h内每隔2 h检测一次,48 h内每隔12 h检测一次。各组实验重复3次。
9. 统计学处理:图中所示荧光强度值均为受照后荧光值减去未受照本底荧光值的绝对荧光强度值ΔF,实验数据均使用Excel和GraphPad Prism5进行分析处理。
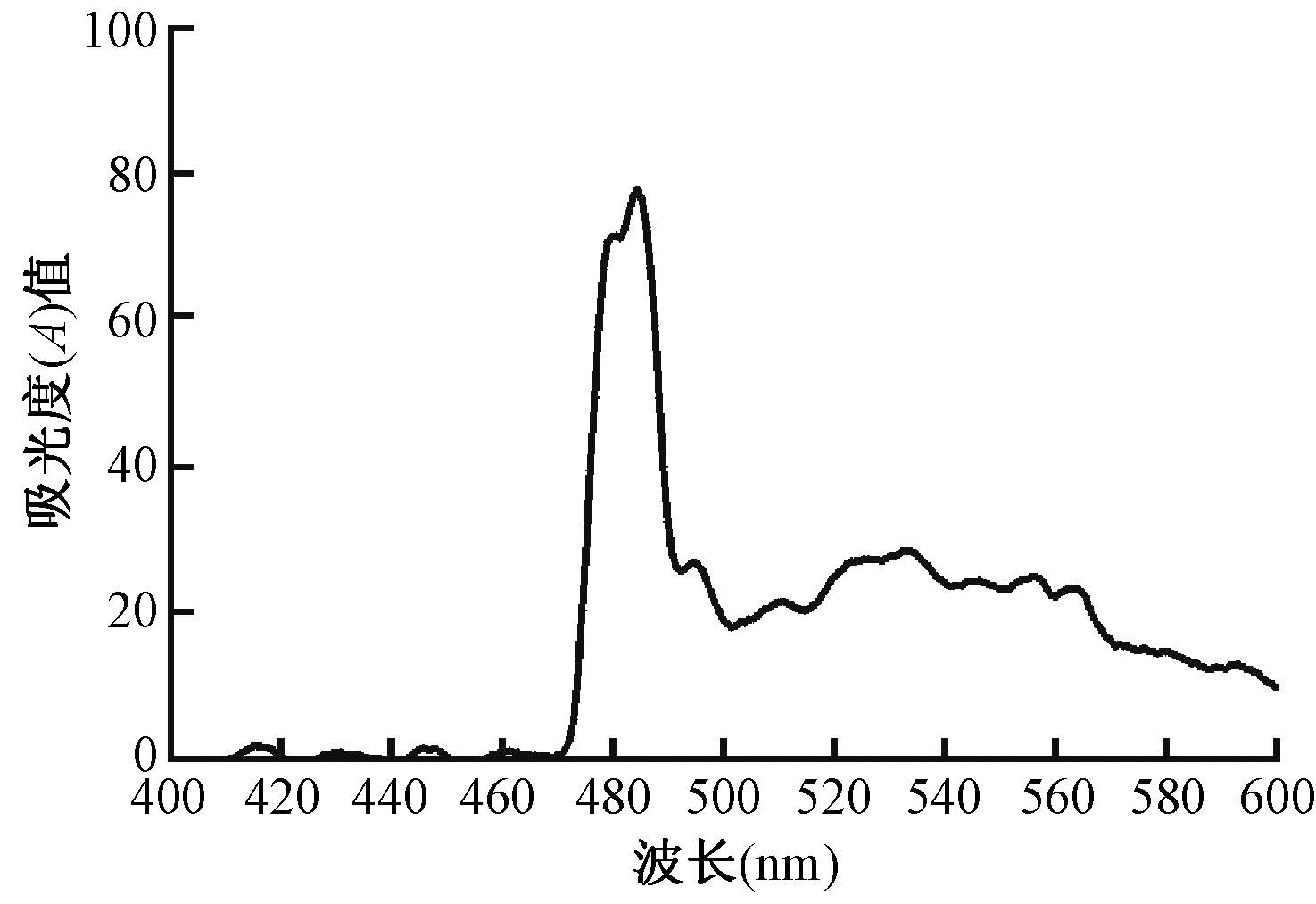
结 果1. 吸收光谱:图 1为X射线照射后的荧光探针水溶液的吸收光谱图,可见该探针的吸收峰在488 nm左右,与Alexa Fluor 488的吸收峰位置一致。
|
图 1 Alexa Fluor 488-DNA-BHQ1水溶液的吸收光谱 Figure 1 The absorption spectra of Alexa Fluor 488-DNA- BHQ1 solution |
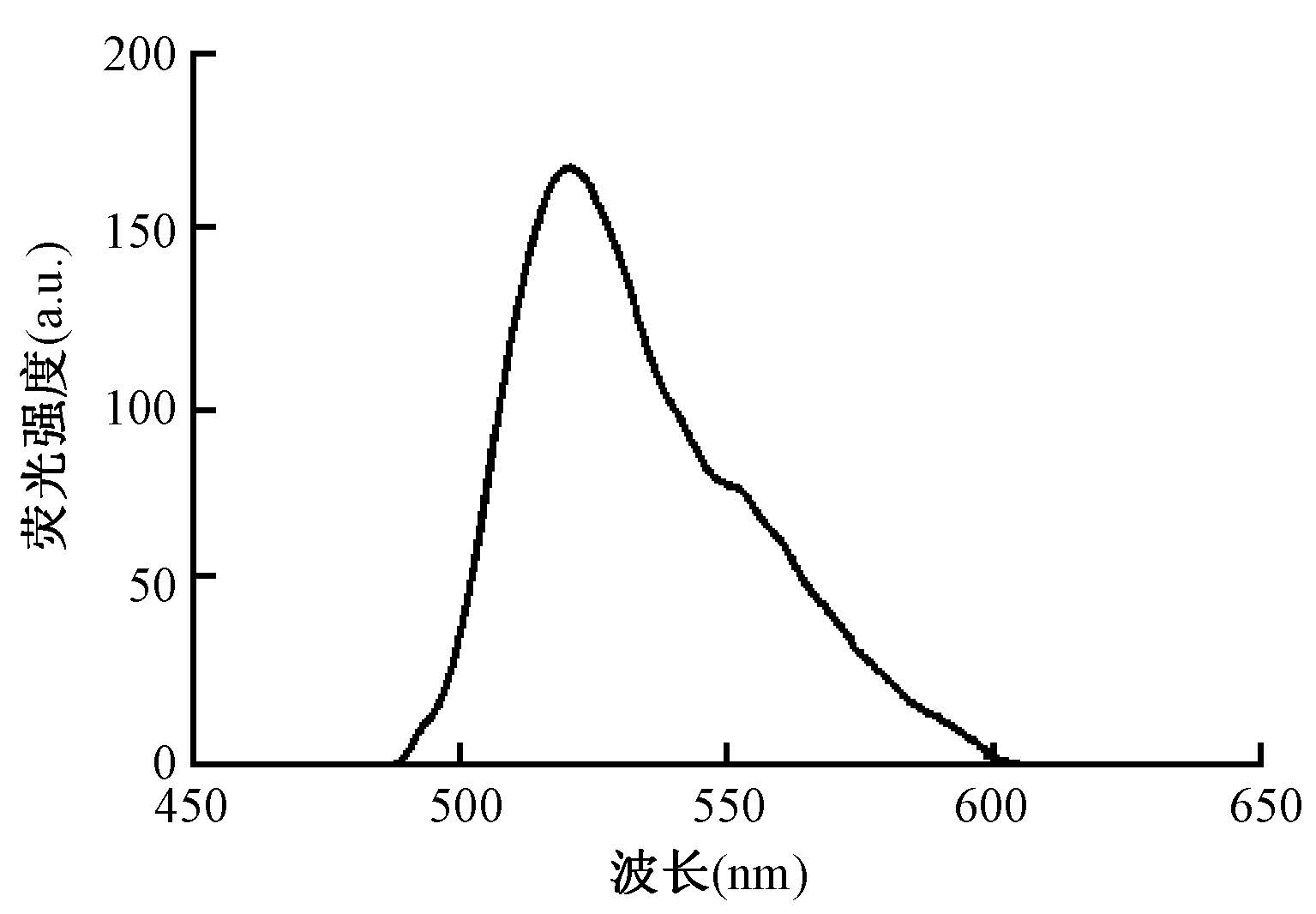
2. 发射光谱:由图 2可见,Alexa Fluor 488-DNA-BHQ1荧光探针水溶液发射波长的峰值在519 nm左右,与Alexa Fluor 488的发射峰一致。
|
图 2 X射线照射后的Alexa Fluor 488-DNA-BHQ1 水溶液的发射光谱 Figure 2 The emission spectrum of Alexa Fluor 488-DNA-BHQ1 solutions irradiated with X-rays |
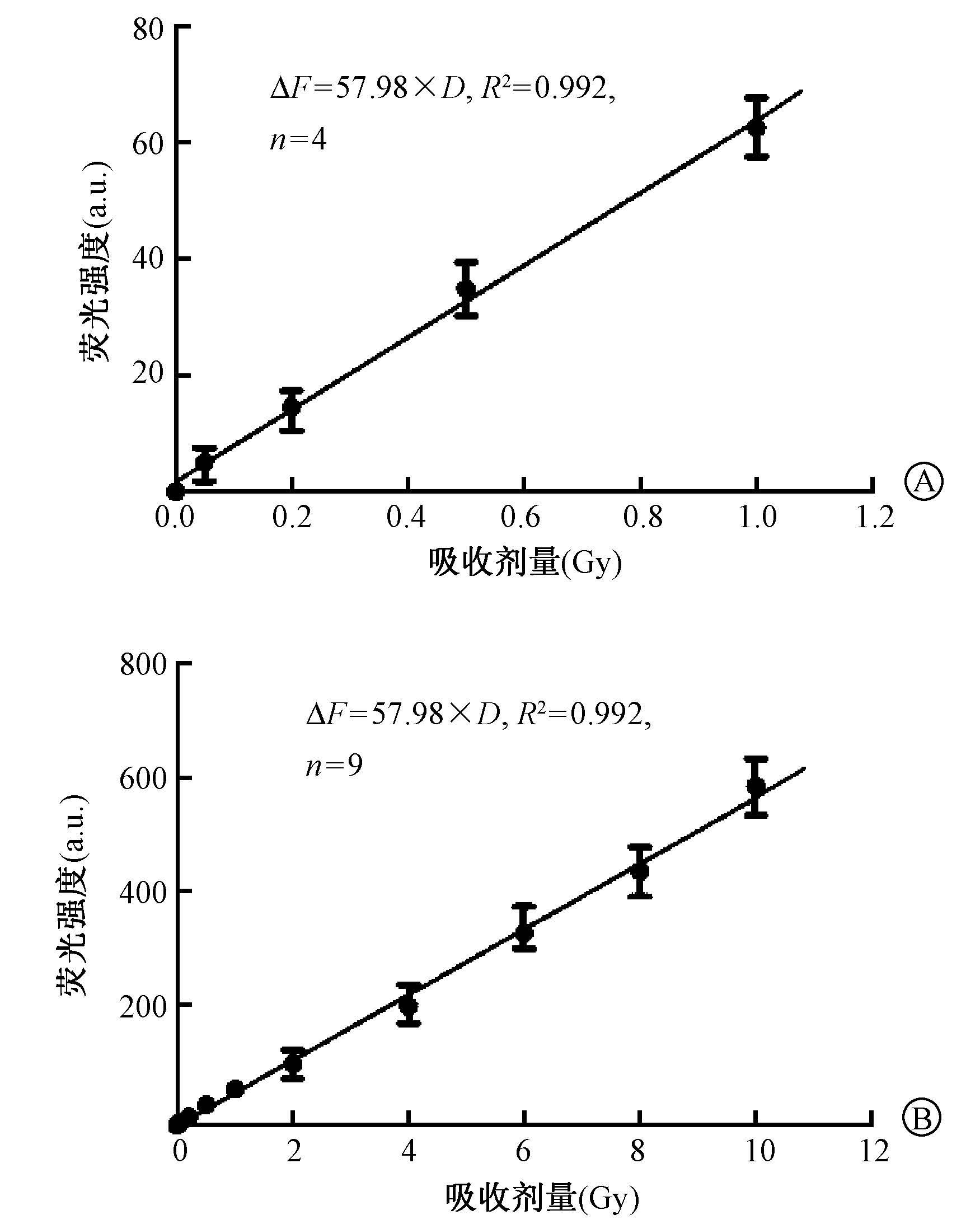
3. 吸收剂量与荧光强度效应曲线:如图 3所示,在0~10 Gy剂量范围内,Alexa Fluor 488-DNA-BHQ1荧光探针水溶液的剂量响应曲线的线性良好,绝对荧光强度ΔF与照射剂量D的关系为ΔF=57.98×D(R2=0.992)。
|
图 3 荧光探针产生荧光强度 与吸收剂量的线性关系A.0~1 Gy;B.0~10 Gy Figure 3 The linear relationship between the fluorescence intensity and the absorbed dose A. 0-1 Gy;B.0-10 Gy |
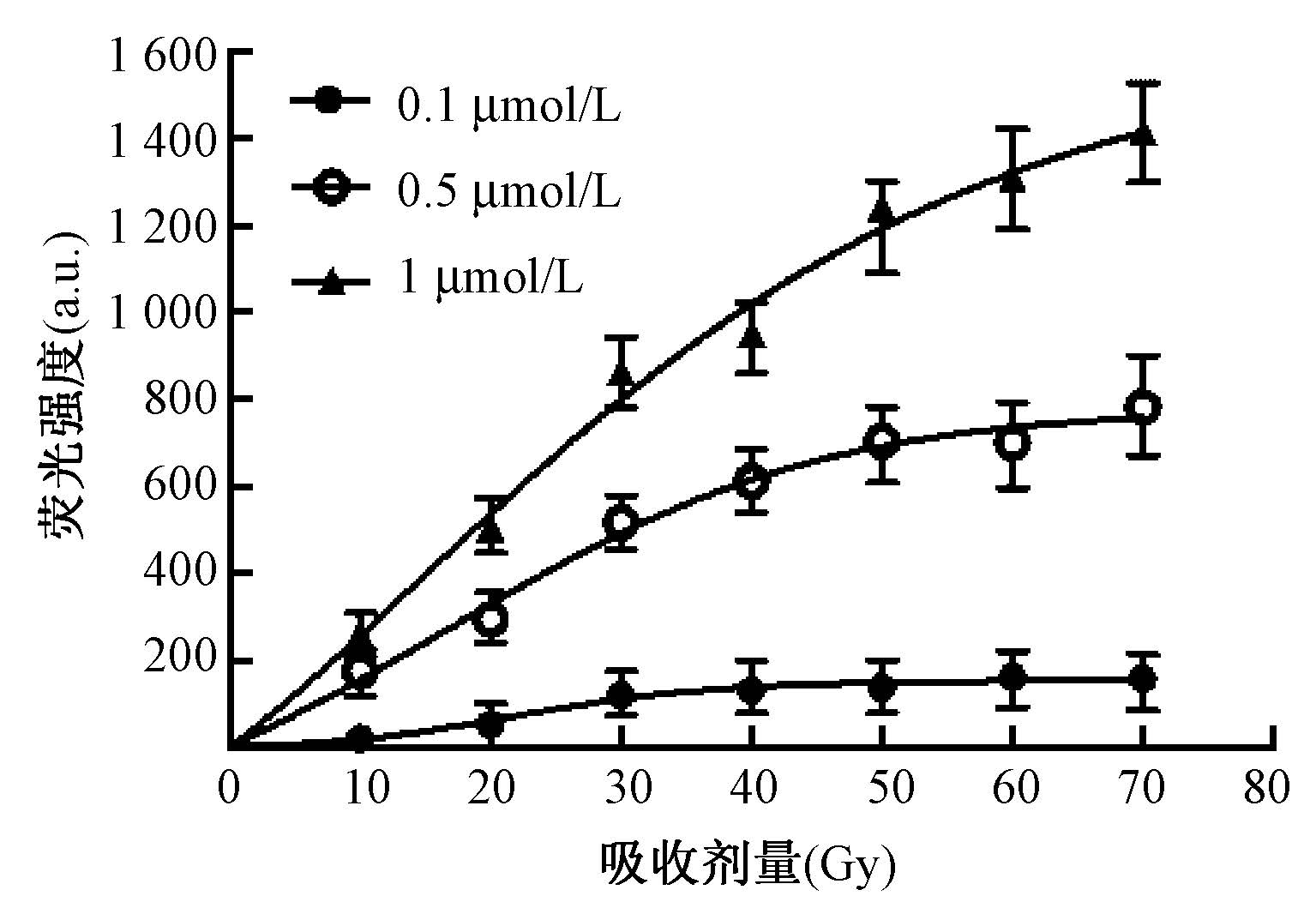
4. 不同浓度Alexa Fluor 488-DNA-BHQ1荧光探针剂量响应曲线:如图 4可见,在30 Gy剂量范围以内,荧光探针的浓度为0.5和1 μmol/L时,荧光强度与吸收剂量的线性良好,绝对荧光强度ΔF与吸收剂量D的关系分别为ΔF=16.74×D(R2=0.987)和ΔF=28.32×D(R2=0.993)。均能满足临床上单次辐射吸收剂量的测量需求。不同浓度的探针样品,在照射一定剂量的X射线后荧光强度不再改变,即DNA链全部断裂,产生荧光强度趋于稳定。
|
图 4 不同浓度的荧光探针吸收剂量-荧光强度关系 Figure 4 The relationship of fluorescence intensity and absorbed dose at different concentrations of fluorescent probes |
5. 辐照后荧光探针的最佳测量时间:如图 5所示,受照后Alexa Fluor 488-DNA-BHQ1荧光探针水溶液的荧光强度20 min内上升较快,20 min后荧光趋于稳定,40~80 min荧光强度基本不变化,考虑实际应用,检测时间控制在受照后20~80 min较好。
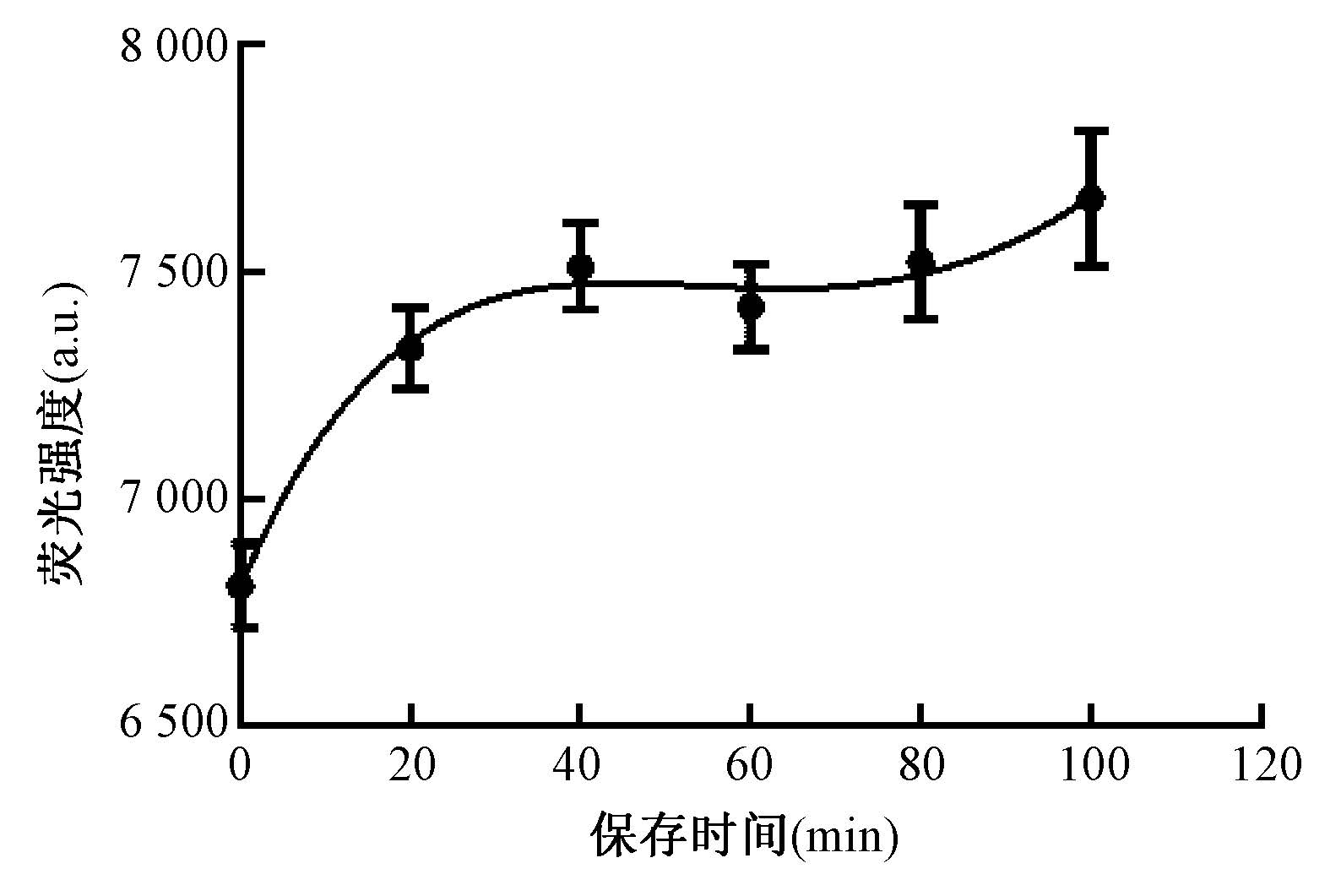
|
图 5 照射后Alexa Fluor 488-DNA-BHQ1水溶液荧光强度变化 Figure 5 The alteration of fluorescence intensity of Alexa Fluor 488-DNA-BHQ1 solutions at different times post-irradiation |
6. 不同温度条件下荧光的稳定性:如图 6所示。保存于4℃条件下的探针荧光强度较室温条件下的探针荧光强度弱,但荧光强度比室温条件下保存更稳定,且4℃条件下的样品在24 h后荧光强度趋于稳定,而室温条件保存的样品的荧光强度随着时间延长稳定性更差。故实验用液在4℃保存为好。
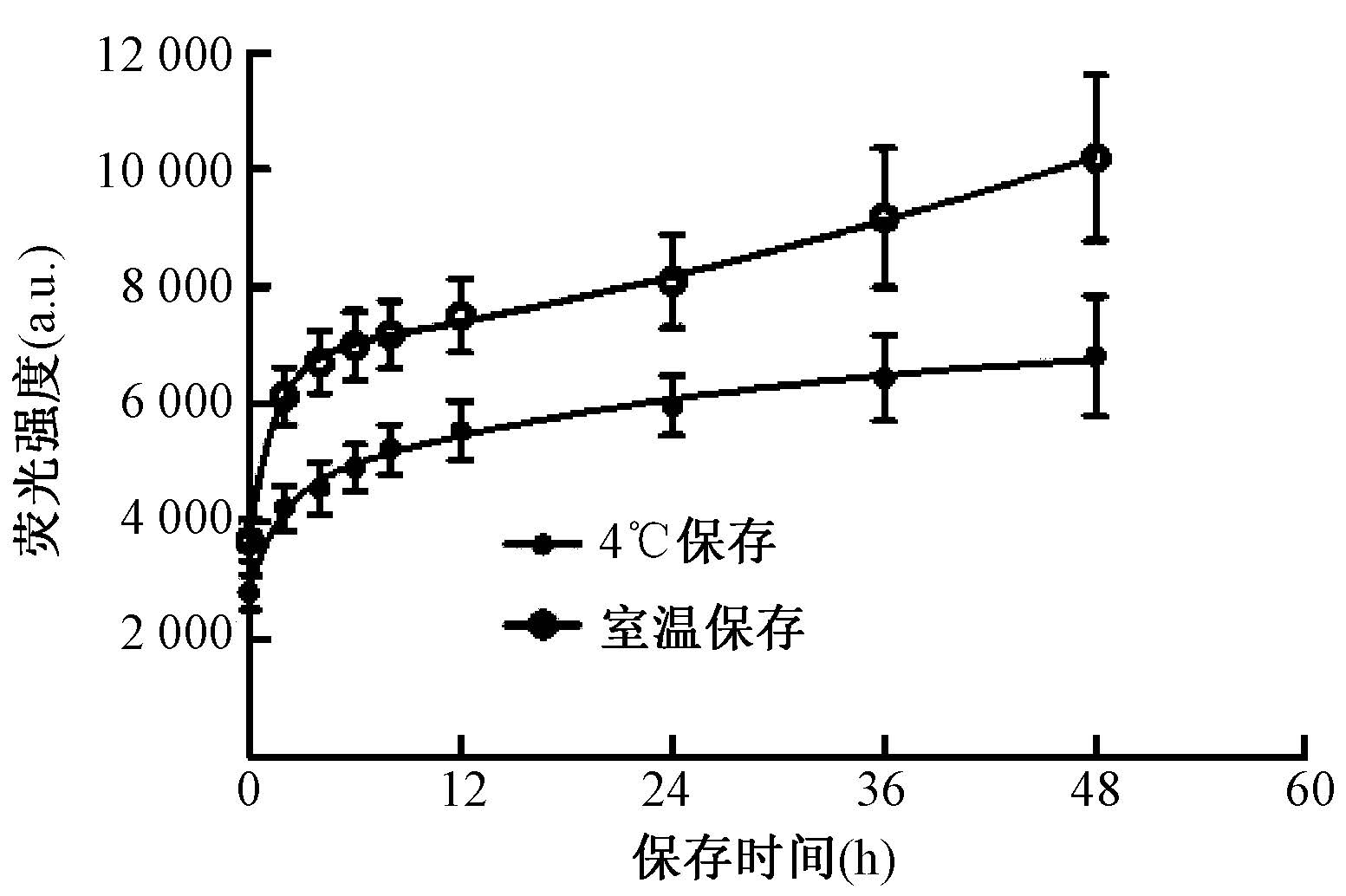
|
图 6 不同温度条件下荧光强度的稳定性 Figure 6 The stability of the fluorescence intensity of Alexa Fluor 488-DNA-BHQ1 solutions under different temperatures |
讨 论
现行检测辐射吸收剂量的方法以电离室剂量计、热释光剂量计、凝胶剂量计为主。每种方法都有相应局限性,如电离室剂量计灵敏度高,但组织等效性差,检测不同能量射线需进行能量修正等问题[5];热释光剂量计携带方便,但吸收能量检测时一次性释放,无法重复检测[6];凝胶剂量计可以应用于三维剂量测量,存在操作复杂,无明显剂量响应性等问题[7]。化学剂量计利用辐射在适当的化学体系引起的化学变化与吸收剂量的关系测量物质中吸收剂量,测量这些化学变化最常用的测量方法是光化学测量方法,用于上述固(气)剂量计无法使用的场合。
本实验利用Alexa Fluor 488的荧光共振能量转移原理(FRET),制作成新型荧光探针,其结构为5′ Alexa Fluor 488-AGGGTTAGGG 3′BHQ1。Alexa Fluor 488荧光强度强,且发光稳定性好,作为发射荧光分子,将其连接在DNA 5′端上,另一3′端接上BHQ1淬灭荧光基团。BHQ1作为Alexa Fluor 488的特异淬灭荧光基团,BHQ1的吸收光谱与Alexa Fluor 488发射光谱完全重叠[8],荧光本底很小。将荧光探针溶于水中,X射线或γ射线照射水溶液产生羟自由基,由于羟自由基作用于DNA链,导致DNA链的断裂,DNA的断裂数量与样品吸收剂量成正比,BHQ1与Alexa Fluor 488分离,BHQ1对Alexa Fluor 488的FRET作用消失,从而可以检测到Alexa Fluor 488发出的荧光信号,荧光强度与吸收剂量成正比[9]。本实验参考文献[10]确定DNA序列为5′ AGGGTTAGGG 3′,实验表明,BHQ-1对Alexa Fluor 488的淬灭效果好,使荧光探针的本底荧光更低,较之前研究使用羧基荧光素-寡核苷酸-羧基四甲基罗丹明荧光探针[11]的本底荧光低,可以检测更低的吸收剂量,实验中最低剂量响应可达到0.1 Gy,最大线性范围可达30 Gy,临床单次照射剂量一般不会超过20 Gy,所以该荧光探针满足临床单次照射治疗剂量的测量要求。
实验用的荧光探针浓度为0.1~1 μmol/L,实验结果比较,测量0~30 Gy剂量范围内,检测浓度选择0.5~1 μmol/L比较合适,吸收剂量与荧光强度有着良好的线性关系,灵敏度可低于0.1 Gy。样品在受照后20~80 min时间内荧光强度基本不变,可在此区间内进行检测。4℃条件下避光保存,Alexa Fluor 488-DNA-BHQ1荧光探针的荧光稳定性更好,并在24 h后荧光趋于稳定,满足在一定时间内反复测量的要求。
水溶液荧光剂量计较其他剂量计有着更大优势,组织等效性好,检测方法简单多样,灵敏度高。同时,可以将Alexa Fluor 488-DNA-BHQ1荧光探针加入到不同基质中,用于不同的检测目的。如将探针掺入凝胶中,做成二维、三维剂量计,可以测量二维、三维剂量分布,用于放射治疗计划剂量验证;将荧光探针掺入细胞,测量细胞水平的吸收剂量。本实验证明Alexa Fluor 488-DNA-BHQ1荧光探针可以应用于吸收剂量的测量,更多的应用有待进一步研究。
利益冲突 本人与本人家属、其他研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 林温文设计研究方案,收集数据后统计并起草论文;史盼影协助实验;张保国指导、监督试验进行,修改论文
| [1] | Ebraheem S, Abdel-Fattah AA, Beshir WB, et al. Formyl violet cyanide liquid dosimetry system[J]. Radiat Phys Chem, 2007, 76 (7) :1218–1221 . doi:10.1016/j.radphyschem.2006.11.013 |
| [2] | Beshir WB, Eid S, Gafar SM, et al. Application of solutions of Rhodamine B in dosimetry[J]. Appl Radiat Isot, 2014, 89 (6) :13–17 . doi:10.1016/j.apradiso.2013.11.030 |
| [3] | Stryer L. Fluorescence energy transfer as a spectroscopic ruler[J]. Annu Rev Biochem, 1978, 47 :819–846 . doi:10.1146/annurev.bi.47.070178.004131 |
| [4] | Morishima S, Suzuki F, Nishimune A, et al. Visualization and tissue distribution of α1L-adrenoceptor in human prostate by the fluorescently labeled ligand Alexa-488-silodosin[J]. J Urol, 2010, 183 (2) :812–819 . doi:10.1016/j.juro.2009.09.078 |
| [5] | Almond PR, Svensson H. Ionization chamber dosimetry for photon and electron beams[J]. Acta Radiol Ther Phys Biol, 1977, 16 (2) :177–186 . doi:10.3109/02841867709134310 |
| [6] | Duch MA, Ginjaume M, Chakkor H, et al. Thermoluminescence dosimetry applied to in vivo dose measurements for total body irradiation techniques[J]. Radiother Oncol, 1998, 47 (3) :319–324 . doi:10.1016/S0167-8140(98)00013-9 |
| [7] | Maryanski MJ, Schulz RJ, Ibbott GS, et al. Magnetic resonance imaging of radiation dose distributions using a polymer-gel dosimeter[J]. Phys Med Biol, 1994, 39 (9) :1437–1455 . doi:10.1088/0031-9155/39/9/010 |
| [8] | 夏寿萱. 放射生物学[M]. 北京:军事医学科学出版社. 1998 : 72 . |
| [9] | Xia SX. Radiation biology[M]. Beijing: Military Medical Science Press. 1998 : 72 . |
| [10] | 张宁. 纳米金复合体系荧光探针的设计、研制及应用[D]. 济南:山东师范大学, 2007. Zhang N. The design, development and application of gold nanoparticles complex Fluorescent probe[D]. Jinan: Shandong Normal University, 2007. |
| [11] | Ma HG, Shi PY, Lin WW, et al. Application of carboxyfluorescein-oligonucleotide-carboxytetramethylrhodamine fluorescent probe in dosimetry[J]. J Radiat Res Radiat Proc, 2015, 33 (5) :15–19 . doi:10.11889/j.1000-3436.2015.rrj.33.050202. |
 2016, Vol. 38
2016, Vol. 38


