我国20世纪80年代研制了几种获准可供人体应用的放射损伤防治药物,其中,雌激素类抗放药尼尔雌醇具有低毒、高效、给药方便、便于储存、价格低廉等特点,可基本满足军队和民众对抗放药品的需求,国家食品药品监督管理局(SFDA)已经批准尼尔雌醇用于急性放射病早期治疗。尼尔雌醇最大特点是预防时间窗长,照前7 d内1次给药均有抗放作用,最佳给药时间是照前24~48 h内[1-2]。在上述给药条件下,尼尔雌醇与美军正在研究的抗放药如5-AED、BIO300、CBLB502等相比,其抗放效果相对较弱。尼尔雌醇为雌三醇的衍生物,在用药剂量较大时可能出现暂时性乳房胀痛、硬结和月经失调等症状。本研究的目的是在尽量减少不良反应的情况下,探索增加尼尔雌醇照前给药次数能否提升其抗放效果。本研究首次发现尼尔雌醇照前连续或间隔给药,即多次给药,可显著提升致死性照射小鼠的存活率,促进受照小鼠外周血象和骨髓象恢复,并显著增加受照小鼠骨髓造血干祖细胞数量,保护造血干祖细胞的质量,为抗放药尼尔雌醇在核医学应急救援中的应用提供了实验依据。
材料与方法1. 试剂与仪器:化合物尼尔雌醇由军事医学科学院李鲁老师馈赠,以4%的二甲基亚砜加96%体积的聚乙二醇配制。抗鼠 CD117(C-kit) PE-Cy5抗体和抗鼠Ly-6A/E(Sca-1)PE-Cy7抗体由美国eBioscience公司生产,FITC 抗鼠Lineage[CD3/Gr-1/CD11b/CD45R(B220)]抗体、PE抗鼠CD34抗体和APC抗鼠CD135抗体均由美国Biolegend公司生产。MethoCult GF M3434造血干/祖细胞集落培养液由加拿大Stem Cell Technologies公司生产。BD FACSVerseTM流式细胞仪购自美国BD公司。MEK-7222K型Celltac E全自动血细胞分析仪购自日本光电株式会社。
2.实验动物:实验采用6~8周龄SPF级C57BL/6J雄性小鼠(22±2) g,购自北京华阜康生物科技股份有限公司,动物饲养设施合格证号SCXK(京)2014-0004,动物质量合格证号11401300029556。饲养于军事医学科学院实验动物中心屏障系统,动物饲养合格证号SYXK-(军)-2012-004,每笼5只,饲以SPF级维持饲料,动物饮用水供其自由饮用,温度(24±2)℃,相对湿度为50%~60%,昼夜12 h交替。小鼠购买后观察3 d后称重,并用完全随机法进行分组。
3.动物分组及给药方式:存活率实验中小鼠分为照射对照组和药物组,药物组根据给药次数的不同分为1次给药组(照前1 d给药)、2次间隔给药组(照前1、3 d给药)及3次间隔给药组(照前1、3、5 d给药),每组10只。外周血象检测实验中,将小鼠分为照射对照组和药物组,药物组分为1次给药组、2次给药组及3次连续给药组(照前1、2、3 d给药),每组8只。集落培养和骨髓病理实验中,小鼠均分为对照组和药物组,对照组分为正常对照组和照射对照组,药物组分为1次给药组和2次给药组,每组3只。骨髓造血干细胞(Lin-Sca-1+c-Kit+,LSK)检测实验中小鼠分为照射对照组和药物组,对照组分为正常对照组和照射对照组,药物组分为1次给药组、2次给药组,正常对照组3只,其余每组7只。动物实验经军事医学科学院实验动物伦理委员会通过。
尼尔雌醇采取灌胃给药,每次给药5 mg/kg,0.2 ml。正常对照组和照射对照组均给以辅剂。
4. 动物照射:照射小鼠装有机玻璃盒固定后于军事医学科学院钴源操作室接受60Co γ射线全身照射(TBI),吸收剂量率为(51.3±0.2) cGy/min。除存活率实验小鼠照射剂量为9.0 Gy外,其余实验照射剂量均为6.5 Gy。
5. 存活率实验:小鼠照射后每天观察动物存活数至30 d,并于给药前(0 d)、照后1、4、7、10、14、18、22和30 d记录小鼠体重,观察体重变化。
6. 外周血象检测:于给药前(记为0 d),照后14 d割尾静脉采血,每次每只小鼠采20 μl,注入2 ml血细胞稀释液里,以全自动血细胞分析仪进行血细胞检测计数,检测前将样本充分混匀。
7. 骨髓有核细胞(BMNCs)计数和造血干祖(LK/LSK)细胞检测:将小鼠脱颈椎处死,取两侧股骨,将骨髓制成单细胞悬液,取50 μl用于有核细胞计数,其余用于LSK检测。骨髓细胞用CD16/32抗体4℃孵育10 min,Lineage抗体、Sca-1抗体、c-Kit抗体、CD34抗体和Flt-3抗体4℃标记30 min,同类抗体作同型对照。4℃预冷的PBS洗涤两次,以RPMI 1640培养液重悬,流式细胞仪检测骨髓有核细胞(BMNCs)中的Lin-Sca-1-c-Kit+(LK)和LSK细胞及LSK中CD34-Flt-3-(LT-HSCs)和CD34+Flt-3-(ST-HSCs)细胞。
8. 骨髓细胞集落形成试验:于无菌条件下取两侧股骨,冲出骨髓,用MethoCult GF M3434 造血干/祖细胞集落培养基调整BMNCs浓度到5×105/L,12孔板每孔接种1 ml,每组3个复孔。37℃、5%CO2培养箱培养。第7天分别计数粒细胞-单核细胞集落生成单位(CFU-GM)、爆式红系集落生成单位(BFU-E)、巨核细胞集落生成单位(CFU-MK)和混合集落生成单位(CFU-Mix)。
9. 骨髓病理:将小鼠脱颈椎处死,取两侧股骨,于4%中性甲醛中固定5 d,流水冲洗30 min,置5%甲酸溶液中脱钙5 d左右至骨头有弹性易弯曲,流水冲洗24 h洗去脱钙液,然后经常规脱水,浸蜡,包埋,切片,脱蜡,苏木素-伊红染色,中性树胶封片,于光学显微镜下观察骨髓组织病理改变。
10. 统计学处理:所有数据均采用x±s表示,以GraphPad Prism 6进行统计分析作图。外周血细胞计数采用单因素方差分析比较组间差异,具有组间差异的时间点采用t检验比较两组间差异。其他多个样本均数的实验采用单因素方差分析,存活率实验用Kaplan-meier法绘制存活曲线,采用Log-rank test进行比较分析。P<0.05为差异有统计学意义。
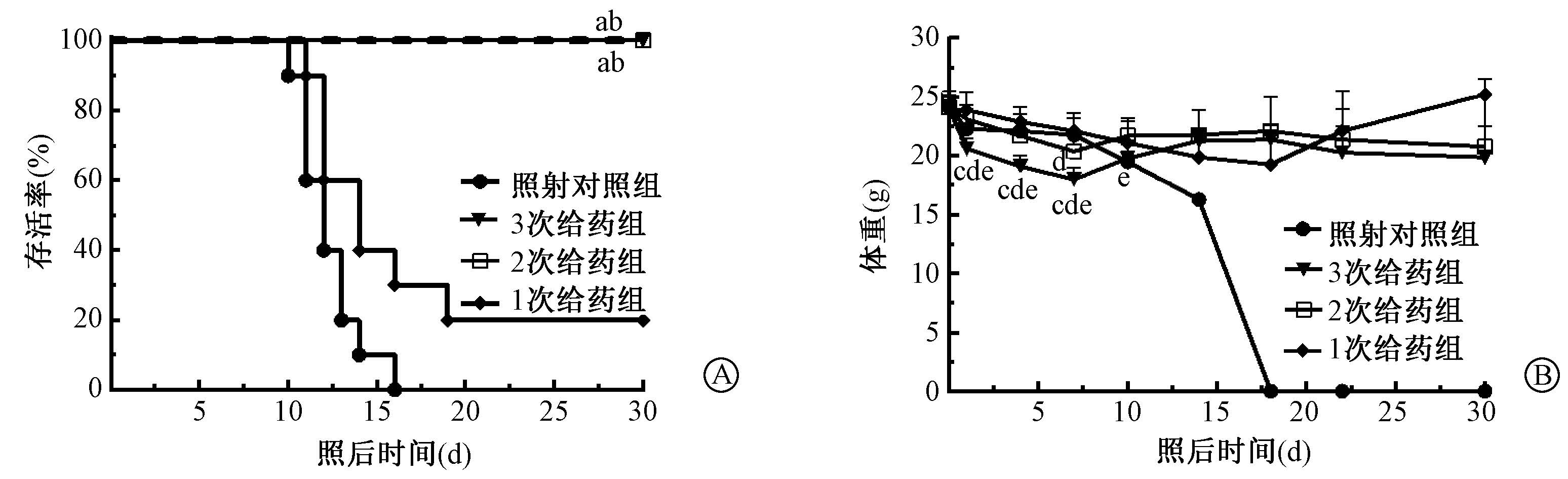
结果1.存活率的变化:如图 1A所示,小鼠9.0 Gy全身照射后,照射对照组小鼠照后10 d开始出现死亡,16 d全部死亡,平均存活时间(12±4)d;1次给药组小鼠30 d存活率为20%,死亡小鼠平均存活时间为(13±6)d;2次给药组与3次给药组小鼠存活率均达到100%。1次给药组小鼠与照射对照组相比,差异无统计学意义(P>0.05)。而2次给药组及3次给药组与照射对照组比较,小鼠存活率明显提高(χ2=21.66、21.66,P<0.05),平均存活时间明显延长;同时存活率高于1次给药组,差异有统计学意义(χ2=13.36、13.36,P<0.05)。
|
注:a与照射对照组比较,χ2=21.66、21.66,P<0.05;b与1次给药组比较,italic>χχ2=13.36、13.36, P<0.05;c与照射对照组比较,t=2.45、5.70、6.98,P<.05;d与1次给药组比较,t=5.97、7.60、 2.71、7.19,P<0.05;e与2次给药组比较,t=6.21、5.20、4.63、3.54,P<0.05 图 1 各处理组小鼠存活率及体重变化 A.存活率曲线; B.体重变化 Figure 1 Survival rates and body weight of mice after irradiation A. Survival curves; B. Changes in body weight |
体重变化:3次给药组小鼠照射后体重有下降的趋势,在1、4和7 d均低于照射对照组、1次给药组和2次给药组(t=2.45~7.60,P<0.05),同时在10 d时低于2次给药组(t=3.54,P<0.05);2次给药组与照射对照组比较,差异无统计学意义,同时2次给药组除7 d时体重略微低于1次给药组(t=2.71,P<0.05)外,其余时间点体重与1次给药组比较,差异无统计学意义(图 1B)。说明增加给药次数至3次时,产生了明显的不良反应。
2. 外周血象的变化:如表 1所示,与照射对照组比较,照前1次给药组在照后14 d对外周血细胞提高作用不明显,仅血小板数差异有统计学意义(t=4.55,P<0.05)。2次给药组、3次给药组与照射对照组之间在白细胞、红细胞、血小板和中性粒细胞上差异均有统计学意义(F=21.33、100.9、49.34、19.19,P<0.05),同时与1次给药组之间差异也有统计学意义(F=17.11、63.38、21.89、14.37,P<0.05)。但2次给药组与3次给药组之间,各类血细胞差异均无统计学意义(P>0.05)。
|
|
表 1 照射后14 d小鼠外周血象的变化(x±s) Table 1 Peripheral blood cell counts of irradiated mice on day 14(x±s) |
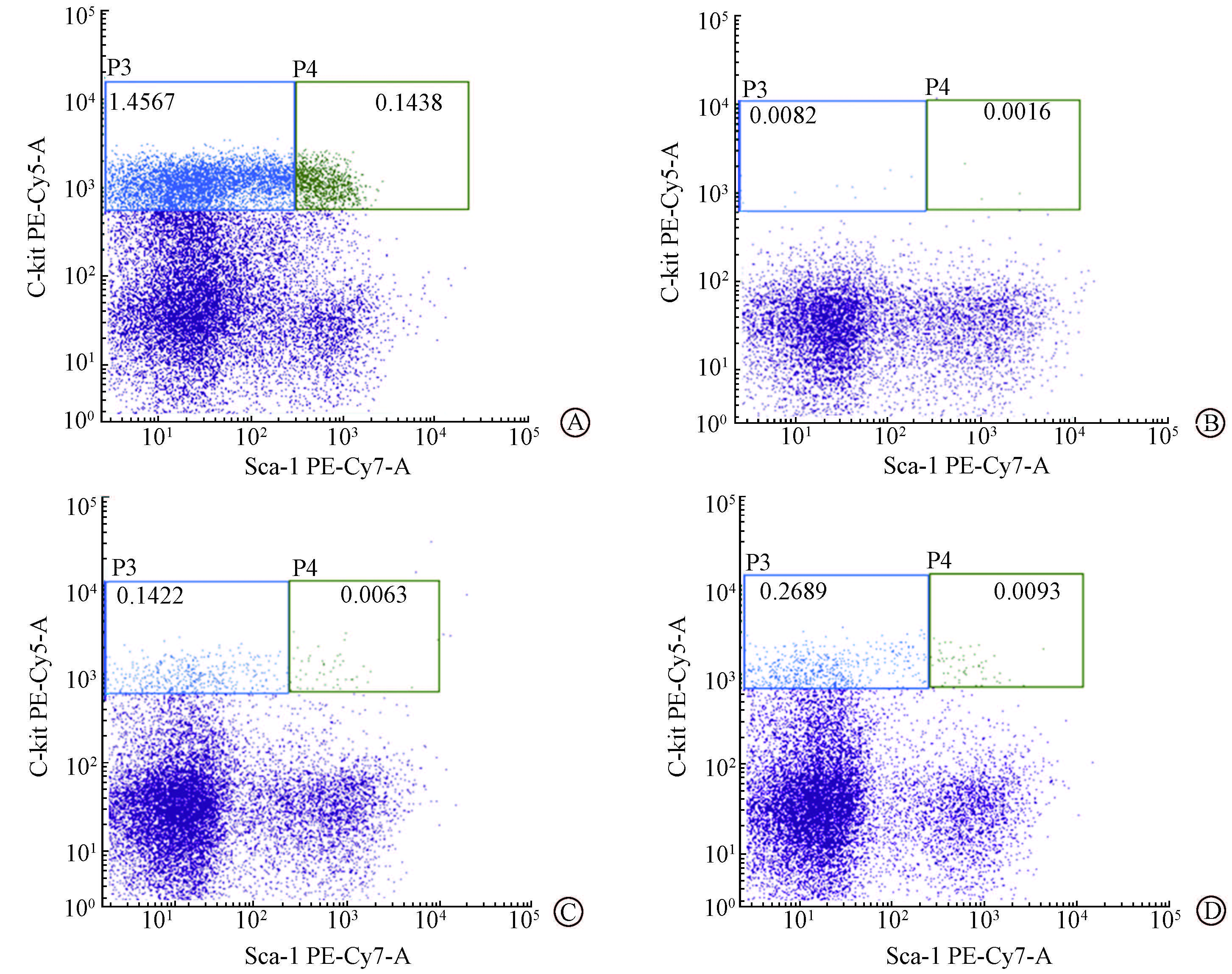
3.骨髓有核细胞数和骨髓造血干/祖细胞数量的变化:2次给药组及1次给药组BMNCs较照射对照组明显增加(t=3.99、8.18,P<0.05),且2次给药组明显优于1次给药组(t=3.06,P<0.05)。应用流式细胞仪分析照后10 d骨髓造血干细胞(Lin-Sca-1+c-Kit+,LSK)和祖细胞(Lin-Sca-1-c-Kit+,LK)数量,发现2次给药组和1次给药组LSK和LK数量较照射对照组均有显著升高(t=7.09、4.86、8.58、2.80,P <0.05),同时2次给药组LSK和LK数量均高于1次给药组(t=3.69、2.91,P<0.05,表 2)。LSK和LK在BMNc中的比例差异也有统计学意义(F=43.08、8.81,P<0.05,图 2)。
|
|
表 2 照射后小鼠骨髓有核细胞数和造血干祖细胞数量的变化(×103/股骨,x±s) Table 2 The cellularity of BMNCs, HPCs and HSCs in bone marrow of mice after irradiation(×103/Femur,x±s) |
|
图 2 照射后小鼠骨髓LSK/LK比例的变化 A.正常对照组;B. 照射对照组;C.1次给药组;D.2次给药组 Figure 2 Ratios of LK/LSK in BMNCs of mice after irradiation A. Normal group; B. Irradiation group;C. Single administration group; D. Twice administration group |
另外,对HSCs中的LT-HSCs(CD34-Flt-3- LSK)、ST-HSCs(CD34-Flt-3+ LSK)及MPPs(CD34+Flt-3+ LSK)进行分析,药物组LT-HSCs和ST-HSCs均高于照射对照组(t=5.43、4.00、3.35、2.58,P<0.05),另外,2次给药组ST-HSCs高于1次给药组。而照射后MPPs数量较少,药物组和照射对照组差异无统计学意义(P>0.05)。
4.骨髓造血细胞集落形成实验:结果列于表 3。照射后,照射对照组各系的骨髓细胞集落形成能力明显降低,甚至不能形成集落;药物组均能不同程度的提高照后小鼠骨髓造血细胞各系集落形成能力。1次给药组CFU-GM和CFU-Mix的数量有所增加(t=7.86、6.57,P<0.05),而2次给药组在CFU-GM、BFU-E、CFU-Mix和CFU-MK数量上均有增加(t=7.95、4.95、7.27、7.56,P<0.05)。2次给药组与1次给药组比较,在CFU-Mix和CFU-MK数量上都有增加(t=4.29、6.34,P<0.05)。
|
|
表 3 各处理组小鼠骨髓造血细胞集落形成能力的变化(5×105/L,x±s) Table 3 CFU assays of BM cells in mice(5×105/L,x±s) |
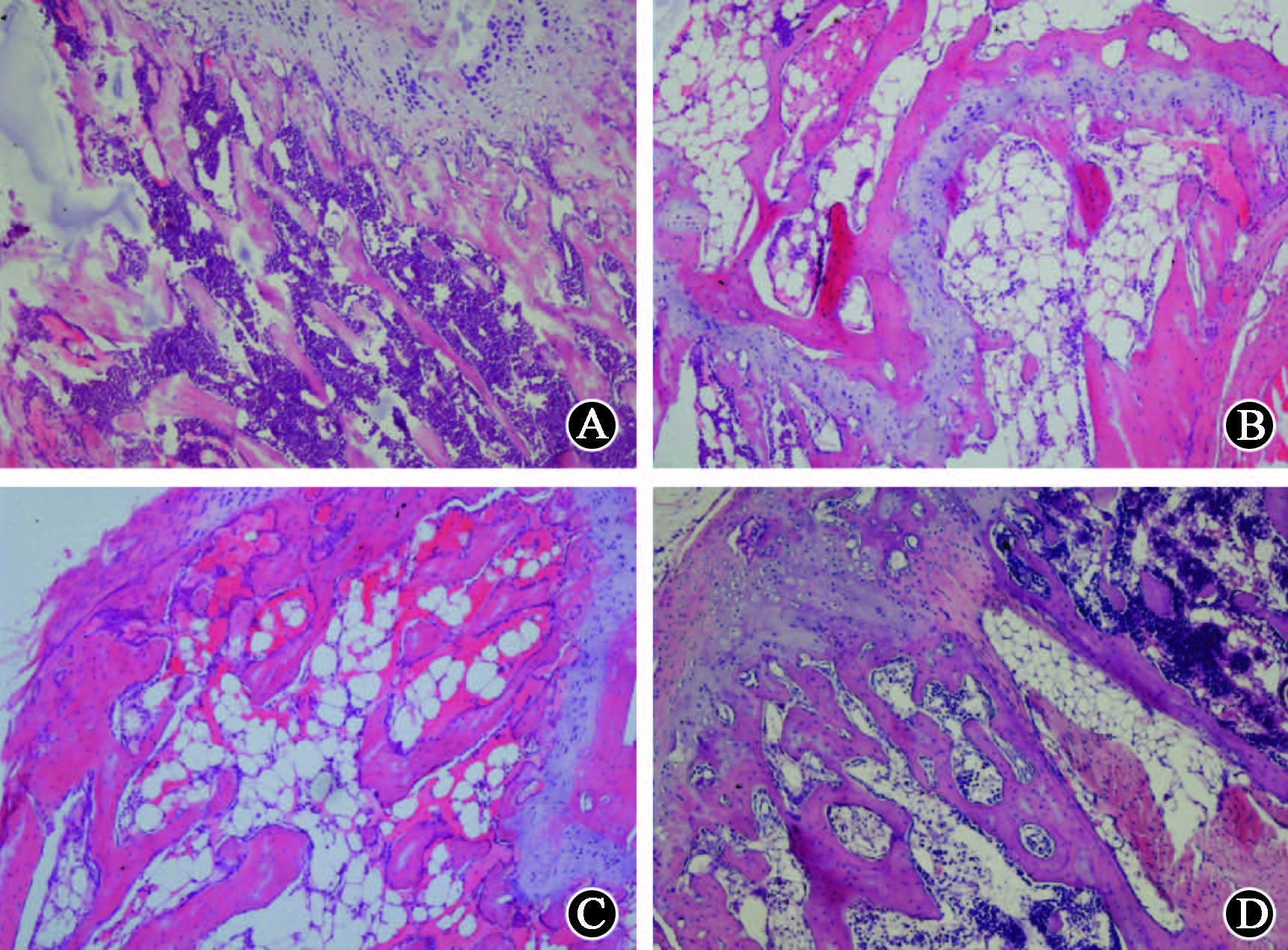
5. 骨髓病理学变化:正常对照组小鼠骨髓腔细胞填充完全,骨小梁完整,照射后小鼠骨髓出现明显空洞,脂肪细胞增加,骨髓有核细胞明显减少,骨小梁连接点减少,形态不完整(图 3A、B)。与照射对照组相比,1次给药组骨髓有核细胞数增加,多附着于骨小梁位置,骨小梁链接点增多,损伤程度有所减轻(图 3C)。而2次给药组可见成簇的骨髓有核细胞,骨髓空洞减少,骨小梁结构更加完整,骨小梁所占容量增加(图 3D),组织损伤程度较照射对照组和1次给药组明显好转。
|
A.正常对照组;B.照射对照组;C.1次给药组;D.2次给药组 A. Normal group, B. Irradiation group; C. Single administration group, D. Twice administration group 图 3 各处理组小鼠骨髓病理的变化 HE染色 ×200 Figure 3 Bone marrow histological analyses of mice |
讨 论
本研究通过观察致死性照射小鼠30 d存活率、亚致死照射小鼠血象恢复等指标,比较了尼尔雌醇照前24 h单次给药、照前2次间隔给药(照前1、3 d给药)、照前3次间隔给药(照前1、3、5 d给药)和照前3次连续给药(照前1、2、3 d给药)4种给药方式的抗放效果的差异。发现尼尔雌醇常规给药即照前24 h单次给药的抗放效果有限,与以往的研究资料一致;增加给药次数后,其抗放效果显著提升,连续给药与间隔给药之间差异无统计学意义;参比本实验室的已有研究资料,尼尔雌醇照前多次给药的疗效优于美军正在研究的抗放药如5-AED、BIO300和EX-RAD。由于核武器袭击以及辐射事故具有诸多不确定性,考虑到核医学应急救援的实际情况,建议尼尔雌醇照射前采用间隔1 d两次给药的方式,在尽量减少其不良反应的情况下,获得最佳的抗放效果。
骨髓造血干细胞增殖与功能重建是照后小鼠外周血恢复和存活率提高的细胞学基础。在以往的研究中,基于当时的实验条件,主要应用骨髓造血细胞集落培养及内源性和外源性脾结节计数等间接方法,观察了尼尔雌醇对照后小鼠骨髓造血干、祖细胞增殖的影响,发现尼尔雌醇照前预防给药可显著提高照后极期和恢复期小鼠骨髓集落形成率和内源性和外源性脾结节数[2-5]。本次研究除了验证这一效果以外,还对2次给药的有效性进行了评价,同时本结果还显示,尼尔雌醇照前1次给药可增加照后10 d鼠骨髓中造血祖细胞 (Lin-Sca-1-c-Kit+,LK) 和造血干细胞 (Lin-Sca-1+c-Kit+,LSK)数量,提高骨髓造血细胞CFU-GM形成率,促进照后骨髓象恢复,而尼尔雌醇照前2次给药在相应指标上的疗效更为突出,并在多个指标上与照前单次给药差异有统计学意义,这些效应也与其在外周血象恢复和存活率提高上的结果相一致。骨髓长期造血干细胞多数处于静息态,对射线耐受;只有少数造血干细胞处于增殖态,通过不断的增殖分化形成成熟的造血细胞,这类处于增殖状态的细胞对射线敏感[6-7]。6.5 Gy照射小鼠照后10 d,骨髓造血刚开始恢复,与正常对照组相比,照射后小鼠骨髓长期造血干细胞 (LT-HSCs,CD34-Flt-3- LSK)和短期干细胞(ST-HSCs,CD34+Flt-3- LSK)数量显著减少,但比例相对多系造血祖细胞(MPPs,CD34+Flt-3+ LSK)明显增加。两个尼尔雌醇给药组中,骨髓LT-HSCs和ST-HSCs数量较单纯照射组均有显著增加,照前2次间隔给药组效果更好,尼尔雌醇可能通过保护骨髓LT-HSCs来减少照射引起的骨髓造血损伤。
尼尔雌醇作为抗放药物在中国已批准上市,但目前对尼尔雌醇抗放作用机制仍认识不清。葛忠良等[4]报道尼尔雌醇对健康小鼠骨髓集落形成率(CFU-C)有一过性抑制作用,但对小鼠全身照射后1周的骨髓CFU-C有辐射防护作用。唐佩弦[2]报道雌激素一类抗放药对正常造血的抑制作用是通过体内复杂的调节系统来实现的,如尼尔雌醇、3-棕榈酸-17β-棕榈酸雌二醇(“棕二”)等可能通过垂体-肾上腺影响了体内复杂调节系统中远距调节的某个环节;但是,雌二醇在体外照射的血液中有明显的保护细胞的作用,说明它可能同时又影响了造血的近距调节功能,或直接作用于造血细胞[8]。近年来研究发现,雌性小鼠骨髓造血干细胞更新频率明显高于雄性小鼠,给予外源雌二醇或妊娠期间造血干细胞更新频率增加更显著[9]。另报道给小鼠注射高剂量的他莫西芬,通过激活雌激素受体α,可引起骨髓ST-HSCs和MPPs细胞凋亡,同时也能引起静息态造血干细胞增殖[10]。长期给小鼠注射低剂量的雌二醇(0.24 mg ·kg-1 ·d-1×4周)可显著增加骨髓LSK数量,而1次大剂量雌二醇注射(5 mg/kg)可显著降低骨髓LSK数量[11-12]。据此推测,尼尔雌醇照前连续或间隔给药的抗放增效作用可能是其增强了尼尔雌醇对正常造血的抑制作用,通过负反馈调节,促进了体内具有抗放活性的细胞因子或介质的分泌,进而提升了其抗放效果,其具体作用机制有待于进一步深入研究。
利益冲突 本人与本人家属、其他研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 仪丽荣设计研究方案,实施实验,收集数据后统计并起草论文;王丽梅、柳晓兰协助实验,集落培养;善亚君协助实验,流式检测;从玉文设计、指导实验思路、监督实验进行,修改论文;余祖胤、罗庆良修改论文
| [1] | 戴昌世, 王秉伋. 抗辐射药物研究[M]. 北京:军事医学科学出版社. 2003 . Dai CS, Wang BJ. Researches on radioprotectors[M]. Beijing:Military Medical Science Press. 2003 . |
| [2] | 唐佩弦. 雌激素等抗放药对造血系统的作用[J]. 中国人民解放军军事医学科学院院刊, 1979,6 (2) :159–168. Tang PX. The effects of estriol on hemopoietic system[J]. J Acad Mil Med Sci, 1979, 6 (2) :159–168 . |
| [3] | 夏贞彪, 王建国, 邢瑞云, 等. “523”药物对受照小鼠造血系统的影响[J]. 中华放射医学与防护杂志, 1994,14 (5) :322–324. Xia ZB, Wang JG, Xing RY, et al. Effect of "523" on hematopoietic reconstitution in irradiated mice[J]. Chin J Radiol Med Prot, 1994, 14 (5) :322–324 . |
| [4] | 葛忠良, 刘秀珍, 刘雪桐. 3-环戊醚17-乙炔雌三醇对照射小鼠CFU-C的影响[J]. 中国人民解放军军事医学科学院院刊, 1981,16 (4) :417–421. Ge ZL, Liu XZ, Liu XT. The effect of 3-cyclopentyi-17-ethynyl estriol on bone marrow CFC-C of the irradiated mice[J]. J Acad Mil Med Sci, 1981, 16 (4) :417–421 . |
| [5] | 杜德林, 袁金昌, 谢顺华, 等. 雌三醇衍生物对小鼠骨髓造血干细胞的放射防护作用[J]. 中国人民解放军军事医学科学院院刊, 1980,12 (4) :359–364. Du DL, Yuan JC, Xie SH, et al. The radioprotective effects of a derivative of estriol on hemopoietic stem cells in mice[J]. J Acad Mil Med Sci, 1980, 12 (4) :359–364 . |
| [6] | Shao LJ, Luo Y, Zhou DH. Hematopoietic stem cell injury induced by ionizing radiation[J]. Antioxid Redox Signal, 2014, 20 (9) :1447–1462 . doi:10.1089/ars.2013.5635 |
| [7] | Li L, Clevers H. Coexistence of quiescent and active adult stem cells in mammals[J]. Science, 2010, 327 (5965) :542–545 . doi:10.1126/science.1180794 |
| [8] | 吴祖泽, 孙伯威, 程伊洪. 3-棕榈酸-17β-棕榈酸雌二醇(棕二)对正常和600仑照射小鼠造血功能的影响[J]. 中国人民解放军军事医学科学院院刊, 1979,5 (1) :7–15. Wu ZZ, Sun BW, Cheng YH. The effect of 3-palmitic acid-17β-palmitic acid estriol on hematopoietic reconstitution of nomal and 6 Gy irradiated mice[J]. J Acad Mil Med Sci, 1979, 5 (1) :7–15 . |
| [9] | Sánchez-Aguilera A, Arranz L, Martín-Pérez D, et al. Estrogen signaling selectively induces apoptosis of hematopoietic progenitors and myeloid neoplasms without harming steady-state hematopoiesis[J]. Cell Stem Cell, 2014, 15 (6) :791–804 . doi:10.1016/j.stem.2014.11.002 |
| [10] | Thurmond TS, Murante FG, Staples JE, et al. Role of estrogen receptor alpha in hematopoietic stem cell development and B lymphocyte maturation in the male mouse[J]. Endocrinology, 2000, 141 (7) :2309–2318 . doi:10.1210/endo.141.7.7560 |
| [11] | Illing A, Liu P, Ostermay S, et al. Estradiol increases hematopoietic stem and progenitor cells independent of its actions on bone[J]. Haematologica, 2012, 97 (8) :1131–1135 . doi:10.3324/haematol.2011.052456 |
| [12] | Aguilera AS, Arranz L, Pérez DM, et al. Estrogen signaling selectively induces apoptosis of hematopoietic progenitors and myeloid neoplasms without harming steady-state hematopoiesis[J]. Cell Stem Cell, 2014, 15 (6) :791–804 . doi:10.1016/j.stem.2014.11.002. |
 2016, Vol. 38
2016, Vol. 38


