耐辐射奇球菌(Deinococcus radiodurans) 是迄今为止发现的耐辐射能力最强的微生物之一[1-2]。该菌对电离辐射、紫外线、氧化剂等所致的致死和突变效应具有极强的抗性,能耐受超过15 000 Gy的γ射线照射,抗辐射能力是大肠杆菌的250多倍,耐受剂量是人类的3 000倍 [3-5]。研究表明,D. radiodurans R1菌株中的pprI基因是抗辐射损伤的开关基因,pprI产物引起下游pprA和recA等基因的表达上调,促使辐射损伤修复[6-7]。将pprI基因真核表达载体转染到BALB/c小鼠中,可显著提高哺乳动物的辐射抗性[8-10];同时,利用大肠杆菌获得了高效表达纯化的PprI融合蛋白[11]。然而,由于原核生物与真核生物在基因组成、蛋白表达和调控机制诸方面存在巨大的差异,耐辐射奇球菌pprI原核基因能否在真核系统中高效表达和纯化,迄今少见报道。因此,本研究探讨了耐辐射奇球菌的pprI基因在毕赤酵母菌中的分泌表达及纯化方法,获得高效表达的PprI蛋白,为深入研究其生物学效应及其分子机制提供了实验依据。
材料与方法1. 菌株与质粒:大肠杆菌菌株 E. coli TOP10及毕赤酵母菌株P. pastoris GS115均为本实验室保藏,毕赤酵母表达载体质粒为pHBM-905A由湖北大学马立新教授惠赠。
2. 主要试剂:Taq DNA聚合酶、限制性内切酶、T4 DNA连接酶等均为大连宝生物工程公司产品,质粒DNA提取试剂盒和DNA片段凝胶回收试剂盒均为杭州爱思进公司产品,DNA分子标志物购自北京赛百盛公司,蛋白分子标志物购自美国Bio-Rad公司,酵母基础氮源(YNB)为美国DIFCO公司产品,鼠源聚组氨酸抗体标签(anti-His tag)抗体为美国Sigma公司产品,辣根过氧化物酶(HRP)交联的兔抗鼠抗体为美国Invitrogen公司产品,ECL化学发光试剂盒购自美国Millipore公司,Ni-NTA柱购自美国Thermo公司,二喹啉甲酸(BCA)试剂盒购自江苏省海门市碧云天生物技术研究所。其他试剂均为国产化学纯或分析纯产品。
3.pprI基因编码序列的合成与密码子优化:依据毕赤酵母密码子的偏爱性,对耐辐射奇球菌(D. radiodurans R1) pprI基因(Gene ID: 1798483 DR_0167) 中的蛋白质编码序列进行优化改造,全基因序列的合成与DNA测序均由上海杰李生物技术有限公司完成。
4. 引物合成:根据新合成pprI基因的序列设计引物,在其上游引入6×His标签序列。905-DR上下游引物序列分别为:上游5′ GTCA CATCATCACCACCATCAT GTTCCATCTGCTAACGTTTCTCCAC 3′,下游5′ GGCCATTATTGGGCAGCATCTTGTGGTTCA 3′,划线部分为6×His标签序列,引物由上海杰李生物技术有限公司合成。
5. 6×His-pprI基因的获得:用新合成的pprI基因为模板,以905-DR-F和905-DR-R为引物,在50 μl反应体系内进行PCR扩增反应。用琼脂糖凝胶电泳检测PCR反应产物。
6. 毕赤酵母重组表达质粒pHBM905A-His-pprI的构建:将6×His-pprI的PCR扩增产物(1 005 bp)在有dTTP存在条件下用T4 DNA聚合酶处理。将毕赤酵母表达载体pHBM905A用Cop I和Not I双酶切,经琼脂糖电泳分离,割胶回收大片段(7 719 bp)。将两者的反应产物进行连接,转化大肠杆菌TOP10感受态菌株,涂布LB/Amp培养基平板,37℃培养过夜。采用煮菌PCR方法筛选重组转化子,DNA测序鉴定。
7. 毕赤酵母菌株转化与重组克隆筛选:按照操作手册的方法,制备毕赤酵母感受态细胞。将鉴定正确的重组质粒pHBM-6×His-pprI经Sal I酶切线性化,电转化毕赤酵母GS115感受态细胞。将电转化后的毕赤酵母细胞涂布MD平板,28℃培养2~3 d后,随机挑取MD平板上的酵母转化子菌落,采用905-DR-F和905-DR-R为引物进行煮菌PCR鉴定。
8. 毕赤酵母重组菌株表达PprI蛋白:挑取经鉴定为阳性的pHBM-6×His-pprI毕赤酵母转化子,接种至含有50 ml BMGY培养基的500 ml摇瓶中,摇床转速为250~300 r/min,28~30℃培养至菌体OD600≈20~30。室温离心5 000 r/min,离心半径9.8 cm,离心5 min,去除上清,收集细胞,用50 ml BMMY培养基重新悬浮细胞,在28~30℃摇床中继续培养,每隔24 h向摇瓶中加入甲醇至终浓度为1%进行诱导表达。诱导表达3 d后,取15 μl培养上清液进行SDS-PAGE电泳及Western blot检测目的蛋白。
9. 表达蛋白的质谱鉴定:诱导表达的蛋白经SDS-PAGE电泳分离、染色后,切割目的条带,用50 μl双蒸水洗2次,每次10 min。用50 mmol/L NH4HCO3/HCN(1 ∶1)在37℃脱色3次,每次20 min。真空干燥10 min。加50 μl 10 mmol/L二硫苏糖醇(DTT)(用25 mmol/L NH4HCO3配制),56℃水浴1 h。样品冷至室温,去除溶液,快速加50 μl 30~40 mmol/L吲哚乙酸(IAA)(用25 mmol/L NH4HCO3配制),置于暗室45 min。依次用25 mmol/L NH4HCO3、25 mmol/L NH4HCO3+50%HCN各清洗胶条2次,每次10 min,再用HCN脱水至胶条变白,真空干燥10 min。将胶条用2~3 μl 胰蛋白酶液消化,4℃放置30 min。加25 mmol/L NH4HCO3至总体积 10~15 μl,37℃过夜。加入2 μl 0.1%三氟乙酸(TFA)终止反应,振荡混匀,收集酶解液,点靶。用美国Bruker Daltonics公司的Ultraflex Ⅱ TOF/TOF 质谱仪进行肽质量指纹图谱(peptide mass fingerprinting,PMF ) 分析。
10. 表达蛋白的纯化:将鉴定正确的毕赤酵母转化子在摇瓶中扩大培养。甲醇诱导表达6 d后,离心5 000 r/min,离心半径9.8 cm,离心5 min收集培养上清液,透析至50 mmol/L pH 8.0的Tris-HCl溶液中。然后,过Ni-NTA柱,用不同浓度咪唑洗脱收集目的蛋白。SDS-PAGE及Western blot鉴定纯化效果,用BCA试剂盒测定目的蛋白浓度。
结果1. 目的基因的克隆:经过对改造后的pprI基因进行DNA序列测定,表明其编码的PprI蛋白序列 (NP_293891.1) 完全正确。为了便于后续的PprI蛋白分离纯化,以上述合成的pprI基因为模板,利用905-DR-F和905-DR-R为引物进行PCR扩增反应,从而在pprI基因上游带上6×His标签。经琼脂糖凝胶电泳检查,结果表明PCR扩增产物的大小(1 005 bp)与预期一致(图 1)。
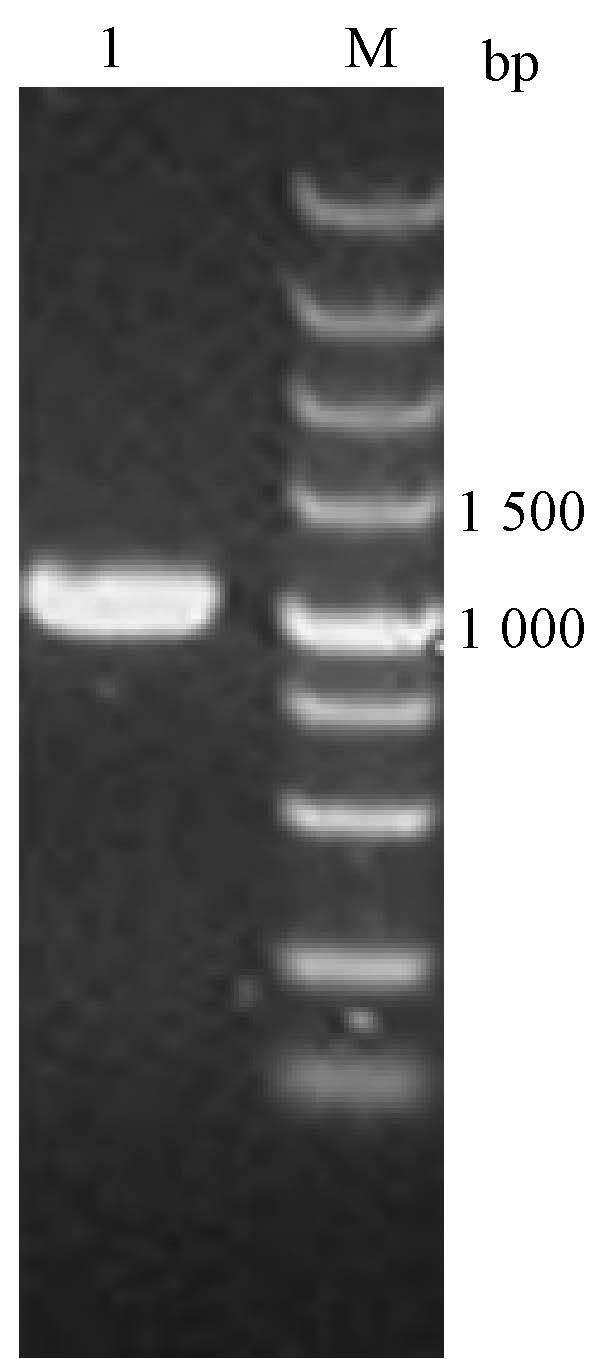
|
注:1.PCR扩增产物;M. DNA分子标志物 图 1 6×His-pprI基因PCR产物的琼脂糖凝胶电泳 Figure 1 Agarose gel electrophoresis of 6×His-pprI gene PCR product |
2. 毕赤酵母表达质粒的构建:将构建的重组表达质粒pHBM905A-6×His-pprI转化大肠杆菌TOP10,筛选转化子。用琼脂糖凝胶电泳对PCR扩增产物检测重组质粒。结果表明,从随机挑取得的4个转化子中都能扩增得到6×His-pprI基因片段(图 2)。随机选取其中1个重组质粒进行DNA测序,结果也证明重组质粒中插入的6×His-pprI基因与设计完全一致。
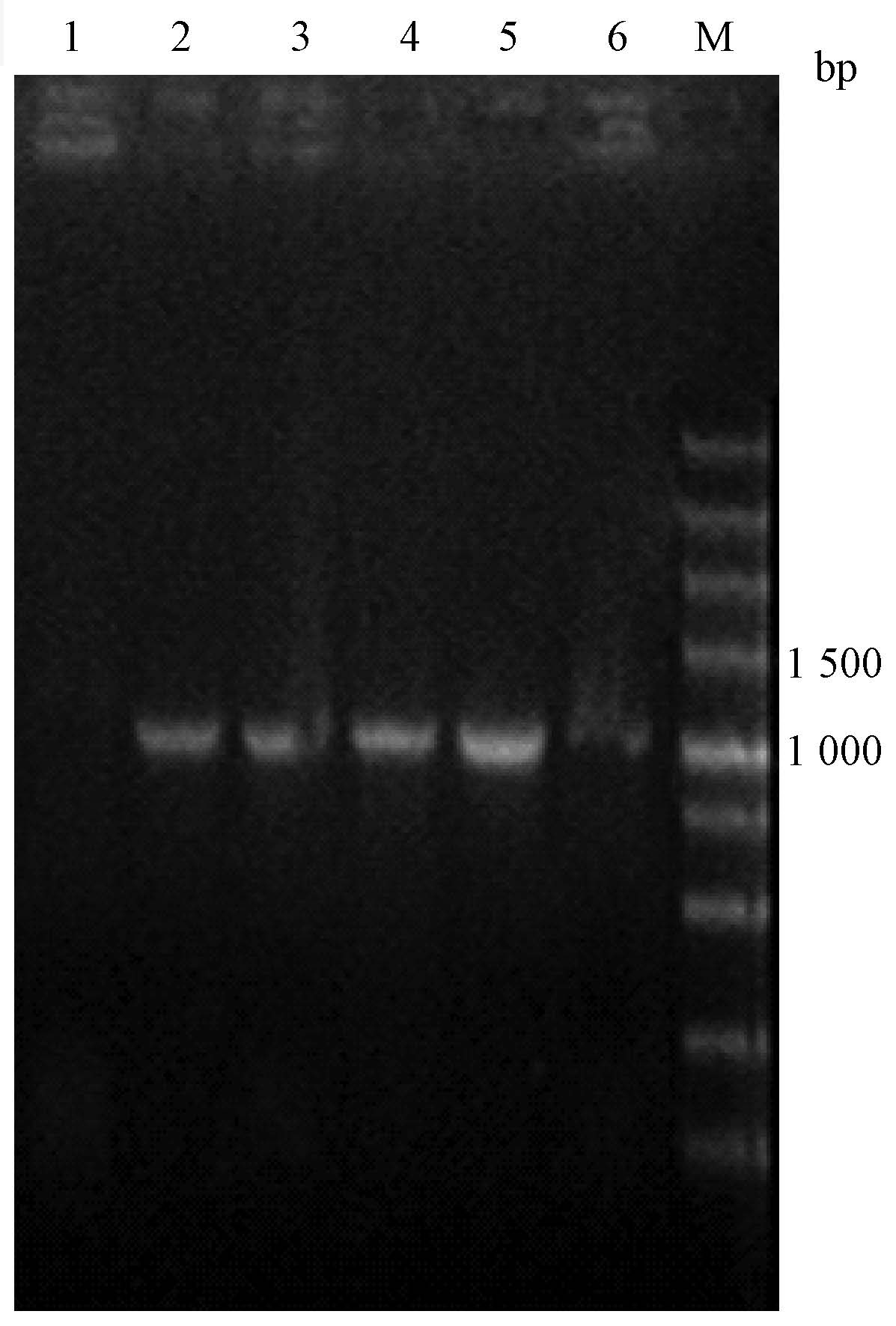
|
注:1.无模板DNA (阴性对照);2~5.4个转化子PCR产物;6. 以6×His-pprI基因为模板(阳性对照);M. DNA分子标志物 图 2 大肠杆菌重组子的PCR鉴定 Figure 2 PCR identification of recombinant Escherichia coli |
3. 毕赤酵母转化子的获得:将鉴定正确的重组质粒pHBM-6×His-pprI经Sal I酶切线性化(图 3),电转化毕赤酵母GS115感受态细胞。随机挑取12个酵母转化子菌落进行煮菌PCR鉴定。结果显示,12个酵母转化子中都能扩增出6×His-pprI基因条带,表明转化成功 (图 4)。

|
注:1. 重组质粒pHBM-6×His-pprI;2. 重组质粒pHBM-6× His-pprI经Sal I酶切;M. DNA分子标志物 图 3 pprI毕赤酵母重组质粒及其Sal I酶切 Figure 3 PprI Pichia pastoris recombinant plasmid and it ′s Sal I cleavage |
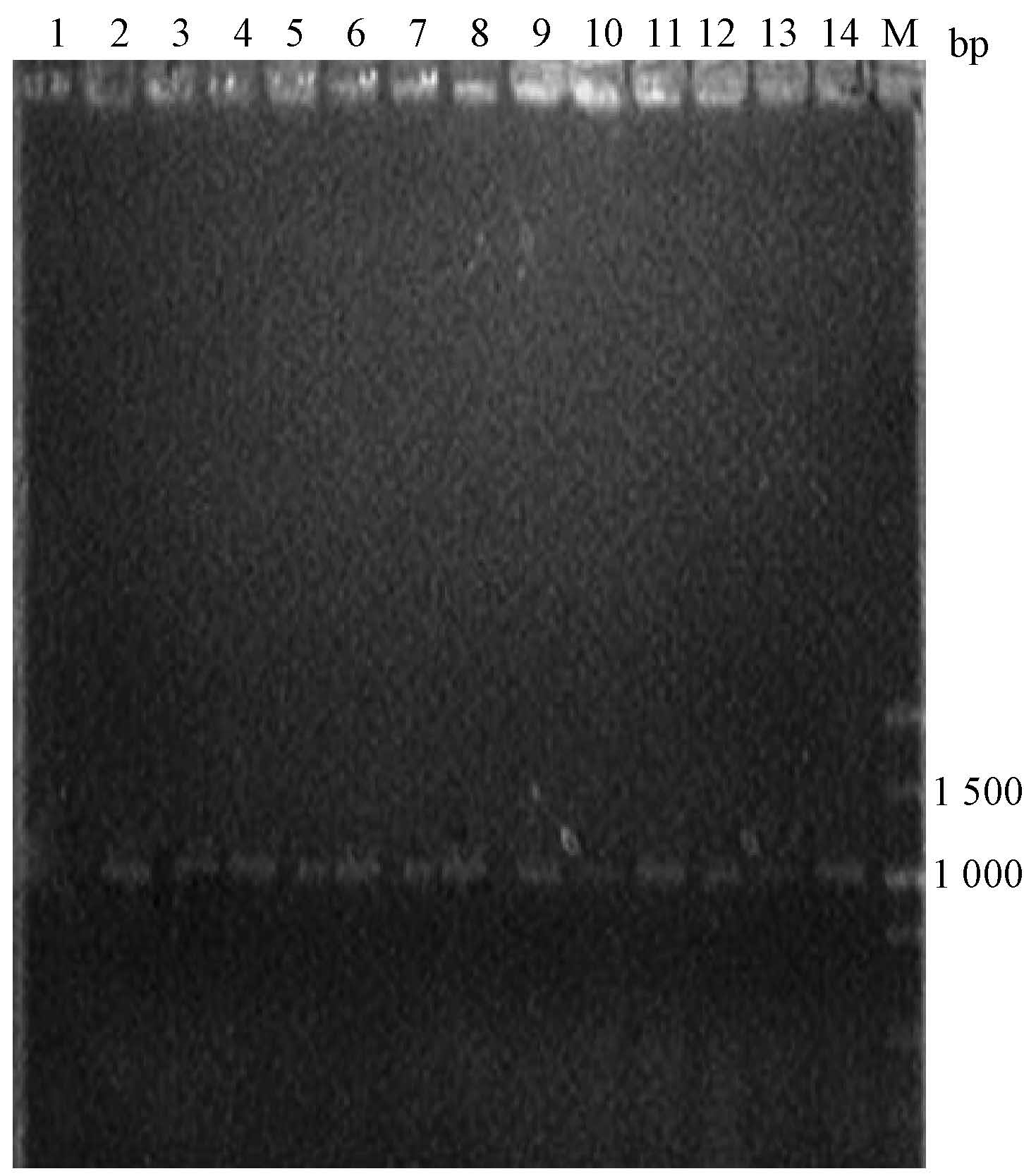
|
注:1. pHBM905A空质粒为模板 (阴性);2.重组质粒pHBM-6× His-pprI为模板 (阳性);3~14.1~12号毕赤酵母转化子为模板 图 4 s="paragraph_title outline_anchor" level="1">4 Figure 4 PCR identification of Pichia pastoris transformants |
4. 目的蛋白在毕赤酵母中的表达:随机挑取7个阳性pHBM-6×His-pprI毕赤酵母转化子单菌落,同时以空载体质粒pHBM905A的毕赤酵母转化菌株作为阴性对照,在同样条件下摇瓶培养。培养上清液进行SDS-PAGE电泳检测目的蛋白的分泌表达情况。结果显示,与阴性对照菌株相比,7 个阳性毕赤酵母转化子的培养上清液中均可见到在相对分子量为43 000的位置附近有特异性的表达蛋白质条带 (图 5)。表明耐辐射奇球菌的PprI蛋白在毕赤酵母中得到了分泌表达。
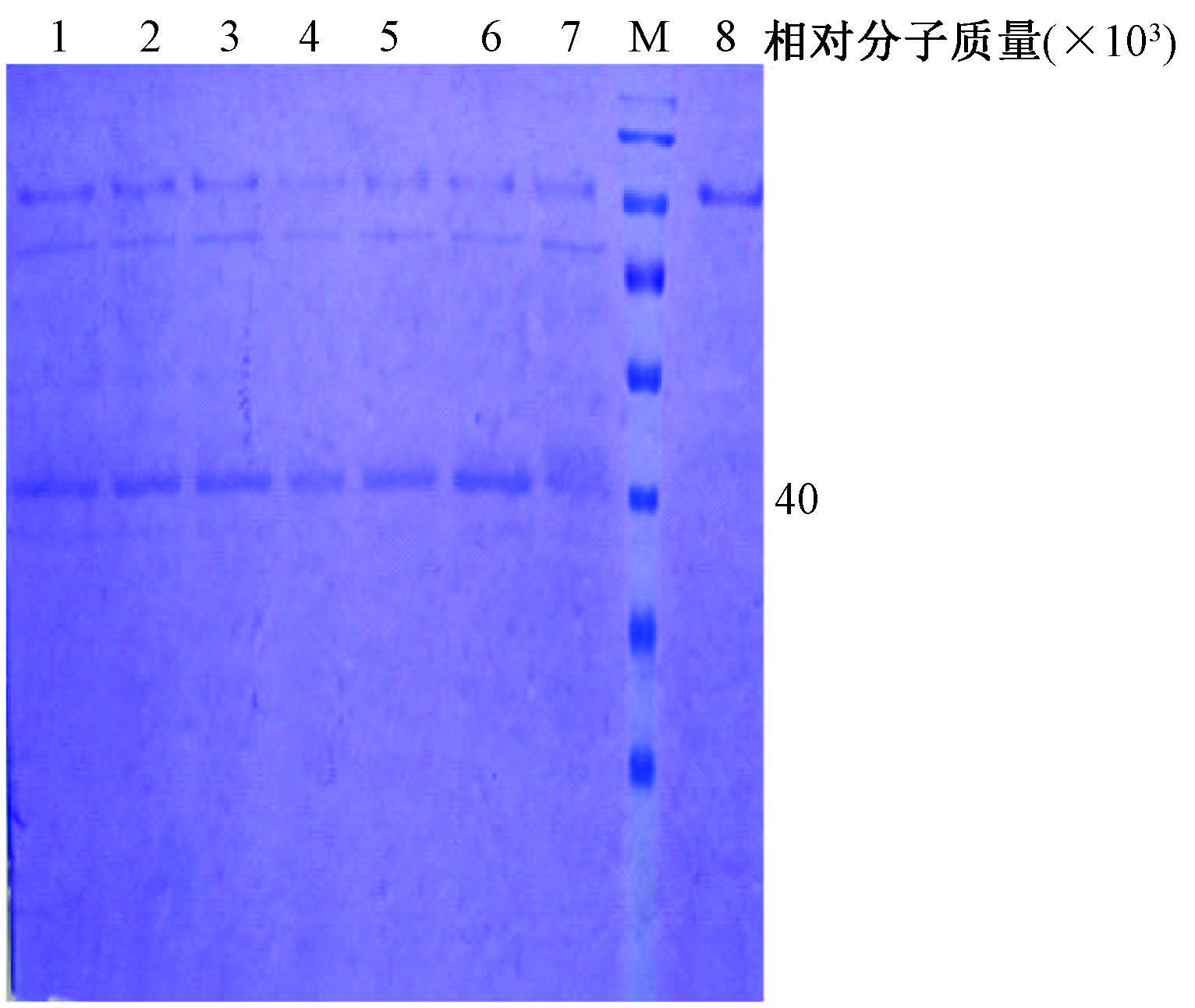
|
注:1-7. pHBM905A-6×His-pprI的毕赤酵母GS115菌株转化子; 8. 空载体pHBM905A转化毕赤酵母GS115菌株;M. 蛋白分子量 标准;每泳道的培养上清液上样量均为15 μl 图 5 甲醇诱导3 d后毕赤酵母转化子培养上清液的SDS-PAGE检测 Figure 5 SDS-PAGE detection of the supernatant of Pichia pastoris transformant at 3 d after methanol induction |
5. 表达产物的Western Blot检测:为了判断毕赤酵母转化子培养上清液中的特异性表达蛋白是否确实为6×His-PprI融合蛋白,随机选取其中2个阳性酵母转化子的甲醇诱导培养上清液进行Western blot检测。结果显示,抗6×His的标签抗体能与这2个阳性酵母转化子培养上清液中43 000位置附近的蛋白条带发生特异性结合反应,而且反应强度随甲醇诱导时间的增加而相应增强 (图 6)。表明毕赤酵母转化子培养上清液中的特异性蛋白确实为6×His-PprI融合蛋白。

|
注:1.1号酵母转化子诱导2 d的发酵上清; 2.2号酵母转化子诱导2 d的发酵上清; 3.1号酵母转化子诱导1 d的发酵上清;M. 蛋白分子标志物 图 6 毕赤酵母转化子表达产物的Western blot检测 Figure 6 Western blot detection of the expression product of Pichia pastoris transformants |
6. 表达产物的肽质量指纹图谱鉴定:为了进一步验证毕赤酵母转化子表达上清液中的蛋白是否为耐辐射奇球菌的PprI蛋白,割取了SDS-PAGE电泳胶上分离的目的蛋白条带,用Ultraflex Ⅱ TOF/TOF 质谱仪进行了肽质量指纹图谱 (peptide mass fingerprinting,PMF)的检测,并将检测结果输入美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)的OMOSSA数据库进行分析。结果显示,该蛋白序列确实是来源于耐辐射奇球菌(Deinococcus radiodurans)的DR_0167号蛋白。表明PprI蛋白在毕赤酵母中成功获得分泌表达。
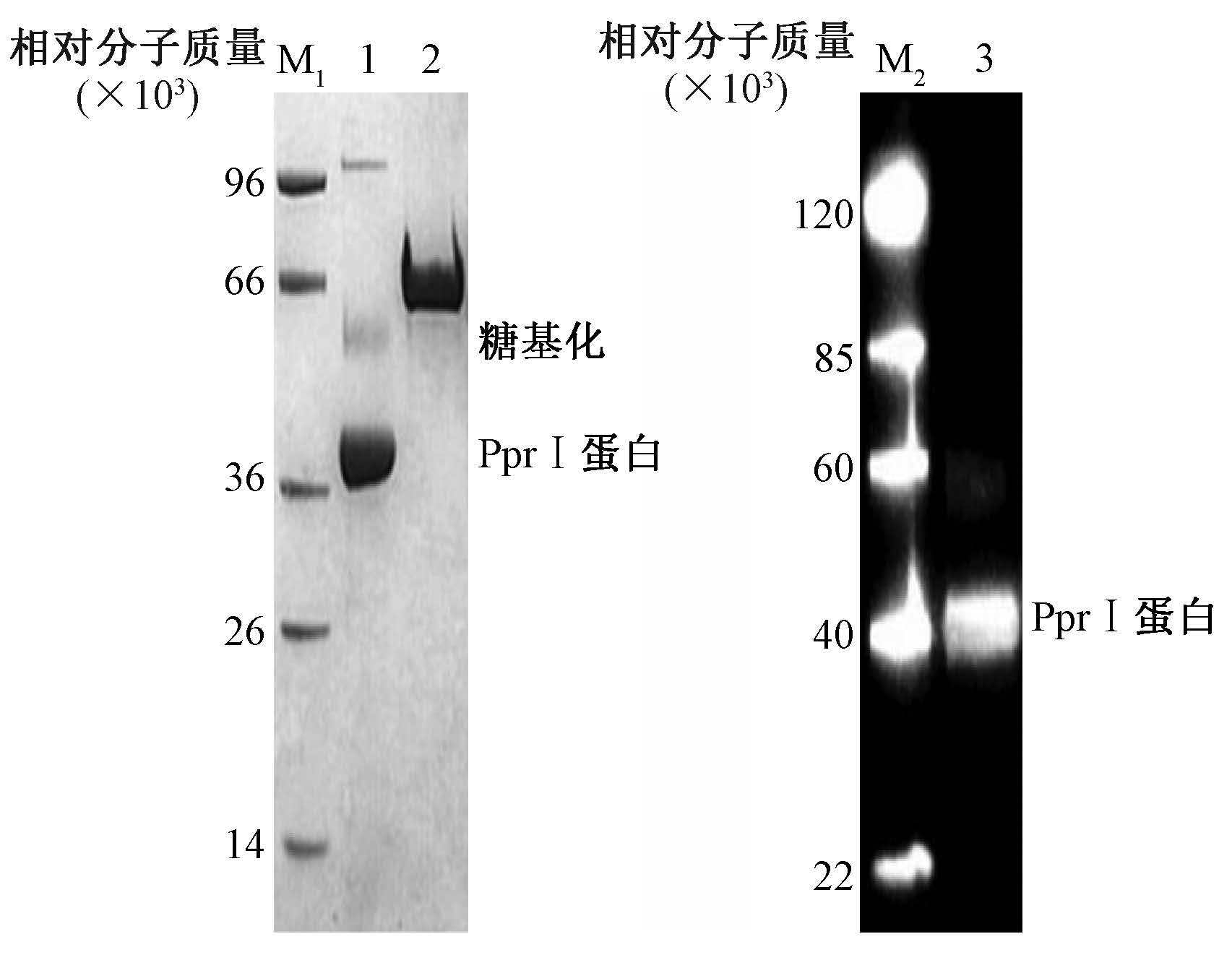
7. 目的蛋白的纯化:收集诱导表达6 d后的培养上清液,透析,然后过Ni-NTA柱,用不同浓度咪唑洗脱收集目的蛋白。结果显示,PprI蛋白的洗脱效果与咪唑浓度密切相关,当咪唑浓度为250 mmol/L时,PprI蛋白的洗脱率最高(图 7)。SDS-PAGE及Western blot鉴定纯化效果(图 8)。BCA法测得PprI蛋白浓度为0.35 mg/ml。

|
注:1.透析后的培养基上清;2.流出液;3.50 mmol/L Tris, 300 mmol/L NaCl,20 mmol/L Imidazole,pH 8.0洗脱组分; 4-5.50 mmol/L Tris,300 mmol/L NaCl,250 mmol/L Imidazole, pH 8.0洗脱组分;M. 蛋白分子标志物 图 7 PprI蛋白过金属镍螯合的Ni-NTA柱的纯化结果 Figure 7 Purification profile of PprI protein by metal nickel chelate Ni-NTA column |
|
注:1.5 μg PprI蛋白;2.5 μg BSA(对照);3.5 μg PprI蛋白; M1和M2. 蛋白分子标志物 图 8 洗脱组分SDS-PAGE(A)和Western blot(B)的分析 Figure 8 SDS-PAGE (A) and Western blot (B) analysis of elution fractions |
讨 论
耐辐射奇球菌受大剂量γ射线照射后,其染色体基因组会产生约150~200个DNA双链断裂(DSBs),3 000个DNA单链断裂(SSBs),至少1 000个DNA碱基损伤,而该菌可在数小时内完全修复这些DNA损伤[12-14]。研究发现,耐辐射奇球菌的辐射损伤修复能力与PprI蛋白的DNA结合功能有关[15]。为了深入研究PprI蛋白的结构与功能及其在哺乳动物中抗辐射效应的分子机制,需要获得足够量的真核系统表达纯化的PprI蛋白。
采用基因工程技术表达pprI基因是大量获得其蛋白的一种有效方法。相比于大肠杆菌表达系统,巴斯德毕赤酵母表达系统具有很多优势,如真核细胞的翻译后修饰,使外源蛋白更易保持天然的生物学活性;蛋白分泌表达可简化纯化工艺;具有高遗传稳定性和可调控性,适合高密度发酵。因此,本研究采用真核毕赤酵母系统表达原核的耐辐射奇球菌的pprI基因。
由于耐辐射奇球菌是原核生物,而毕赤酵母属于真核生物,二者基因编码序列的密码子偏爱性方面存在显著的差异。因此,本研究根据毕赤酵母密码子的偏爱性,在保持其PprI蛋白质氨基酸序列不变的前提下,采用全基因合成技术对pprI基因的密码子进行了优化改造。实验结果表明,经过改造的新合成的pprI基因在毕赤酵母中成功地高效表达和分泌了目的蛋白质。
根据对耐辐射奇球菌PprI蛋白的氨基酸序列分析,其预测相对分子质量约为35 000。本课题组曾在大肠杆菌中转染pprI基因的表达产物的表观分子量约为37 000[11]。本实验应用毕赤酵母表达的PprI蛋白表观分子量约为43 000,表明在毕赤酵母表达系统中PprI蛋白获得了翻译后修饰。有关翻译后修饰以及其对抗辐射活性的影响,有待于进一步深入的研究。
本研究的意义在于,建立了高效分泌表达耐辐射奇球菌PprI蛋白的重组毕赤酵母菌株,由于目的蛋白属于分泌表达并且带有6×His标签,因此有利于表达蛋白的纯化工艺,选用Ni-NTA柱获得了大量纯化的PprI蛋白。PprI蛋白在真核系统的表达和纯化,为其在哺乳动物中抗辐射效应及分子机制的研究创造了必要的条件,具有重要的科学意义和产业化应用前景。
利益冲突 本人与本人家属、其他研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 任丽丽设计研究方案,进行实验并起草论文;吴伟协助设计研究方案;施怡和岳凌协助进行实验;杨占山指导实验进行并修改论文
| [1] | Battista JR, Earl AM, Park MJ. Why is Deinococcus radiodurans so resistant to ionizing radiation?[J]. Trends Microbiol, 1999, 7 (9) :362–365 . doi:10.1016/S0966-842X(99)01566-8 |
| [2] | Minton KW. DNA repair in the extremely radioresistant bacterium Deinnococcus radiodurans[J]. Mol Microbiol, 1994, 13 (1) :9–15 . doi:10.1111/j.1365-2958.1994.tb00397.x |
| [3] | Cox MM, Battista JR. Deinococcus radiodurans-the consummate survivor[J]. Nat Rev Microbiol, 2005, 3 (11) :882–892 . doi:10.1038/nrmicro1264 |
| [4] | Blasius M, Sommer S, Hübscher U. Deinococcus radiodurans: what belongs to the survival kit?[J]. Crit Rev Biochem Mol Biol, 2008, 43 (3) :221–238 . doi:10.1080/10409230802122274 |
| [5] | Lange CC, Wackett LP, Minton KW, et al. Engineering a recombinant Deinococcus radiodurans for organopollutant degradation in radioactive mixed waste environments[J]. Nat Biotechnol, 1998, 16 (10) :929–933 . doi:10.1038/nbt1098-929 |
| [6] | Hua YJ, Narumi I, Gao GJ, et al. PprI: a general switch responsible for extreme radioresistance of Deinococcus radiodurans[J]. Biochem Biophys Res Commun, 2003, 306 (2) :354–360 . doi:10.1016/S0006-291X(03)00965-3 |
| [7] | Ohba H, Satoh K, Yanagisawa T, et al. The radiation responsive promoter of the Deinococcus radiodurans pprA gene[J]. Gene, 2005, 363 (2) :133–141 . doi:10.1016/j.gene.2005.07.035 |
| [8] | 陈婷婷, 连利霞, 牟英, 等. 抗辐射球菌pprI基因活体电转染救治小鼠γ射线损伤的实验研究[J]. 辐射研究与辐射工艺学报, 2010,28 (3) :166–171. Chen TT, Lian LX, Mu Y, et al. Research on pprI gene of Deinococcus radiodurans transfered by electroporation in vivo for remedy of the γ-rays radiation injury with mice[J]. J Radiat Res Radiat Proc, 2010, 28 (3) :166–171 . |
| [9] | 文玲, 施怡, 任丽丽, 等. 耐辐射球菌pprI基因真核表达载体的构建及其抗辐射作用[J]. 中华放射医学与防护杂志, 2014,34 (8) :563–568. doi:10.3760/cma.j.issn.0254-5098.2014.08.002 Wen L, Shi Y, Ren LL, et al. Construction of eukaryotic expression vector carrying pprI gene of Deinococcus radiodurans and its radioresistant effect[J]. Chin J Radiol Med Prot, 2014, 34 (8) :563–568 . doi:10.3760/cma.j.issn.0254-5098.2014.08.002 |
| [10] | 施怡, 文玲, 任丽丽, 等. 原核pprI基因活体转染对BALB/c小鼠急性放射损伤防治作用的研究[J]. 中华放射医学与防护杂志, 2015,35 (7) :485–490. doi:10.3760/cma.j.issn.0254-5098.2015.07.002. Shi Y, Wen L, Ren LL, et al. Role of prokaryotic pprI gene in protecting BALB/c mice from acute radiation injury[J]. Chin J Radiol Med Prot, 2015, 35 (7) :485–490 . doi:10.3760/cma.j.issn.0254-5098.2015.07.002. |
| [11] | 张永芹, 周辉, 陈洁, 等. 耐辐射奇球菌PprI蛋白质的表达及其纯化的实验研究[J]. 辐射研究与辐射工艺学报, 2011,29 (2) :117–122. Zhang YQ, Zhou H, Chen J, et al. Research on expression and purification of Deinococcus radiodurans PprI protein[J]. J Radiat Res Radiat Proc, 2011, 29 (2) :117–122 . |
| [12] | White O, Eisen JA, Heidelberg JF, et al. Genome sequence of the radio-resistant bacterium Deinococcus radiodurans R1[J]. Science, 1999, 286 (5444) :1571–1577 . doi:10.1126/science.286.5444.1571 |
| [13] | Levin-Zaidman S, Englander J, Shimoni E, et al. Ringlike structure of the Deinococcus radiodurans genome: a key to radioresistance?[J]. Science, 2003, 299 (5604) :254–256 . doi:10.1126/science.1077865 |
| [14] | Minton KW. DNA repair in the extremely radioresistant bacrerium Deinococcus radiodurans[J]. Mol Microbiol, 1994, 13 (1) :9–15 . doi:10.1111/j.1365-2958.1994.tb00397.x. |
| [15] | Lu H, Chen H, Xu G, et al. DNA binding is essential for PprI function in response to radiation damage in Deinococcus radiodurans[J]. DNA Repair (Amst), 2012, 11 (2) :139–145 . doi:10.1016/j.dnarep.2011.10.013. |
 2016, Vol. 38
2016, Vol. 38


