2. 100850 北京, 军事医学科学院放射与辐射医学研究所 放射生物学北京市重点实验室
2. Institute of Radiation Medicine, the Military Medical Sciences, Beijing Key Laboratory for Radiobiology, Beijing 100850, China
癌干细胞(cancer stem cell,CSC),又称癌干细胞样细胞,具有干细胞性质的癌细胞,具有很强的自我复制和多细胞分化潜能等能力[1]。常见的癌干细胞表面标志物有:CD133、CD44、CD24、CD90、CD166等[2],CD133和CD44普遍被认为是结肠癌干细胞标志物,本实验室的检测结果显示,p53野生型的HCT116细胞群中CD133和CD44双阳性细胞比例很高。鉴于癌干细胞的耐辐射和抗化疗的能力[3, 4],发展杀死癌干细胞的有效措施被认为是癌症治疗的新策略。
DNA依赖蛋白激酶催化亚基(DNA-dependent protein-kinase catalytic subunit,DNA-PKcs)是放射所致DNA双链断裂损伤的非同源末端连接(non-homologous end-joining,NHEJ)修复通路中关键分子[5]。DNA-PKcs一方面通过维持基因组稳定性,显示防止细胞癌变的抑癌基因功能,另一方面因其具有DNA双链断裂修复功能,而且在很多肿瘤细胞中DNA-PKcs表现为高表达,由此导致肿瘤细胞的耐辐射和耐化疗能力增加。研究报道,包括NU7026在内的DNA-PKcs抑制剂或shRNA靶向抑制DNA-PKcs表达,能显著提高癌细胞的放射敏感性[6, 7, 8],显示其癌症治疗放射增敏的应用价值。鉴于癌干细胞的耐辐射能力,与肿瘤治疗疗效不佳有密切联系,本研究选择DNA-PKcs激酶活性特异抑制NU7026,探究抑制DNA-PKcs活性对含有高比例癌干细胞亚群的结肠癌细胞HCT116的放射增敏作用。
1. 试剂及药物配制:DNA-PKcs激酶抑制剂NU7026(美国Sigma公司),二甲基亚砜(DMSO,美国Sigma公司)进口分装,Annexin V细胞凋亡试剂盒(日本DoJinDO公司),0.25%的胰酶(美国Sigma公司),缓冲液由本实验室配置(PBS,pH 7.2,含0.5%BSA,2 mmol/L EDTA)。荧光标记抗体:CD133/2(293C3)-FITC(德国Miltenyl Biotec公司),CD44-PE(德国Miltenyl Biotec公司);培养基(美国Hyclone公司);胎牛血清(美国Hyclone公司);γ-H2AX(ser139,德国Merck Millipore公司);FITC标记二抗羊抗鼠IgG(北京中杉金桥公司);DAPI(日本合光纯药株式会社)。采用DMSO溶解NU7026,规格为5 mg的NU7026中加入2 ml的DMSO,充分溶解后,再用McCoy′s 5A培养基稀释至所需浓度,DMSO终浓度低于<0.2%,对照组加入等体积的DMSO。
2. 细胞培养:用McCoy′s 5A培养基培养p53阳性的人结肠癌细胞系HCT116细胞由本实验室保存,培养基中添加10%胎牛血清,100 μg/ml青霉素以及80 μg/ml链霉素,在37℃,5%CO2环境下孵育培养。用0.25%胰蛋白酶消化分离,进行传代。
3. 细胞照射:采用军事医学科学院辐射中心60Co γ辐射源,吸收剂量率为133.25 cGy/min,室温照射,源靶距为3 m。
4. 细胞集落形成实验:取对数期细胞用于实验,接种于60 mm直径培养皿中。分为对照组(500个细胞)、单纯药物组(20 μmol/L NU7026,1 000个细胞)、单纯照射组(2 Gy,1 000个细胞)和药物+照射组(2 Gy+20 μmol/L NU7026,1 000个细胞),每个点重复3个培养皿。5 ml培养液/皿,在37℃、5% CO2的培养箱中培养10~14 d。计算每组细胞集落形成率和细胞存活率,细胞集落形成率(%)=>50个细胞的克隆数/预先接种的细胞数×100%,细胞存活率(%)=实验组集落形成率/对照组集落形成率×100%。
5. 癌干细胞标志物检测:各处理组细胞经蛋白胰酶消化后,用冷却的PBS清洗,收集上清,用配制的缓冲液重悬细胞,再加入10 μl的荧光抗体CD133,避光4℃孵育10 min后,加入1~2 ml缓冲液1 200 r/min离心10 min,离心半径7 cm,去上清,加入200 μl的缓冲液重悬细胞,使其成为单个细胞,上流式细胞仪检测(或者加入200 μl的1%多聚甲醛重悬4℃保存,以待上流式细胞仪检测)。
6. 细胞周期检测:照射后24 h收集细胞,弃原液,用PBS洗3遍,用预先保存在-20℃的70%乙醇,4℃过夜固定,第2天取出,4℃1 500 r/min离心8 min,离心半径7 cm,用PBS离心洗两遍后,弃上清,加入100 μl PBS重悬细胞,加入RNase 2.5 μg至终浓度为50 μg/ml,37℃孵育30 min后,再加入200 μl PI混合均匀,上机检测。
7. 细胞凋亡检测:检测细胞照射后48 h的凋亡情况。收集细胞,用PBS洗2遍,再用0.25%不含EDTA的胰蛋白酶消化细胞,取细胞悬液转移至离心管中,4 ℃ 5 000 r/min离心3 min,离心半径7 cm,弃上清,加入1 ml PBS离心3 min弃上清,加入100 μl 1×Annexin V结合缓冲液重悬细胞,加入5 μl Annexing V FITC结合物,再加入5 μl PI溶液。室温避光培养15 min,加入400 μl 1×Annexin V结合缓冲液,流式细胞仪检测。
8. 免疫荧光激光共聚焦检测γ-H2AX焦点(foci):照射前1 d,每孔接种1×106细胞,同时平行两组培养板细胞,一组只照射,另一组加药同时照射,2 Gy照射前2 h加入终浓度为20 μmol/L的NU7026,分别在照射后0、0.5、2、4、8、24 h时取出一片盖玻片,用4%的多聚甲醛固定细胞放入4℃保存,用预冷的PBS洗3次,用3%BSA室温孵育1 h后,0.25%Tritoon 100 破膜15 min后,取20 μl按1%BSA∶γ-H2AX为1∶200比例的鼠抗体γ-H2AX,4℃过夜后,用1%BSA洗3次;用1∶500稀释的FITC标记二抗羊抗鼠IgG室温避光孵育1 h,用1%BSA洗3次;再用 PBS∶DAPI(原液)为1∶1 000的DAPI稀释液,染核15 min,用PBS洗3次每次10 min,最后用50%的甘油封片,放湿盒,4℃避光,最后上激光共聚焦免疫荧光仪器检测。数据处理,每组每个时间点计数50个细胞的总焦点,计算每个细胞平均焦点数代表DNA损伤情况。
9.统计学处理:计量资料采用x±s 表示,所有实验独立重复至少3次。采用SPSS 17.0软件进行统计学处理,对实验数据采用独立样本t检验。P<0.05为差异有统计学意义。
1. HCT116细胞癌干细胞标志物检测:本研究采用的细胞为p53野生型的HCT116细胞系,通过流式细胞仪检测CD133+/CD44+亚群细胞比例,结果显示,CD133+/CD44+双阳性细胞亚群的比例高达(88.14±0.47)%,为癌干细胞亚群优势细胞系。在体外无血清培养基中培养,集落形成率达到(84.75±1.35)%,显示HCT116细胞具有很强的集落形成能力。
2. NU7026对HCT116细胞受照射后增殖的影响:前期实验显示,NU7026在20 μmol/L浓度下对DNA-PKcs激酶活性具有抑制作用[9],本研究以此为药物作用浓度。NU7026和照射处理HCT116细胞的集落形成率和存活率结果列于表 1。单纯药物和单纯照射对HCT116细胞的增殖均具有抑制作用。药物+照射联合组的集落形成率和细胞存活率比单纯照射组下降更明显,差异有统计学意义(t=7.21、7.22,P<0.01)。
| 表1 NU7026和照射处理HCT116细胞的集落形成率和存活率 Table 1 The colony-formation rate and survival of HCT116 cells treated with or without NU7026 before 2 Gy irradiation |
3. NU7026对HCT116细胞受照射后CD133阳性细胞亚群分布的影响:如表 2所示,HCT116细胞受2 Gy照射后,干细胞表面标志物CD133阳性细胞亚群的比例逐渐上升,显示HCT116癌干细胞的放射抗性。联合20 μmol/L NU7026处理,显著抑制了单独照射导致癌干细胞亚群的增加,从CD133阳性细胞亚群比例的下降表明NU7026增强了放射对癌干细胞的杀伤效应。
| 表2 NU7026和2 Gy照射处理后不同时间对HCT116细胞CD133+癌干细胞亚群分布 Table 2 The effects of NU7026 and/or 2 Gy irradiation on the distribution of CD133+ positive sub-population of HCT 116 cells |
4. NU7026对照射诱发HCT116细胞G2/M期阻滞的影响:HCT116细胞各处理组在照射后24 h的细胞周期分布的流式细胞分析如图 1所示。检测发现照射后24 h G2/M期细胞比例仍然高于未经处理的对照组,而此时,药物+照射组的G2/M阻滞率(39.62%±3.18%)显著高于单纯照射组(25.00%±0.89%)(t=7.67,P<0.01)。
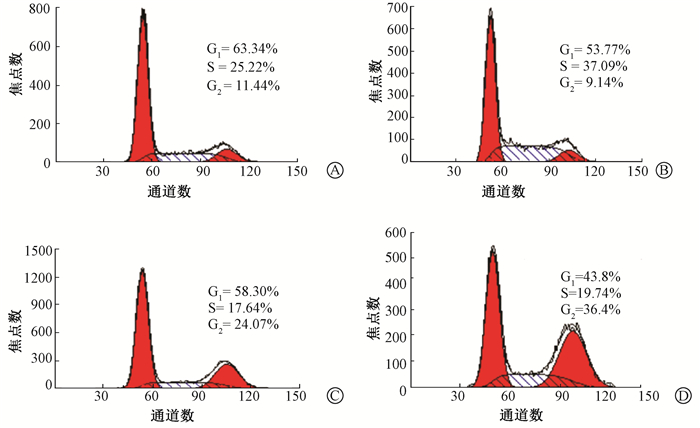
|
图1 HCT116细胞各处理组在照射后24 h的细胞周期分布的流式细胞分析 A.对照组;B.单纯药物组;C.单纯照射组;D.药物+照射组 Figure 1 Cell cycle distribution of the HCT116 cells after different treatments, and it was detected by flow cytometry analysis at 24 h after irradiation A. Control; B. NU7026 alone; C. 2 Gy alone; D. NU7026+2 Gy |
5. NU7026对照射诱发HCT116细胞凋亡的影响:HCT116各处理组细胞在2 Gy照射后48 h细胞凋亡的流式细胞分析结果如图 2所示。NU7026+2 Gy照射组细胞在照后48 h早期凋亡率为(40.10%±4.88%),明显高于单独2 Gy照射组(15.92%±1.48%)(t=8.24,P<0.01)。
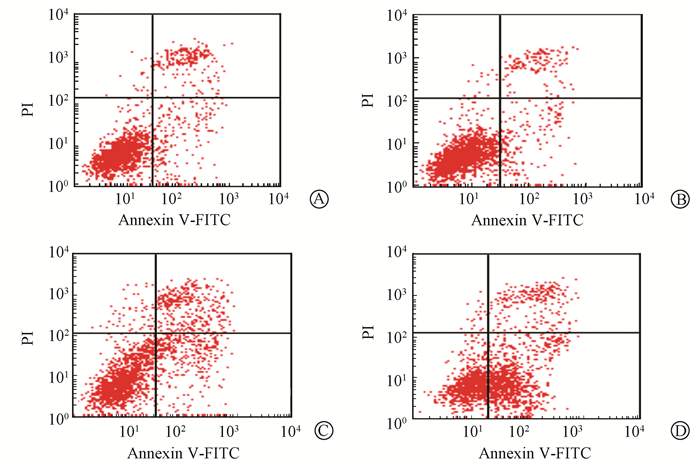
|
图2 HCT116各处理组细胞在2 Gy照射后48 h细胞凋亡的流式细胞分析 A.对照组;B.单纯药物组;C.单纯照射组;D.药物+照射组 Figure 2 Apoptosis induction in HCT116 cells,detected by flow cytometry analysis at 48 h after different treatments A. Control;B. NU7026 alone; C. 2 Gy alone; D. NU7026 and 2 Gy |
6.NU7026对射线诱发HCT116细胞DNA双链断裂修复的影响:通过标志物γ-H2AX foci分析DNA双链断裂损伤修复情况。细胞受到辐射后0.5~24 h各时间点,药物+照射组细胞γ-H2AX foci数均显著高于单纯照射组(图 3,4),NU7026表现出明显抑制DNA双链断裂修复的作用。
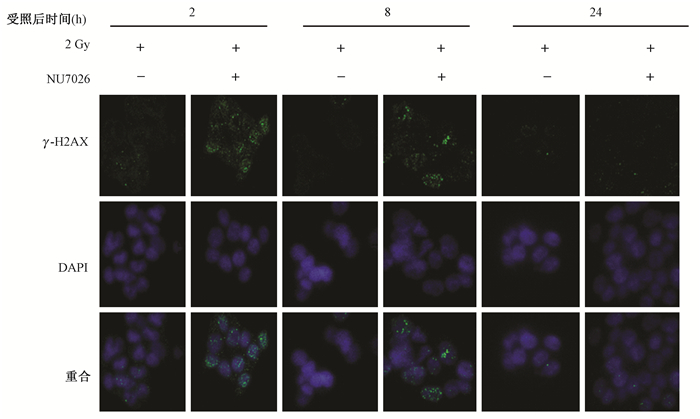
|
图3 2 Gy与2 Gy+NU7026两组细胞处理后2~24 h γ-H2AX焦点的免疫荧光检测图 Figure 3 The immunofluorescent staining images of γ-H2AX foci in the cells at 2-24 h after the treatments with 2 Gy alone or combined with 20 μmol/L NU7026 |
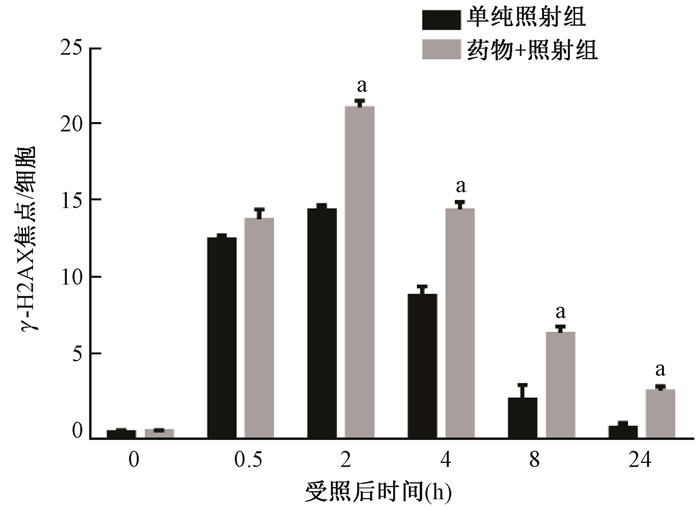
|
图4 2 Gy与2 Gy+NU7026两处理组细胞在γ射线照射后0.5~24 h的免疫荧光检γ-H2AX焦点数 注:a与同一时间单纯照射组比较,t=19.58、11.95、7.01、9.45,P<0.01 Figure 4 The kinetics of γ-H2AX foci formation in the HCT116 cells treated with 2 Gy alone or combined with 20 μmol/L NU7026 from 0.5h to 24 h after irradiation |
本实验结果显示,HCT116细胞系中有高达88.14%的CD133/CD44双阳性细胞亚群,提示是一个癌干细胞处于优势细胞亚群的细胞系。DNA-PKcs是一个重要的DNA双链断裂修复蛋白,近年来,对其DNA修复功能以外的生物学作用,如细胞周期调控作用,受到关注,但都与细胞DNA损伤反应有关[10, 11]。研究结果表明,在DNA-PKcs抑制剂NU7026的作用下,进一步降低了2 Gy照射HCT116细胞的存活率,显示出显著的放射增敏作用。更重要的是,HCT1160细胞单独2 Gy照射后,癌干细胞表面标志物CD133阳性细胞亚群所占比例增加,表明癌干细胞具有较高的放射抗性。DNA-PKcs抑制剂NU7026能显著抑制受照细胞的癌干细胞亚群的增加,显示出辐射对癌干细胞杀伤效应的增敏作用。
以往的研究表明,2 Gy中等剂量照射细胞发生G2/M阻滞的高峰期是在受照后8~12 h,此后开始逐渐恢复。如果G2/M阻滞后续响应机制异常,在照射后24 h仍然有较高的阻滞[10, 11, 12]。在本研究中,HCT116细胞在2 Gy照射后24 h,药物+照射组的G2/M期阻滞率显著高于单纯照射组,表明抑制DNA-PKcs导致放射诱发细胞G2/M阻滞的恢复延迟或成为不可逆阻滞。前期研究表明,一旦G2/M阻滞延长而转变为不可逆阻滞时,细胞就有可能是发生有丝分裂灾变死亡[10],这可能是NU7026放射增敏的机制之一。已知细胞要完成细胞质分裂,从有丝分裂期退出,其条件之一是Cyclin B1蛋白的降解。本课题组研究发现,DNA-PKcs缺陷导致Cyclin B1蛋白的泛素化蛋白酶体降解通路机制异常,从而导致Cyclin B1蛋白的堆积,细胞无法完成有丝分裂[13],由此可以解释本研究观察到的上述结果。此外,细胞凋亡检测结果,药物+照射组与单纯照射组在照射后24和72 h两个时间点的差异不明显,但在48 h,药物+照射联合处理组细胞的早期凋亡率,要显著高于单纯照射组,显然,NU7026增加了受照细胞的凋亡发生率。γ-H2AX foci免疫荧光结果显示,NU7026显著抑制细胞对放射诱发DNA双链断裂的修复能力,这与预想的结果一致。
本研究揭示,DNA-PKcs抑制剂NU7026对结肠癌细胞HCT116具有显著的放射增敏作用,特别是增加放射对癌干细胞的杀伤效应。NU7026除抑制细胞DNA修复功能外,还包括延迟细胞G2/M期阻滞,乃至引发有丝分裂灾变、促进细胞凋亡发生。这种多途径放射增敏作用,非常有利于癌干细胞辐射抗性问题的解决,将为临床治疗癌症的放疗增敏剂的应用研究提供理论依据。
利益冲突 本研究除受到国家自然科学基金大科学装置联合基金资助外,未受其他项目赞助。本文研究者及家属,未因进行该研究而接受任何不正当的职务或经费利益,在此对研究的独立性和科学性予以保证 作者贡献声明 陈霞执行项目的研究,撰写论文,修改论文;刘晓丹、王豫执行部分研究;周平坤设计研究方案,分析讨论研究结果| [1] | Safari M, Khoshnevisan A. An overview of the role of cancer stem cells in spine tumors with a special focus on chordoma[J]. World J Stem Cells, 2014, 6(1):53-64. DOI:10.4252/wjsc.v6.i1.53. |
| [2] | Dembinski JL, Krauss S. A distinct slow-cycling cancer stem-like subpopulation of pancreatic adenocarcinoma cells is maintained in vivo[J]. Cancers (Basel), 2010, 2(4):2011-2025. DOI:10.3390/cancers2042011. |
| [3] | Hu Y, Fu L. Targeting cancer stem cells:a new therapy to cure cancer patients[J]. Am J Cancer Res, 2012, 2(3):340-356. |
| [4] | Sahlberg SH, Spiegelberg D, Glimelius B, et al. Evaluation of cancer stem cell markers CD133, CD44, CD24:association with AKT isoforms and radiation resistance in colon cancer cells[J]. PLoS One, 2014, 9(4):e94621. DOI:10.1371/journal.pone.0094621. |
| [5] | 杨艳丽, 张士猛, 周平坤. DNA依赖型蛋白激酶催化亚单位在辐射诱导的DNA损伤应答中的作用[J].中华放射医学与防护杂志,2014,34(7):551-554. DOI:10.3760/cma.j.issn.0254-5098.2014.07.019. Yang YL, Zhang SM, Zhou PK. The effects of DNA dependent protein kinase catalytic subunit on the DNA damage responses induced by radiation[J].Chin J Radiol Med Prot,2014,34(7):551-554. DOI:10.3760/cma.j.issn.0254-5098.2014.07.019. |
| [6] | 黄波, 龙颖, 唐艳, 等. NU7026对肝癌细胞放射增敏作用及机制研究[J].辐射研究与辐射工艺学报,2013,31(6):9-13. Huang B, Long Y, Tang Y, et al. Study on radiosensitization effects and mechanisms of NU7026 on hepatocellular carcinoma cells[J].J Radiat Res Radiat Proc, 2013, 31(6):9-13. |
| [7] | Dolman ME, van der Ploeg I, Koster J, et al. DNA-dependent protein kinase as molecular target for radiosensitization of neuroblastoma cells[J]. PLoS One, 2015,10(12):e0145744. DOI:10.1371/journal.pone.0145744. |
| [8] | Fontana AO, Augsburger MA, Grosse N, et al. Differential DNA repair pathway choice in cancer cells after proton- and photon-irradiation[J]. Radiother Oncol, 2015,116(3):374-380. DOI:10.1016/j.radonc.2015.08.014. |
| [9] | Zou LH, Shang ZF, Tan W, et al. TNKS1BP1 functions in DNA double-strand break repair though facilitating DNA-PKcs autophosphorylation dependent on PARP-1[J]. Oncotarget, 2015, 6(9):7011-7022. DOI:10.18632/oncotarget.3137. |
| [10] | Shang ZF, Huang B, Xu QZ, et al. Inactivation of DNA-dependent protein kinase leads to spindle disruption and mitotic catastrophe with attenuated checkpoint protein 2 phosphorylation in response to DNA damage[J]. Cancer Res, 2010, 70(9):3657-3666. DOI:10.1158/0008-5472.CAN-09-3362. |
| [11] | Ma H, Bi J, Liu T, et al. Icotinib hydrochloride enhances the effect of radiotherapy by affecting DNA repair in colorectal cancer cells[J]. Oncol Rep, 2015,33(3):1161-1170. DOI:10.3892/or.2014.3699. |
| [12] | Lee KJ, Lin YF, Chou HY, et al. Involvement of DNA-dependent protein kinase in normal cell cycle progression through mitosis[J]. J Biol Chem, 2011, 286(14):12796-12802. DOI:10.1074/jbc.M110.212969. |
| [13] | Shang ZF, Tan W, Liu XD, et al. DNA-PKcs negatively regulates cyclin B1 protein stability through facilitating its ubiquitination mediated by Cdh1-APC/C pathway[J]. Int J Biol Sci, 2015, 11(9):1026-1035. DOI:10.7150/ijbs.12443. |
 2016, Vol. 36
2016, Vol. 36


