2. 215004 苏州, 苏州大学附属第二医院应急中心
2. Department of Nuclear Emergency Center, Second Affiliated Hospital of Soochow University, Suzhou 215004, China
2014年5月7日,南京发生了一起192Ir源丢失事故,受照人员“王”于照射后第5天被送往苏州大学附属第二医院进行临床诊治。在历时378 d的住院过程中,苏州大学附属第二医院临床营养科评估了患者的营养状况,为患者制定针对性的营养治疗方案,现报道如下。
1.临床资料:见本期刘玉龙等文。
2.营养治疗过程
(1)入院至清创术前(受照后第5~ 61天):患者“王”,男,58岁,受照后第5天收住本院。入院时身高160 cm,体重42.5 kg,体质量指数(BMI)16.6 kg/m2(消瘦)。淋巴细胞数(LY)偏低,其余血常规指标无异常。肝功能指标丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)正常。胆红素指标总胆红素(TBil)和直接胆红素(DBil)偏高。患者食欲正常,无恶心呕吐、腹胀腹泻,给予少渣高蛋白高维生素饮食。因不适应医院饮食,常有剩余饭菜,嘱其餐间口服营养补充(ONS)整蛋白肠内营养制剂。每餐进食前,将其碗筷高温消毒,防止发生肠道内感染。
(2)首次清创术至第1次植皮术前(受照后第62~170天):患者于受照后第62天行首次清创术,术前体重41 kg,食欲尚可,进食后无腹胀腹泻等胃肠道不良反应。术后第5天患者体重下降至40.5 kg,血红蛋白(Hb)、LY、血清前白蛋白(PA)、血清白蛋白(ALB)等相关营养指标下降明显,肝功能基本正常。按热能35 kcal·kg-1·d-1,蛋白质1.5 g·kg-1·d-1进行营养治疗。术后给予患者低渣高蛋白高维生素软食,并鼓励其进食。患者食欲差,进食量仅为供给量40%~50%,不足部分通过肠外营养(PN)给予,主要经外周静脉给予葡萄糖、脂肪乳剂、氨基酸、多种维生素等。受照后第168天体重下降至36 kg,BMI 14.1 kg/m2(严重消瘦)。当天给予放置鼻空肠管,调整营养治疗方案如下:肠内营养(EN)给予整蛋白肠内营养液500 ml和自制匀浆膳250 ml,肠外给予中长链脂肪乳250 ml和复合氨基酸溶液250 ml,同时ONS整蛋白肠内营养制剂 200 ml。全日总热能约1 650 kcal,蛋白质和氨基酸总量约68 g。输注泵控制肠内营养液输注速度70 ml/h。患者无腹胀腹泻等胃肠道不耐受反应。受照后第170天,患者全身营养状况差,体温基本正常,右下肢伤口较大,周围组织呈暗红色,质地较硬,伤口表面渗液较少。
(3)第1次皮瓣转移术至第2次皮瓣转移术前(受照后第171~262天):受照后第171天,患者行“右下肢清创术+背阔肌游离皮瓣转移修复术+背部取皮(右背部)植皮术+左大腿取皮术”。因感染等原因,移植皮瓣20%面积未成活,伤口分泌物培养多次见泛耐药鲍曼不动杆菌生长,予以负压封闭引流(VSD)持续负压吸引,并再次行伤口清创术。术后第1天患者ALB、PA、Hb、LY下降明显,食欲差,诉腹胀,考虑其腹胀与全麻时间长致肠动力减弱有关,也可能与EN有关。对此,调整肠内营养液输注速度为50 ml/h,给予口服多酶片和胃肠动力药,腹胀较前好转。受照后第222天患者因难以忍受鼻空肠管而予以拔除,当日行经外周静脉的中心静脉置管(PICC)。营养治疗主要采取“全合一”肠外营养治疗,同时口服补充肠内营养制剂,全日总热能约1 400 kcal,蛋白质和氨基酸总量约60 g。至受照后第251天,患者一般情况良好,食欲差,二便正常,ALB、PA、Hb、LY有所上升,植皮区愈合良好。
(4)第2次皮瓣移植术至出院(受照后第263~383天):受照后第263天,患者再次行皮瓣移植术。术后继续给予“全合一”肠外营养,同时进食少量半流质及整蛋白肠内营养制剂,全日总热能约1 500 kcal,蛋白质和氨基酸约63 g。受照后276 d,测量患者体重39 kg,BMI 15.2 kg/m2(消瘦);TBil、DBil、ALT、AST升高,提示患者出现淤胆及肝损。为此,受照后第286天给予患者重置鼻空肠管。调整营养治疗方案:EN加补充性肠外营养(SPN),以刺激肠蠕动,保持肠道功能,防止菌群失调;热能按30 kcal·kg-1·d-1供给;给予短肽型肠内营养液500 ml;输注速度25 ml/h;总液体量按50 ml·kg-1·d-1。考虑患者出现胸腔积液需限制液体入量,仅使用1 500 ml“全合一”肠外营养液中的550 ml,以符合此阶段热能、液体量等营养治疗需求。受照后第291天,肝功能和胆红素指标仍偏高,对此减少肠外营养中脂肪乳剂用量,加用ω-3鱼油脂肪乳,同时口服保肝和利胆药物,输注速度为30~40 ml/h,鼓励患者进食米汤等流质。
受照后第297天,患者精神明显好转,食欲可,肝损和淤胆减轻。全日可进食3次稀饭约300 kcal,口服整蛋白肠内营养制剂约180 kcal,肠内给予整蛋白肠内营养液750 kcal,输注速度50 ml/h。全日总热能约1 230 kcal,蛋白质约46 g。考虑患者经口饮食和EN热量已超过总热能需要量的60%,停止给予PN。
受照后第342天,患者创面愈合可,无明显感染迹象。食欲可,进食半流质和软食,饮食量包括主食3两,荤菜3两,水果4两,酸牛奶1杯,另加口服整蛋白肠内营养制剂,全日总能量约1 300 kcal,进食后无胃肠道不良反应,停止给予EN,但先保留鼻肠管。受照后第348天,与患者沟通拔除鼻肠管后严格按照营养医师制定的饮食方案进食,患者同意,遂当天拔除鼻空肠管。此后患者食欲尚可,进食依从性较好。
受照后第361天,患者伤口已基本痊愈,除PA偏低,血磷略偏高外,其他血生化和血常规各项指标均恢复正常。受照后第380天,患者体重增至41 kg,进软食,餐间补充整蛋白肠内营养制剂。经过378 d住院治疗,患者精神好、食欲可、无腹胀、二便如常、伤口痊愈、右下肢活动障碍。受照后第383天,准予患者出院,转至当地医院继续康复治疗。
(5)采用间接能量测定仪(代谢车)测定静息能量消耗值(REE):受照后第293、308和342天使用代谢车(型号CCM Express,美国Medgraphics公司生产)测定患者REE,据此确定患者当日热能需要量。
(6)营养相关指标观察:营养治疗中,进行相关营养指标观察,包括患者体重、BMI、Hb、LY、ALT、AST、TBil、DBil、ALB、PA等。
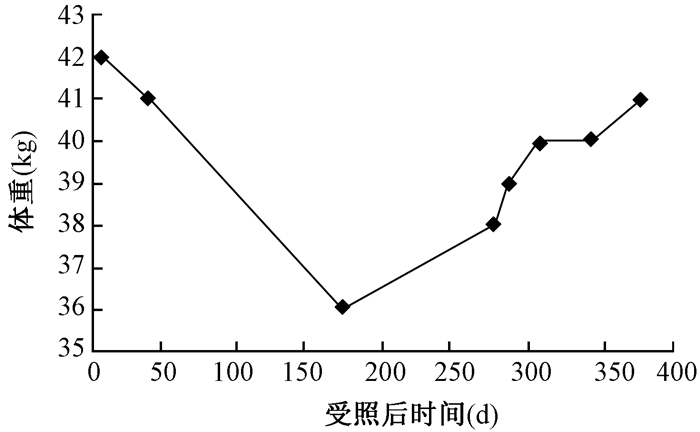
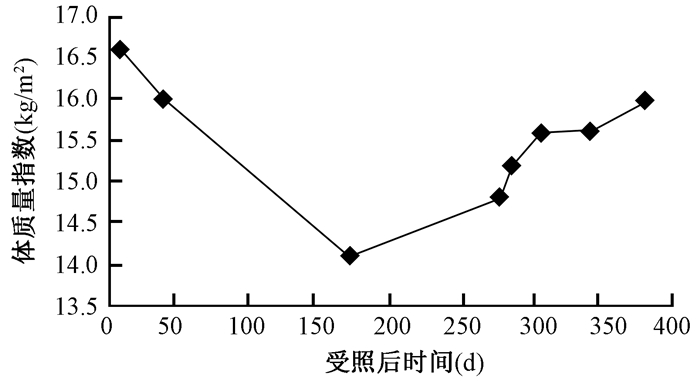
1.体格测量指标的改变:患者入院时体重42.5 kg,BMI 16.6 kg/m2,受照后第168天体重下降至最低为36 kg,BMI 14.1 kg/m2,出院时体重和BMI基本恢复。营养治疗过程中体重和体质量指数的变化见图 1,2。
|
图1 患者营养治疗中的体重变化 Figure 1 The body weight change of patient in nutritional therapy |
|
图2 患者营养治疗中的体质量指数变化 Figure 2 The changes of body mass index of patient in nutritional therapy |
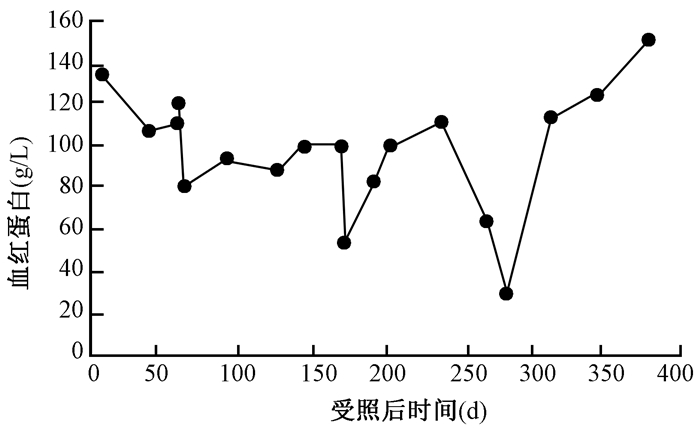
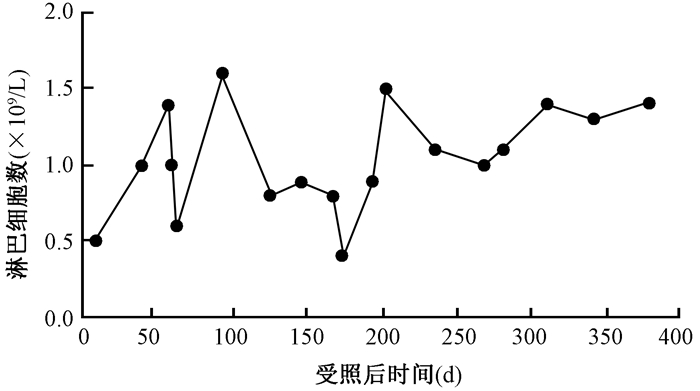
2.Hb和LY的变化:患者入院时Hb 135 g/L为正常,受照后第62天降至81 g/L,受照后第172和268天降至最低为54和64 g/L,出院时恢复正常。患者入院时LY为0.5×109/L,偏低;受照后第58天恢复正常,受照后第62和172天降至最低为0.6×109/L和0.4×109/L,受照后第202天恢复正常直至出院。患者营养治疗中Hb和LY的变化见图 3,4。
|
图3 患者营养治疗中的血红蛋白变化 Figure 3 Hemoglobin changes during nutritional therapy |
|
图4 患者营养治疗中的淋巴细胞数变化 Figure 4 Lymphocytes changes during nutritional therapy |
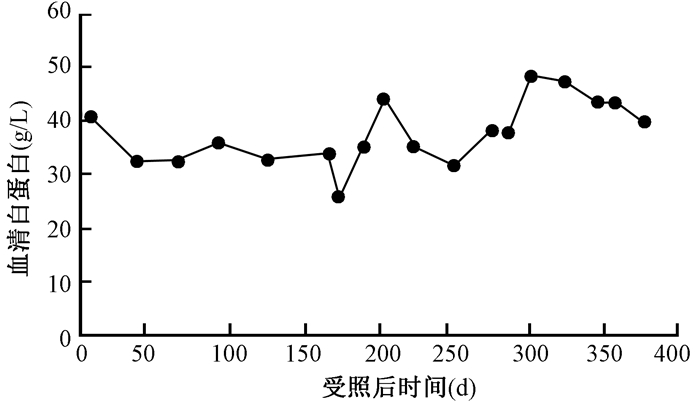
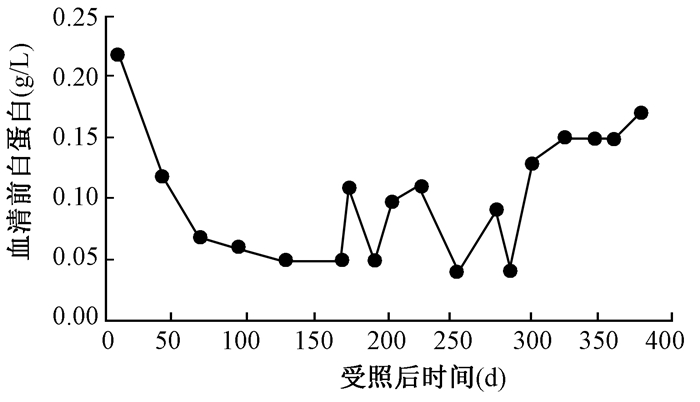
3.患者内脏蛋白的改变:患者入院时ALB正常,为41.2 g/L,受照后第172天降至最低,为25.3 g/L,出院时恢复正常。PA入院时正常,为0.22 g/L,受照后第248天降至最低为0.04 g/L,出院时基本恢复正常为0.17 g/L。患者营养治疗中ALB和PA的变化见图 5,6。
|
图5 患者营养治疗中的血清白蛋白变化 Figure 5 Serum albumin changes during nutritional therapy |
|
图6 患者营养治疗中的血清前白蛋白变化 Figure 6 Serum prealbumin changes during nutritional therapy |
4.血生化指标的变化:患者入院时AST、ALT正常,TBLL和DBIL略偏高,受照后第276天即行“全合一”肠外营养2.5个月后,AST、ALT、TBLL和DBIL逐渐升高,出院时均恢复正常。患者营养治疗中ALT、AST、TBLL、DBIL的变化见表 1。
| 表1 患者受照后不同时间营养治疗中的血生化指标变化 Table 1 Liver function of the patient during therapy |
5. REE的变化:患者于受照后第294、308和342天使用代谢车测定REE,分别为1032、989和976 kcal/d。
临床营养学发展至今,大量的研究结果已证实,合理的营养治疗对改善患者的临床结局具有重要作用,尤其对于危重患者营养治疗已成为临床救治的重要组成之一[1]。急性放射损伤及相关手术属严重应激,机体处于高分解代谢状态,易出现一系列代谢紊乱和能量及营养素的高消耗,患者极易出现蛋白质能量营养不良,导致体重下降、低蛋白血症、术后感染等并发症,从而影响疗效和预后。
适当的能量摄入对防止因过度或过低营养供给引起的相关并发症具有非常重要的作用。目前临床上大多数是凭经验来估算患者的能量需求。应用间接测热法(代谢车)测得的患者能量消耗值被认为是决定个体能量需要的金标准。
营养治疗早中期,主要依据体重和相关营养指标估算每日能量和蛋白质需要量。患者入院后体重逐渐下降,Hb、LY、ALB和PA不同程度下降,受照后第168天体重较入院时下降15.3%,这提示给予患者能量和蛋白质量明显不足。此阶段按30~35 kcal·kg-1·d-1计算能量需求,这与患者处于高消耗状态的实际需要量存在较大差异。治疗后期,总结前期经验教训,调整营养治疗方案,并多次使用代谢车测定患者REE,据此确定热能的摄入量,使患者体重和相关营养指标得到了有效改善。因此,在临床营养治疗中,当原有的能量供给无法达到预期目标时,应及时调整能量供给量,条件许可下,须应用代谢车测定患者的能量消耗值,以提供患者最优化的营养治疗方案。
EN的物质系经门静脉进入循环,可以保护消化道黏膜屏障,防止肠道菌群移位,避免肠源性感染,防止肝损和淤胆等并发症,从而改善患者结局。众多营养支持治疗指南都强调,只要存在(或部分存在)肠功能,就应首选SPN[2]。但在临床实践中,若患者不能耐受营养液及创伤或手术后发生胃排空障碍等原因,EN常难达到目标需要量,合理补充SPN,可以满足患者对能量和蛋白质的需求,能有效地改善患者的营养状况。曾有小规模的临床研究显示,给予EN的同时给予SPN并不能改善患者的临床结局,甚至增加并发症和治疗费用,因此不推荐肠内肠外联合营养支持[3]。多中心的临床研究显示,通过肠内和肠外结合支持可尽早达到营养治疗目标,能改善重症患者的临床结局[4]。目前比较一致的观点认为,需要营养支持治疗的患者,在EN无法达到目标量(少于总能量需求的60%)超过3 d时,推荐给予SSPN,同时逐步增加EN至目标量后再逐渐撤除SSPN,并努力恢复经口饮食[5]。对于本例患者,采取多种营养治疗途径相结合方式,采取EN优先、EN不足时以SPN补充、逐步过度至EN的原则。入院时给予经口饮食,治疗过程中先后采用经口饮食+SPN、EN+SPN+ONS、SPN+ONS、EN+SPN、经口饮食+EN等,出院时恢复经口饮食。
随着SPN在临床中的广泛应用,其相关的肝损和淤胆越来越普遍。进行“全合一”肠外营养约2.5个月后,“王”出现肝损和淤胆,一方面与长期使用药物有关,另一方面也与长期SPN有关[6]。对此通过予以适量营养、减少SPN中脂肪乳剂用量等调整营养治疗方案,肝功能和胆红素指标逐渐恢复正常。研究显示,当联合肠内肠外营养治疗时,SPN所占的比例越高,肝损发生风险越大。因此,对于危重症患者的营养治疗,应强调肠道给予营养的重要性,肠道功能允许条件下应尽早进行EN,以降低SPN所致的肝损和淤胆等并发症的发生率[7]。
由于放射性皮肤损伤具有潜在性、持久性、进行性作用的特征,受伤肢体部位皮肤损伤逐步进展,且在救治中需进行多次清创手术和植皮术,故患者处于高代谢状态,能量、蛋白质等多种营养素需求量增加。本例患者早中期体重及营养相关指标出现明显下降,多次出现感染,提示对于此类危重患者,其营养治疗须及早介入,应在其入院后即制定合理的营养治疗方案,以改善患者的高代谢状态,改善负氮平衡,促进创面修复,降低术后感染等并发症。
综合上述,营养治疗是放射损伤患者综合救治中极为重要的一个组成部分,应根据患者的病情,提供适当的营养配方,通过合适的途径,进行有效的营养治疗,才能提高放射损伤患者的救治成功率。
利益冲突 所有的共同作者均于投稿前阅读并认可本研究内容,本研究不存在任何潜在利益冲突 作者贡献声明 陈学英、刘玉龙提出本文的写作设计思路和方案;王优优负责病例临床治疗资料的整理;蔡梅芝、黄威威负责营养治疗资料的整理;洪秀秀和赵斯迪负责病例实验室检查和体格检查数据的整理和图表设计| [1] | 李宁. 重视外科病人营养问题[J].中国实用外科杂志,2012,32(2):101-103. DOI:1005-2208(2012)02-0101-03. Li N. Pay attention to the nutrition issues of surgical patients[J]. J Chin Prac Surg,2012,32(2):101-103. DOI:1005-2208(2012)02-0101-03. |
| [2] | 朱维铭. 肠内营养的规范化问题[J]. 肠外与肠内营养, 2013,20(4):193-195. DOI:10.3969/j.issn.1007-810X.2013.04.001. Zhu WM. The standardization issues of enteral nutrition[J]. Parent Ent Nutrit,2013,20(4):193-195. DOI:10.3969/j.issn.1007-810X.2013.04.001. |
| [3] | Dhaliwal R, Jurewitsch B, Harrietha D, et al. Combination enteral and parenteral nutrition in critically ill patient s:harmful or beneficial? A systematic review of the evidence[J]. Intens Care Med,2004,30(8):1666-1671. DOI:10.1007/s00134-004-2345-y. |
| [4] | Alberda C, Gramlich L, Jones N, et al. The relationship between nutritional intake and clinical outcomes in critically ill patients:results of an international multicenter observational study[J]. Intens Care Med,2009,35(10):1728-1737. DOI:10.1007/s00134-009-1567-4. |
| [5] | Heidegger CP, Romand JA, Treggiari MM, et al. Is it now time to promote mixed enteral and parenteral nutrition for the critical-ly ill patient?[J]. Intens Care Med,2007,33(6):963-969.DOI:10.1007/s00134-007-0654-7. |
| [6] | Xu ZW,Li YS. Pathogenesis and treatment of parenteral nutrition-associated liver-disease[J]. Hepatobiliary Pancreat Pis Int, 2012, 11(6):586-593. DOI:10.1016/S1499-3872(12)60229-X. |
| [7] | Lauriti G, Zani A, Aufieri R, et al. Incidence, prevention, and treatment of parenteral nutrition-associated cholestasis and intestinal failure-associated liver disease in infants and children:a systematic review[J]. J Parenter Enteral Nutr,2014,38(1):70-85. DOI:10.1177/0148607113496280. |
 2016, Vol. 36
2016, Vol. 36


