2. 215004 苏州, 苏州大学附属第二医院应急中心
2. Department of Nuclear Emergency Center, Second Affiliated Hospital of Soochow University, Suzhou 215004, China
辐射可引起眼部组织的损伤而导致相应的病变,特别是眼晶状体及视网膜的病变(如白内障和视网膜视神经病变或萎缩)。此外,还可引起包括溢泪、干眼症、眼睑外翻、巩膜坏死、青光眼等多种损伤[1]。在日本广岛、长崎原子弹爆炸幸存者的随访结果显示,白内障的发生率明显增高。苏州大学附属第二医院眼科对2014年5月7日南京192Ir源事故受照剂量最大患者 “王”进行20个月的眼部临床随访观察,现将相关临床资料总结报道如下。
1. 一般资料:事故经过资料见本刊周启甫等[2]报道;临床资料见本期刘玉龙等的报道。
2. 眼科检查方法
(1)裂隙灯检查:采用附带前眼部照相功能的SLM-3裂隙灯显微镜做角膜、前房及眼晶状体的检查并拍照存档。
(2)视野检查:采用自动视野分析仪(瑞士Octopus101),应用静态全阈值程序对受检者进行视野检测。患者在自然瞳孔下接受检查,检查前根据患者的屈光度数及年龄加上相应的矫正镜片,双眼检查顺序随机。
(3)光学相干断层扫描(optical coherence tomography,OCT)检查:应用0.5%复方托吡卡胺充分散瞳,采用光学相干断层扫描仪(Cirrus HD-OCT 400,Carl Zeiss)检查并观察患者黄斑区和视网膜神经纤维层改变,扫描速度27 000 scans/s,轴向分辨率为5 μm,立体扫描,黄斑区512×128,视盘区200×200,应用分析软件测量黄斑部9个分区的视网膜厚度以及视网膜神经纤维层厚度。
(4)眼底照相和眼底荧光素血管造影(fundus fluorescein angiography,FFA)检查:应用0.5%复方托吡卡胺充分散瞳,采用蔡司眼底照相机(VISUCAMNM/FA)进行彩色眼底照相及眼底荧光素血管造影检查,拍照45°眼底后极部彩色照片,根据眼底照片结果再行FFA检查。
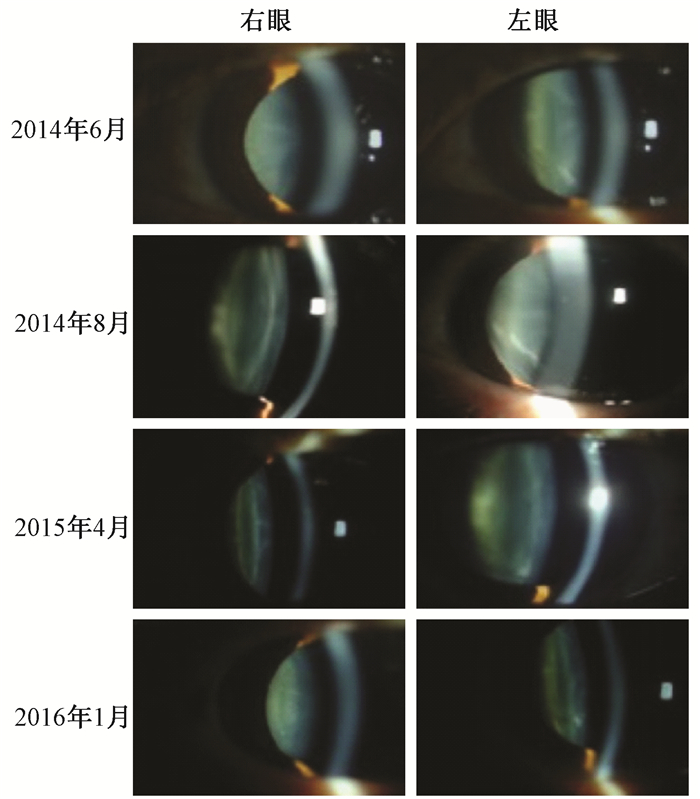
1. 裂隙灯检查:分别于2014年6月和8月、2015年4月及2016年1月对“王”进行了检查。与2014年6月相比,2014年8月的眼晶状体情况变化不大,左眼近眼晶状体赤道部可见一条楔形浑浊,双眼晶状体皮质区偶见散在粉末状点样浑浊灶,2015年4月右眼晶状体皮质区粉末状点样浑浊灶部分增加,2016年1月右眼晶状体皮质区出现成簇的粉末状、结晶状、点状浑浊灶,左眼晶状体皮质区浑浊点同时也部分增加,见图 1。
|
图1 2014年6月—2016年1月患者双眼裂隙灯检查 Figure 1 Slit lamp examination results of the patient from Jun 2014 to Jan 2016 |
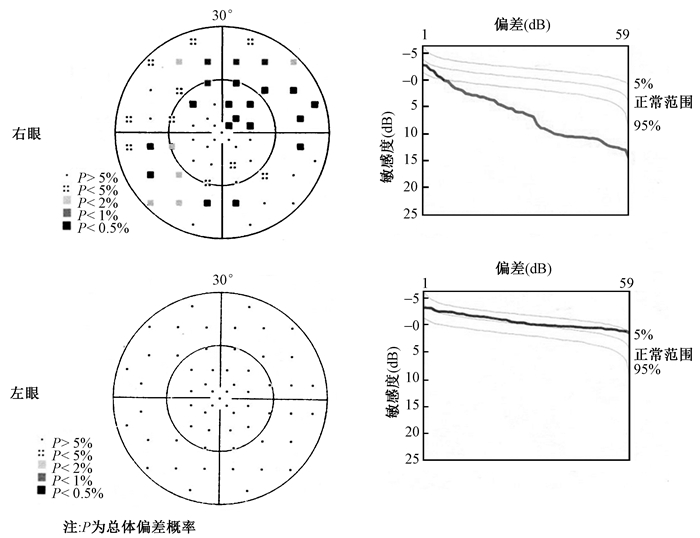
2. 视野检查:2016年1月用Octopus101自动视野分析仪给“王”做了视野检查。受照1个月后视野检查无异常,受照20个月后复查时发现:右眼视野颞上方可见部分视野缺损,鼻下方散在局部暗点,视觉敏感度下降,左眼视野及视觉敏感度基本正常,见图 2。
|
图2 2016年1月患者双眼视野检查 Figure 2 Visual field examination results of the patient in Jan 2016 |
3. 光学相干断层扫描(OCT)检查:采用OCT观察“王”的黄斑区图像特征,应用黄斑地形图分析软件测量黄斑部9个分区的视网膜厚度。直径1 mm的中央区(CSF)视网膜平均厚度分别为:2014年6月检测,右眼258 μm,左眼255 μm;2014年8月检测,右眼251 μm,左眼240 μm;2016年1月检测;右眼250 μm,左眼247 μm。OCT检查视网膜神经纤维层(RNFL)平均厚度分别为:右眼 72 μm,左眼79 μm。双眼视神经纤维层变薄。
4. 眼底照相: 2014年6月检查中发现:视网膜右眼鼻侧边缘区外侧及左眼颞侧边缘区外侧有部分点状或片状的硬性渗出,玻璃膜疣,视盘颜色稍淡,有视神经部分萎缩倾向,右眼杯盘比(C/D)≈0.55,左眼C/D≈0.50,2016年6月复查时见双眼眼底黄白色斑点样灶明显增多(FFA证实部分斑点状高荧光改变,提示色素上皮层改变),范围扩大,视盘颜色较淡,视神经部分萎缩,右眼C/D≈0.55,左眼C/D≈0.50。
5.FFA检查:2016年1月通过静脉注入荧光素钠,对“王”双眼行眼底荧光素血管造影检查。造影动脉期沿视盘区出现点状或少许絮状渗漏,持续至造影晚期,与眼底照相结果相吻合。
眼晶状体是人体对辐射效应较敏感的器官之一,电离辐射可诱发白内障[3]。国家标准放射性白内障形态为眼晶状体后囊下区域内出现点状、空泡状或盘状浑浊[4],而近期研究观察发现在眼晶状体皮质内也可发现辐射诱导的眼晶体状浑浊[5]。另外,有文献报道,白内障模型建立以及结果证实放射性白内障的形成速度和程度与照射剂量成正相关[6]。近年来,分子生物学、生物化学及基因工程的迅猛发展,也为研究白内障的发病机制提供了更为广阔的前景[7]。“王”受照20个月后,在眼晶状体楔形浑浊基础上又出现粉末样或点状浑浊明显增多,双眼非对称性变化,非冠状分布,且增长速度较快,确定其眼晶状体浑浊病变有所进展,很可能与辐射损伤直接相关,但仍属放射性白内障的早期阶段,并未形成放射性白内障的典型改变和表型。患者在后期的随访复查时,眼晶状体的浑浊出现了新的变化,这种改变主要表现在:原有的周边皮质浑浊范围增大明显,且在眼晶状体的成年核及皮质层部分出现了粉尘状浑浊点,且数量多、密度大;成绕核分布。经查询相关文献,与多数文献所报道放射性损伤的白内障特点不完全一致[3],但又非老年白内障的形态。该患者早期的眼晶状体楔形浑浊与老年性白内障的初期表现相似,而后出现的在晶状体成年核及皮质区的高密度、绕核分布的粉尘状浑浊点又不是老年皮质性白内障的形态。眼底检查未见高度近视、色素膜炎、视网膜色素变性等病变,也无相应的眼晶状体特征性改变,故可排除相关并发性白内障的可能。患者既往无糖尿病、手足搐搦及长期服用类固醇等疾病史和服相关药物治疗史,同样可排除相关代谢性白内障。因此,认为这种新近出现的眼晶状体变化很可能是放射性白内障的另一个新的特征。故而,仍需继续观察“王”放射损伤所致眼晶状体及视网膜变化的长期改变。
放射性视网膜病变是由于射线对视网膜血管、脉络膜血管及睫状后短动脉损害所致的迟发性、慢性进行性的视盘、视网膜和脉络膜病变。以后极部视网膜出血、视盘改变及黄斑水肿等变化为放射性视网膜病变较常见的表现特征[8]。后极部视网膜比周边视网膜对放射损伤更敏感,辐射最先导致后极部血管损伤,可引起视网膜水肿和缺血,产生新生血管,导致玻璃体出血和视网膜脱离等[9, 10, 11]。“王”受192Ir源辐射损伤,经长达20个月后的随访发现,“王”右眼视功能下降,视神经部分萎缩,眼底血管造影检查发现沿视盘周围附近区的视网膜出现点状或少许絮状渗漏,病变部位符合放射性视网膜病变的改变,视网膜色素上皮层(RPE层)也可见到斑点状萎缩灶,但放射性视网膜病变的表现与多种全身性和眼部疾病的改变也有一些相似征象,一旦明确诊断后即可以采用相应的对症治疗措施,正确诊断和及时治疗有助于减轻损害程度和防止发生严重的视功能损害,同时对该类患者的长期随访观察也是临床及科研工作中非常重要的工作。
利益冲突 无 作者贡献声明 徐国旭负责病员眼检查、论文书写及审核;娄慧、曾欣蔚、王优优负责临床资料收集整理及部分图片、文字说明;刘玉龙负责病员的救治及论文初审指导| [1] | Finger PT. Radiation therapy for choroidal melanoma[J]. Surv Ophthalmol, 1997, 42(3):215-32. DOI:10.1097/HP.0000000000000152. |
| [2] | 周启甫,陈栋梁,周晓剑,等. 南京192Ir放射源辐射事故应急调查及分析[J]. 中华放射医学与防护杂志, 2014, 34(8):561-562. DOI:10.3760/cma.j.issn.0254-5098.2014.08.001. Zhou QF, Chen DL, Zhou XJ, et al. Analysis and investigation of Nanjing 192Ir emergency radiation accident[J]. Chin J Radiol Med Prot, 2014, 34(8):561-562. DOI:10.3760/cma.j.issn.0254-5098.2014.08.001. |
| [3] | 孙海华. 辐射性白内障的研究进展[J]. 中华灾害救援医学, 2014, 3(2):171-175. DOI:10.3969/cma.j.issn.2095-6275.2014.03.016. Sun HH. The research on advances in radiation cataract[J]. Chin J Disa Med, 2014, 3(2):171-175. DOI:10.3969/cma.j.issn.2095-6275.2014.03.016. |
| [4] | 国家卫生和计划生育委员会. GBZ 95-2014职业性放射性白内障的诊断[S]. 北京:中国标准出版社,2014. National Health and Family Planning Commission. GBZ 95-2014 diagnostic criteria for occupational radiation cataract[S]. Beijing:Standards Press of China, 2014. |
| [5] | 孙海华,吴志鸿.放射性白内障研究进展[J]. 眼科学, 2013, 2(3):17-22. DOI:10.12677/HJO.2013.23004. Sun HH, Wu ZH. Research progress of radiation cataract[J]. Ophthalmology, 2013, 2(3):17-22. DOI:10.12677/HJO.2013.23004. |
| [6] | 杨焕,徐国旭,刘东伟,等. αB-晶体蛋白在放射性白内障大鼠眼晶状体中的表达[J].中华放射医学与防护杂志, 2009, 29(2):160-163. DOI:10.3760/cma.j.issn.0254-5098.2009.02.011. Yang H, Xu GX, Liu DW, et al. Expression of αB-crystallin in X-ray irradiated rat lenses[J]. Chin J Radiol Med Prot, 2009, 29(2):160-163. DOI:10.3760/cma.j.issn.0254-5098.2009.02.011. |
| [7] | 徐国旭, 刘东伟, 张敬法, 等. 大鼠放射性白内障氧化损伤机制的探讨[J].中华放射医学与防护杂志, 2010, 30(2):177-178. DOI:10.3760/cma.j.issn.0254-5098.2010.02.017. Xu GX, Liu DW, Zhang JF. Mechanism of oxidative damage induced by radiation in rats[J]. Chin J Radiol Med Prot, 2010, 30(2):177-178. DOI:10.3760/cma.j.issn.0254-5098.2010.02.017. |
| [8] | Archer DB. Responses of retinal and choroidal vessels to ionisingradiation[J]. Eye (Lond), 1993, 7(1):1-13. DOI:10.1038/eye.1993.3. |
| [9] | Zamber RW, Kinyoun JL. Radiation retinopathy[J]. West J Med, 1992, 157(5):530-533. |
| [10] | Viebahn M, Barricks ME, Osterloh MD. Synergism between diabetic and radiation retinopathy:case report and review[J]. Br J Ophthalmol, 1991, 75(10):629-632. DOI:10.1186/1471-2415-7-6. |
| [11] | Xu GX, Zhang JF. αB-crystallin, malondialdehyde, superoxide dismutase, and glutathione peroxidase changesin X-ray irradiated rat lens[J]. Int J Ophthalmology, 2011, 4(4):365-370. DOI:10.3980/j.issn.2222-3959.2011.04.08. |
 2016, Vol. 36
2016, Vol. 36


