2. 215004 苏州, 苏州大学附属第二医院整形外科
2. Department of Plastic Surgery, Second Affiliated Hospital of Soochow University, Suzhou 215004, China
脐带间充质干细胞(hUC-MSCs)可通过分化成为表皮及真皮细胞、促进新生血管形成、分泌生长因子等促进难愈性创面的愈合。为此,采用了hUC-MSCs修复1例192Ir源致Ⅳ度急性放射性皮肤损伤的局部创面,观察其疗效,并初步探讨其修复机制,为临床加快急性放射性皮肤损伤创面的愈合提供新思路。
1. 患者一般资料:详见本期刘玉龙等的报道。
2. 临床救治:放射性皮肤损伤的特点为皮损边界、深度难以确定,并且会长期反复损伤,不易愈合。患者局部受照剂量大,局部皮肤破溃、坏死,根据患者的创面变化,早期对创面进行多次清创,以切除坏死组织,防止局部坏死代谢产物侵入血液造成多器官功能衰竭,待坏死组织不再扩大后,对患者进行了两次肌皮瓣移植手术,并在术后输注了hUC-MSCs以促进创面愈合。
3. hUC-MSCs的分离与扩增:本例中使用的hUC-MSCs由上海脐血库提供,具体制备方法详见李艳琪等[1]报道。
4. hUC-MSCs的输注:采用P5代新鲜制备hUC-MSCs用于临床治疗,细胞活力为99%,病原学检测均阴性,包括乙型肝炎病毒表面抗原(HBsAg)、丙型肝炎表面抗体(HCV-Ab)、梅毒血清学试验、人类免疫缺陷病毒抗体(HIV1/2-Ab)、巨细胞病毒IgM抗体(CMV-IgM)。应用hUC-MSCs治疗前给予地塞米松5 mg及盐酸异丙嗪(非那根)10 mg常规用药,预防过敏反应,患者于2015年2月2日、2月9日静脉输注制备好的hUC-MSCs悬液,每次剂量10.1×106 U(含细胞数10×106个),溶于100 ml的0.9%的生理盐水中,15 min输注完毕,当时患者体重为37 kg,相当于输注MSC的数量为0.54×106/kg。
5. 观察指标
(1)观察hUC-MSCs输注前后患者创面的愈合状况。
(2)用短串联重复序列复合扩增方法(STR-PCR)检测hUC-MSCs植入情况:收集患者输注hUC-MSCs前的外周血,以及输注hUC-MSCs 7 d后及14 d后的外周血及创面组织,试剂盒提取间充质干细胞(MSCs)、外周血及创面组织的DNA并进行稀释,选取15个短串联重复序列(STR)位点(D8S1179、D21S11、D7S820、CSF1P0、D3S1358、TH01、D13S317、D16S539、D2S1338、D19S433、vWA、TPOX、D18S51、D5S818、FGA)及XY染色体上的一个Amelogenin蛋白标志物进行PCR扩增,最后用遗传分析仪进行毛细管电泳及片段分析。
(3)采用酶联免疫吸附测定法(ELISA)测定样本中的血管内皮生长因子(VEGF)浓度:采集患者输注hUC-MSCs前以及输注后不同时间段的外周血及创面组织样本,采用ELISA试剂盒(英国Abcam公司)测定样本中的VEGF的浓度。用酶标仪在450 nm波长下测定吸光度(A)值,通过标准曲线计算样本中VEGF浓度。
1. 患者创面愈合情况:患者右下肢诊断为Ⅳ度急性放射性皮肤损伤,早期全身应用抗生素控制感染,局部予以定期换药、多次清创、负压封闭引流(VSD)等处理创面,但由于放射性损伤的特殊性,患者局部损伤进行性加重,病变范围不断扩大。在患者受照后171 d,伤口坏死组织边界分明后,为促进创面愈合,避免截肢,行右下肢清创术+背阔肌游离皮瓣转移修复术+背部取皮植皮术+右臀部取皮术,但术后皮瓣出现血运不良表现,最终皮瓣有20%未存活,遂于患者受照后263 d进行了第2次皮瓣移植术。由于患者皮瓣移植范围大,切除坏死组织深达股骨,且放射损伤造成血管内皮细胞损伤严重,皮瓣移植后基底部血供差,这可能导致了第1次手术后有部分皮瓣未存活。为促进血管新生,加速创面愈合,在第2次皮瓣移植术后第8天、第15天对患者进行了hUC-MSCs输注,结果,右腿创面皮瓣移植区皮瓣全部存活,且最终患者创面愈合良好(图 1)。
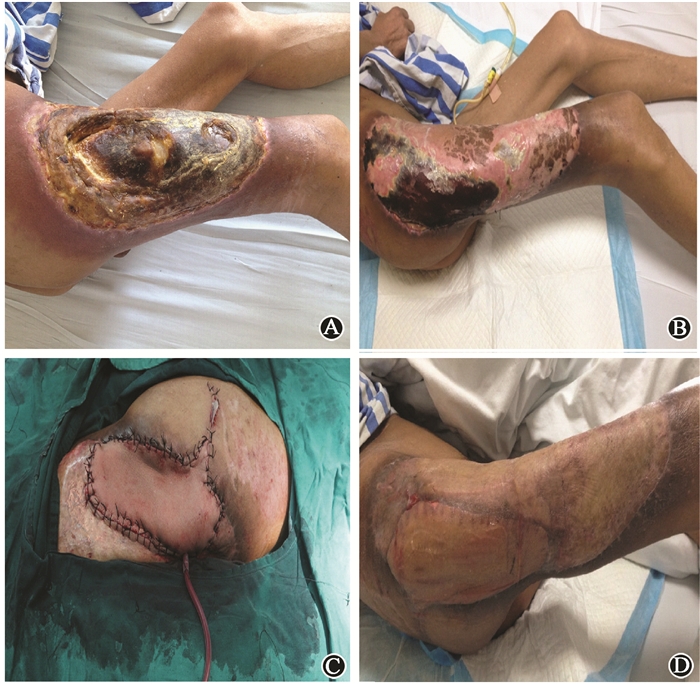
|
图1 受照后不同时期患者创面的愈合情况 A.患者皮瓣移植术前(受照后170 d);B.患者第1次皮瓣移植术后部分皮瓣血运不良(受照后255 d);C.患者第2次皮瓣移植术结束(受照后263 d);D.患者第2次皮瓣移植术后,输注hUC-MSCs后创面愈合情况(受照后300 d) Figure 1 Wounds healing during different periods A.Before the flap transplantation(170 d after exposure); B.Part of the flap with poor blood supply after the first flap transplantation(255 d after exposure); C.At the end of the second flap transplantation(263 d after exposure); D.After accepting hUC-MSCs intravenous injection(300 d after radiation) |
2. 移植后STR-PCR检测:采集患者输注MSCs前及第1次输注MSCs后第2、40、58天的外周血样本,通过STR-PCR检测在创面愈合过程中hUC-MSCs的植入情况,结果发现,输注干细胞后所检测出的仍是本人的基因位点,未检测到外源性基因植入现象,即说明未检测到hUC-MSCs的植入。
3. 免疫组织化学方法测定VEGF分泌情况:结果列于表 1。由表 1可知,在输注间充质干细胞1 d后,患者血清中及创面组织中的VEGF明显升高,但是在输注hUC-MSCs 1周后,患者血清中及创面组织中的VEGF与输注前相比变化不大。
| 表1 输注脐带间充质干细胞(hUC-MSCs)前后不同时间患者血清及创面组织中VEGF的浓度变化(ng/ml) Table 1 The change of relative VEGF level in serum and wounded tissue during different periods before and after the infusion of hUC-MSCs(ng/ml) |
MSCs具有易于外源基因转染和表达、分泌造血因子、抗原性小、组织修复能力强等特征,应用MSCs治疗大剂量照射导致的严重放射性皮肤损伤有极大的应用研究[2]。其中,hUC-MSCs与其他来源的MSCs相比,具有取材方便、无道德伦理限制、易于工业化制备等特征,将其应用于放射损伤的临床治疗有着良好的前景[3]。
本研究中患者在第2次肌皮瓣移植术后接受了hUC-MSCs的输注,最终创面愈合良好,在一定程度上反映了hUC-MSCs对组织的修复作用,但其具体机制仍不明确。目前,主要有以下几种观点:①创面微环境中的炎性分子及一些趋化因子可促进MSCs增殖,并促使MSCs靶向迁移至受损组织,从而参与创面的修复[4]。②MSCs具有强大的分化功能,在特定条件下,MSCs可以分化成为多种皮肤组织结构[5],直接参与创伤组织修复。③创面组织的炎性微环境可激活MSCs的旁分泌机制,分泌多种细胞因子,例如IL-10、TGF-β、VEGF、角质细胞生长因子(KGF),这些因子可减轻创面的炎症,甚至可促进组织再生[6]。④MSCs特有的免疫学特性可减轻创面损伤局部的自身免疫反应和炎症反应,加速创面修复[7]。
本研究表明,MSCs增加了创面局部及外周血的VEGF的含量,从而促进了放射性皮肤损伤创面的愈合。在放射性皮肤损伤创面的愈合过程中,组织的自我修复能力不足,主要原因是放射损伤对血管内皮细胞损伤严重,新生的血管满足不了再生组织的营养供应,从而导致创面经久不愈[8]。有研究表明,MSCs进入损伤组织后最先到达的部位是循环系统,最先修复的是血管内皮组织,从而使得小的循环通道得以修复,改善了损伤组织局部的血运情况,从而修复了损伤组织[9]。对于本例患者这种放射损伤后手术伤口,创伤较深,恢复的关键之一在于血管再生,这会直接影响到创面愈合的结局。VEGF是血管生成的关键调控因素之一,能高度特异性地作用于血管内皮细胞上的有丝分裂原,通过与其受体结合加速血管增殖,具有血管新生、促进血管生成的作用。已有研究表明,MSCs在体外能通过分泌大量的VEGF促进血管的增殖[10],这也与本研究的结论相符。
本例研究中未检测到外源性MSCs植入的证据,分析其可能原因为:①患者全身受照剂量较小,未明显影响其免疫功能,且患者住院期间应用增强免疫功能药物,其自身免疫功能尚可,可能不利于外源性MSCs的植入。②输注的MSCs含量低,不足以在患者体内大量扩增,MSCs的推荐应用剂量是1×106 U/kg,本例中患者在输注MSCs时体重37 kg,本预计给患者输注40×106 U,分4次输注,但由于后期患者全身情况变化,体内内环境紊乱,出现多器官障碍表现,综合考虑患者病情后,仅仅对患者输注了2次MSCs。③本研究STR-PCR检测中相关仪器精度的限制,不足以检测到MSCs在血液或创面组织中的植入。④MSCs可能植入了其他器官或组织。⑤MSCs可能分化成为了其他组织。结合VEGF因子在MSCs植入前后的改变,可以推测MSCs发挥修复作用更多的是通过旁分泌机制分泌多种细胞因子参与创面的愈合过程。
目前,很多动物实验中已证实MSCs对放射性创面有着良好的修复作用[11],但真正应用于临床尚不多见。本研究中,患者外周血或组织中VEGF在输注MSCs 1周后均明显下降,但是为了减少对患者创面的再次创伤,不能更多获取患者血液或组织进行研究,所以,具体的变化规律仍有待更多的实验明确。MSCs在放射损伤的创面修复中有着良好的临床应用前景,还有很多问题需要进一步探讨,如MSCs的最佳治疗时机、有效细胞数量、合理的治疗途径及时间间隔等。
志谢 苏州大学附属第一医院的陈广华和冯宇峰提供了实验协作 利益冲突 作者无利益冲突,排名无争议。作者的配偶、工作伙伴或子女不存在影响研究结果的财务关系 作者贡献声明 包明月负责此论文的设计及撰写;刘玉龙主持了患者的临床救治工作,并在论文撰写过程中给予了指导;王优优、余道江、陈炜博、郑旭、李元、卞华慧、郭凯琳参与了临床的救治过程;所有作者均阅读了稿件,可以证明论文的原创性| [1] | 李艳琪,王洪一,姚尧,等. 人脐带源间充质干细胞分离培养方法的改进[J]. 中国组织工程研究, 2014, 18(10):1609-1614. DOI:10.3969/j.issn.2095-4344.2014.10.021. Li YQ, Wang HY, Yao Y, et al. An improved method for isolation of human umbilical cord mesenchymal stem cells[J]. China J Tissure Eng Res, 2014, 18(10):1609-1614. DOI:10.3969/j.issn.2095-4344.2014.10.021. |
| [2] | Erik B, Eaton Jr, Timothy R, et al. Mesenchymal stem cell therapy for acute radiation syndrome:innovative medical approaches in military medicine[J]. Milit Med Res, 2014, (3):1-9. DOI:10.1186/s40779-014-0027-9. |
| [3] | 杨文成,董有海. 人脐带间充质干细胞的研究进展[J]. 组织工程与重建外科杂志, 2010, 6(5):292-294. DOI:10.3969/j.issn.1673-0364.2010.05.016. Yang WC, Dong YH. The research progress of human umbilical cord mesenchymal stem cells[J]. J Tissue Eng Recon Surg, 2010, 6(5):292-294. DOI:10.3969/j.issn.1673-0364.2010.05.016. |
| [4] | Zhang J, Gong JF, Zhang W, et al. Effects of transplanted bone marrow mesenchymal stem cells on the irradiated intestine of mice[J]. Biomed Sci, 2008, 15(5):585-594. DOI:10.1007/s11373-008-9256-9. |
| [5] | Sasaki M, Abe R, Fujita Y, et al. Mesenchymal stem cells are recruited into wounded skin and contribute to wound repair by transdifferentiation into multiple skin cell type[J]. Immunology, 2008, 180(4):2581-2587. DOI:10.4049/jimmunol.180.4.2581. |
| [6] | Niwa A, Umeda K, Chang H, et al. Orderly hematopoietic development of induced pluripotent stem cells via Flk-1(+) hemoangiogenic progenitors[J]. Cell Physiol, 2009, 221(2):367-377. DOI:10.1002/jcp.21864. |
| [7] | 朱红燕,张宏,傅晋翔,等. 骨髓间充质干细胞与急性皮肤放射损伤的修复[J].中国组织工程研究与临床康复, 2009, 13(32):6303-6308. DOI:10.3969/j.issn.1673-8225.2009.32.020. Zhu HY,Zhang H,Fu JX,et al.Bone marrow mesenchymal stem cells promote the regeneration of irradiation-induced acute skin injury[J].J Clin Rehab Tissue Eng Res,2009,13(32):6303-6308. DOI:10.3969/j.issn.1673-8225.2009.32.020. |
| [8] | 张晓启,刘旭盛,刘爽,等. 血管内皮细胞生长因子对内皮细胞放射损伤的保护作用[J]. 中华放射医学与防护杂志, 2002, 22(3):178-180. Zhang XQ, Liu XS, Liu S, et al. Effect of vascular endothelial growth factor on irradiated primary human umbilical vein endothelial cells[J]. Chin J Radiol Med Prot, 2002, 22(3):178-180. |
| [9] | 陈强,李志满,吴建军. BMSCs对大鼠放射性皮肤损伤的治疗研究[J]. 实验动物科学, 2014, 31(2):35-37. Chen Q, Li ZM, Wu JJ. BMSCs therapy for the radiation skin injury of rats[J]. Lab Anim Sci, 2014, 31(2):35-37. |
| [10] | Kaigler D, Krebsbach PH, Polverini PJ, et al. Role of vascular endothelial growth factor in bone marrow stromal cell modulation of endothelial cells[J]. Tissue Eng, 2003, 9(1):95. |
| [11] | Zhang B, Wang M, Gong AH, et al. HucMSC-exosome mediated-wnt4 signaling is required for cutaneous wound healing[J]. Stem Cells, 2015, 33(7):2158-2168. DOI:10.1002/stem.1771. |
 2016, Vol. 36
2016, Vol. 36


