2. 250014 济南, 山东省千佛山医院放射科;
3. 250062 济南, 山东省医学科学院放射医学研究所
2. Department of Radiology, Qianfoshan Hospital of Shandong Province, Jinan 2500014, China;
3. Institute of Radiation Medicine, Shandong Academy of Medical Sciences, Jinan 250062, China
18F-氟代葡萄糖正电子发射断层扫描计算机层析成像(X射线)技术(18F-FDG-PET/CT)是一种先进的分子成像诊断技术,通过先进的分子、功能、代谢成像与经典的解剖、形态、密度显示相互结合,可以无创、定量、动态地对受检者体内经正电子标记的放射性药物进行监测,从分子水平对活体内生理和生化的改变进行早期诊断。目前,这一技术主要用于早期发现肿瘤、鉴别肿瘤良恶性、寻找原发灶、更全面了解全身恶性肿瘤患者病变情况及疗效评估和复发监测等。此外,越来越多的研究表明,其亦可用于其他非肿瘤性疾病的早期发现[1, 2]。有研究认为,PET/CT受检者所受剂量不高,检查安全,不良反应轻[3, 4]。本研究以日本大耳白兔为研究对象,观察其经长期18F-FDG-PET/CT检查后机体部分免疫指标的变化。
1.实验动物:健康雄性成年日本大耳白兔,购自济南西岭角养殖繁育中心,许可证号SCXK(鲁)2010-0005,体重2.0~2.5 kg/只,饲养温度25℃,湿度60%~70%。实验经所在单位动物伦理委员会批准。
2.仪器与试剂:PET-CT机(Minitrace,美国GE公司),CRS-3I水箱(美国MED-TEC公司),Discovery-LS PI-T/CT(美国GE公司),7180型全自动生化检测仪(日本日立公司)。CD4+抗体、CD8+抗体、肿瘤坏死因子α(TNF-α)抗体、白介素1β(IL-1β)均购自美国BD Pharmingen公司。18F-FDG、磷酸盐缓冲液(PBS)本院自行生产配置。
3.动物分组及处理:将白兔按随机数字表法分为健康对照组和实验组,每组各18只。实验组动物禁食6 h后静脉留置针注射18F-FDG示踪剂(222 MBq),动物随后在安静、暗光条件下休息40 min后行全身18F-FDG-PET/CT显像。实验组动物每天进行1次CT扫描,每周连续进行5 d,共照射3个月。分别于第1、2和3个月末取动物组织检测,每次6只,健康对照组未给予照射。各项实验重复3次。
4.白细胞数测定:用微吸管取动物耳静脉血液加入有1%HCl的干净PE管中,使溶液混匀,破碎红细胞。微吸管每吸完1个血样后,分别用水、乙醚试剂、纯乙醇试剂依次清洗。准备干净的血细胞计数板和盖玻片,用干净吸管吸取溶液,轻轻在侧面滴加,之后显微镜下计数白细胞数。
5.动物胸腺与脾脏指数测定:动物取血后颈椎脱臼处死,取脾脏、胸腺,分析天平称胸腺、脾脏质量。通过以下公式计算脏器指数:
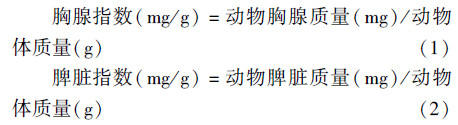
6.腹腔巨噬细胞吞噬功能测定:将鸡红细胞注入兔腹腔,待巨噬细胞吞噬鸡红细胞后4 h,取动物腹腔液涂片,自然干燥,经染色后在油镜下观察巨噬细胞吞噬鸡红细胞的情况,计算吞噬指数与吞噬百分率,以此评价吞噬细胞的吞噬功能。
7.外周血免疫T细胞亚群的检测:取动物外周血约500 μl置于肝素抗凝的EP管中,依据外周血WBC计数,按照抗体所需标准量分别加入CD4+抗体、CD8+抗体各0.625 μl,常温避光孵育30 min,按比例加入红细胞裂解液,振荡混匀,常温避光,孵育15 min,溶血。加PBS终止,离心半径10 cm,3 000 r/min,离心8 min,弃上清,用250 μl PBS重悬细胞,加入150 μl 4%多聚甲醛混匀后用流式细胞仪进行分析,检测CD4+、CD8+T细胞数量,计算CD4+/CD8+比值。
8.动物血清IgG、IgA、IgM含量测定:动物股动脉取血0.5 ml,离心半径10 cm,4 000 r/min,离心10 min,取血清,自动生化仪上用免疫比浊法分别测定IgG、IgA、IgM含量。
9.动物血浆TNF-α、IL-1β水平测定:收集兔血浆,应用免疫印迹试验裂解细胞,将分离的蛋白条带通过湿法转至PVDF膜上,分别加入第一抗体TNF-α和IL-1β,经孵育、洗涤、显色、显影、定影步骤后检测TNF-α、IL-1β蛋白表达。
10.统计学处理:数据以x± s 形式表示。使用SPSS 13.0软件进行分析。Bonferroni Test进行多个样本间的两两比较。P<0.05为差异有统计学意义。
1.辐射对兔白细胞数、脾脏和胸腺指数的影响:结果见表 1。由表 1可知,与正常对照组比较,连续辐射2个月至3个月后兔白细胞总数出现增加,而脾脏和胸腺指数却出现下降,且显示出一定的量效关系,差异有统计学意义(t=3.144~72.903,P<0.05)。
| 表 1 辐射对兔白细胞总数、脾脏和胸腺指数的影响 Table 1 Effects of radiation on the total number of cells, spleen and thymus index |
2.辐射对兔巨噬细胞吞噬功能的影响:结果见表 2。由表 2可知,照射1个月后巨噬细胞吞噬百分率、照射2和3个月后的吞噬指数与吞噬百分率与正常对照组比较均出现下降,差异有统计学意义(t=2.719~11.859,P<0.05)。
| 表 2 辐射对兔巨噬细胞吞噬功能的影响 Table 2 Effects of radiation on phagocytic function of rabbit macrophage |
3.辐射对T细胞亚群的影响:结果见表 3。由表 3可知,与正常对照组比较,辐射后,兔CD4+(2~3个月)出现明显升高,而CD8+(1~3个月)出现降低,导致CD4+/CD8+比值明显增加,差异有统计学意义(t=6.433~29.877,P<0.05)。
| 表 3 辐射对兔外周血T细胞亚群及其比值的影响 Table 3 Effects of radiation on T-lymphocyte subsets and their ratio in peripheral blood of rabbits |
4.辐射对兔血清IgG、IgM、IgA含量的影响:结果见表 4。由表 4可知,辐射后动物血清中IgG含量随照射时间增加而下降,呈现量效关系,不同实验组间差异有统计学意义(t=4.577~28.775,P<0.05)。IgA含量在照射两个月后出现明显降低(t=2.720~28.775,P<0.05)。IgM含量在照射2个月和3个月组间差异不明显。
| 表 4 辐射对兔血清 IgG、IgM、IgA 含量的影响 Table 4 Effects of radiation on the content of IgG, IgA and IgM in rabbit serum |
5.辐射对兔血清TNF-α,IL-1蛋白表达的影响:结果见图 1。实验组的表达较与正常对照组比较,在照射1~3个月后兔血清TNF-α,IL-1表达量明显增加。

|
注:1.实验组照射3个月;2.实验组照射2个月; 3.实验组照射1个月;4.健康对照组 图 1 辐射对兔血清TNF-α,IL-1蛋白表达的影响 Figure 1 Effect of irradiation on the expressions of TNF- alpha and IL-1 in rabbit serum |
机体免疫器官由骨髓、胸腺、脾脏、淋巴结、淋巴样组织等组成,免疫器官既是免疫细胞发生、分化、成熟的场所,也是免疫反应进行的地点[5]。免疫器官的脏器指数是衡量机体免疫功能的初步指标,脏器指数的异常,可旁证组织学病理改变,胸腺和脾脏作为机体的主要免疫器官,本实验发现,经长时间18F-FDG-PET/CT照射后,兔的白细胞数,胸腺指数和脾脏指数都有所下降,提示18F-FDG-PET/CT对动物免疫器官有一定损伤。
单核-巨噬细胞系统是机体免疫系统的重要组成部分,除具吞噬、杀伤和清除异物的作用外,在调节机体免疫平衡方面也具有重要作用[6]。单核-巨噬细胞吞噬功能可反映机体非特异性免疫功能状况。功能缺陷时,易发生感染、肿瘤及自身免疫性疾病等。巨噬细胞通过分泌IL-1和TNF-α来实现免疫调节作用。IL-1可促进T和B细胞的增殖和分化,刺激造血干细胞并参与炎症反应[7]。TNF-α具有参与炎症反应、发热和杀死肿瘤细胞的作用。免疫球蛋白由B淋巴细胞产生,普遍存在于血液、组织液、分泌液中,IgG、IgM、IgA对人体的免疫功能有重要作用,在机体的非特异性免疫中发挥重要作用[8]。本实验结果表明,经过18F-FDG-PET/CT照射后,兔吞噬指数和吞噬百分率、兔血清的IgG、IgM、IgA含量均出现下降,且与辐射剂量有一定效应关系,提示,长期18F-FDG-PET/CT扫描对机体的免疫系统及免疫蛋白均有一定的损伤。
利益冲突 本人与本人家属、其他研究者没有可能影响研究结果的财务关系,所写内容均中立及客观,无利益冲突 作者贡献声明 张巍负责研究设计及论文撰写;罗毅负责设计实验方案极实施;柳怡负责资料收集及统计分析;李洁清协助实验实施| [1] | Chen C, Yan LM, Guo KY, et al. The Diagnostic value of[18F]-FDG-PET/CT in hemopoietic radiation toxiciy: a Tibet minipig model[J]. J Radiat Res,2012,53(6):537-544. DOI: 10.1093/jrr/rrs006. |
| [2] | Cheng MF, Wu YW, Liu KL, et al. Diagnostic value of 18F-FDG-PET/CT in indeterminate infiltrative hepatic lesions in an endemic area of viral hepatitis[J]. Nucl Med Commun, 2011, 32(4): 252-259. DOI: 10.1097/MNM.0b013e32834368bf. |
| [3] | Huang B, Law MW, Khong PL. Whole body PET/CT scanning: estimation of radiation dose and cancer risk[J]. Radiololgy, 2009, 251(1): 166-174.DOI: 10.1148/radiol.2511081300. |
| [4] | 李英华. 正电子发射断层(PET)显像剂18F-Fethypride化学合成、放射性标记及生物学评价[D]. 长春: 吉林大学, 2014. Li YH. Chemosynthesis radioactive labelling and biological assessment of 18F-Fethypride for PET imaging agent[D]. Changchun: Jilin University, 2014. |
| [5] | Pinto MM,Santos NF, Amaral A. Current status of biodosimetry based on standard cytogenetic methods[J]. Radiat Environ Biophys,2010, 49(4): 567-581.DOI: 10.1007/s00411-010-0311-3. |
| [6] | Brown KR, Rzucidlo E. Acute and chronic radiation injury[J]. J Vase Surg, 2011,53(1 Suppl):15S-21S.DOI: 10.1016/j.jvs.2010.06.175. |
| [7] | Liu Y, Ghesani NV, Zuckier LS. Physiology and pathophysiology of incidental findings detected on FDG-PET scintigraphy[J]. Semin Nucl Med,2010,40(4):294-315.DOI: 10.1053/j.semnuclmed.2010.02.002. |
| [8] | Wu SJ, Wang YJ, Guo KY, et al. Effect of total body X-ray irradiation on lymph node in Tibet minipig[J]. J Radiat Res,2012,53(1): 18-23.DOI: 10.1269/jrr.11077. |
 2016, Vol. 36
2016, Vol. 36


