2. 100850 北京, 军事医学科学院附属医院
The Affiliated Hospital of Military Medical Sciences, Beijing 100850, China
在核与辐射事故发生早期,对疑似受照人员进行快速分类诊断对于事故救援具有重要意义。目前,得到认可和应用的生物剂量估算方法主要是以染色体畸变分析为代表的细胞遗传学方法,虽然稳定性好,准确性高,但分析时间较长,工作量大[1]。此外,染色体畸变分析作为辐射事故生物剂量计,主要应用于剂量分布较为均匀的急性照射,但许多辐射事故为局部非均匀照射,由于受照部位的淋巴细胞在血循环内迅速和未受照细胞相混合,使畸变量下降。因此,有必要找到一种对辐射敏感、特异,且对受照人员能够进行快速简便的分类诊断的生物标志物。
miRNA作为一种基因转录后调节因子,可参与辐射诱导DNA损伤的调节,同时引发其靶基因及其蛋白的相应变化,提示miRNA具有作为辐射生物标志物的特性[2, 3]。本研究在前期研究的基础上分析放射治疗患者血浆中miR-210-3p、miR-221-3p、miR-21-5p、miR-150-5p的表达水平的变化,为寻找新的非均匀辐射损伤的早期生物标记物进行初步探索。
1.患者资料:2015年7月至10月在解放军307医院经病理确诊为乳腺癌Ⅱ~Ⅲ期患者13例。年龄36~61岁,平均年龄52.2岁。其中,浸润性导管癌9例,黏液性癌1例,分型不明3例。人表皮生长因子受体2(HER2)阳性10例,阴性3例;雌激素受体(ER)阳性10例,阴性3例;孕激素受体(PR)阳性9例,阴性4例。所有患者放疗前均经过乳腺癌根治手术、化疗。术前均未接受过放化疗。术后1个月后行化疗,化疗结束3~5周开始放疗。采用常规放疗方案:照射部位均为患侧胸壁以及锁骨上淋巴结,总照射面积大于25 cm×25 cm;胸壁用电子线(β射线),能量为深度的3~4倍,锁骨上淋巴结用6 MV X射线;采用美国Varian公司23EX型电子直线加速器;1次/d,5次/周,2 Gy/次。分5次采血:放疗前(0 Gy)、放疗2、10、20、30 Gy后,每次治疗结束24 h后采血。放疗前所有患者血象正常。采血前所有患者均签署知情同意书,并通过中国疾病预防控制中心辐射防护与核安全医学所伦理委员会审查。
2.血浆miRNAs提取:乙二胺四乙酸二钾(EDTA-k2)抗凝真空采血管收集静脉血,用TRIzol LS试剂和miRNeasy试剂盒(德国Qiagen公司)提取所有样品血浆miRNAs,-80℃冻存备用。采用文献[4]方法确定本研究miRNA的提取效率:选择一名正常人的血浆制备成5个样品,每个样品取250 μl血浆提取miRNA,液相分离前分别加入不同浓度的syn-cel-miRNA-39(1 000、100、10、1 fmol),应用qRT-PCR检测分析syn-cel-miRNA-39的相对表达量,并绘制标准曲线,评估提取效率。
3.cDNA的合成:用TaqMan miRNA反转录试剂盒(美国ABI公司),以总miRNAs各2.0 μl为模板合成cDNA,反应体系包括:100 mmol/L dNTP 0.1 μl;反转录酶0.5 μl;10×反转录缓冲液0.75 μl;RNA酶抑制剂0.1 μl;miRNA反转录引物0.5 μl;DEPC水3.55 μl;miRNA 2.0 μl。反应条件:16℃ 30 min,42℃ 30 min,85℃ 5 min。
4.引物设计和合成:miRNA引物及探针由美国ABI公司TaqMan miRNA assays试剂盒提供,探针序列分别为: cel-miR-39: 5′ UCACCGGGUGUAAAUCAGCUUG 3′;has-miR-21-5p: 5′ UAGCUUAUCAGACUGAUGUUGA 3′;has-miR-210-3p: 5′ CUGUGCGUGUGACAGCGGCUGA 3′;has-miR-221-3p: 5′ AGCUACAUUGUCUGCUGGGUUUC 3′;has-miR-150-5p: 5′ UCUCCCAACCCUUGUACCAGUG 3′。
5.实时荧光定量PCR:应用TaqMan PCR system(美国ABI公司)在7500快速实时荧光PCR仪(美国ABI公司)检测miR-210-3p、miR-221-3p、miR-21-5p、miR-150-5p的表达水平。Real-time PCR反应:95℃,10 min预变性;95℃,15 s变性;60℃,1 min退火延伸,45个循环进行扩增,每个样品重复3次。本研究选择syn-cel-miR-39作为qRT-PCR实验的内参来标化实验数据,以0 Gy样本作为对照组,2、10、20、30 Gy样本作为实验组,按2-ΔΔCT法对目的基因进行相对定量,ΔCT=目的基因miRNA的平均CT值-syn-cel-mir-39的平均CT值,将所有组别的2-ΔCT值均除以对照组的2-ΔCT值得到2-ΔΔCT,2-ΔΔCT表示实验组目的基因表达相对于对照组变化的倍数。
6.统计学处理:采用SPSS 19.0统计软件进行分析,所有数据均进行正态性检验(K-S检验)。非正态分布的计量资料以中位数(25百分位数,75百分位数)表示,两组之间采用Mann-Whitney U检验,多组间比较采用Kruskal-Wallis H检验。P <0.05为差异有统计学意义。对表达变化有差异的miRNA进行受试者特征曲线(ROC曲线)分析,并计算曲线下面积(AUC)、灵敏度和特异度,利用“尤登指数”计算临界值。
1.提取效率的评估:加入不同浓度syn-cel-miRNA-39(1 000、100、10、1 fmol)的5个样本所对应的平均CT值分别为15.204、20.384、23.827、28.107、31.645;syn-cel-miRNA-39浓度的对数值与相对应的CT值呈线性关系:y=-4.215x+28.203(R2=0.994),说明miRNA的提取效率和扩增效率基本一致。目的基因miR-210-3p、miR-221-3p、miR-21-5p、miR-150-5p在5个相同样本的平均CT值分别近似等于30.763、28.384、26.782、28.417。根据本实验结果,确定加入患者血浆中syn-cel-miRNA-39的浓度为200 fmol。
2.miRNA在照射前和不同剂量照射后的差异表达:结果见表 1。不同剂量(0、2、10、20、30 Gy)照射后,miR-210-3p、miR-221-3p、miR-21-5p的表达差异无统计学意义(P>0.05)。miR-150-5p 2 Gy照射后与照射前表达水平差异无统计学意义(P>0.05)。随着照射剂量的增加表达水平显著下调(χ2=18.76,P <0.05)。在HER2水平、ER水平、PR水平的阴性组和阳性组中,miR-150-5p表达差异均无统计学意义(P>0.05)。
| 表 1 不同剂量照射后患者血浆中miRNAs的表达情况 Table 1 miRNA expressions in patient plasma after radiotherapy of different doses |
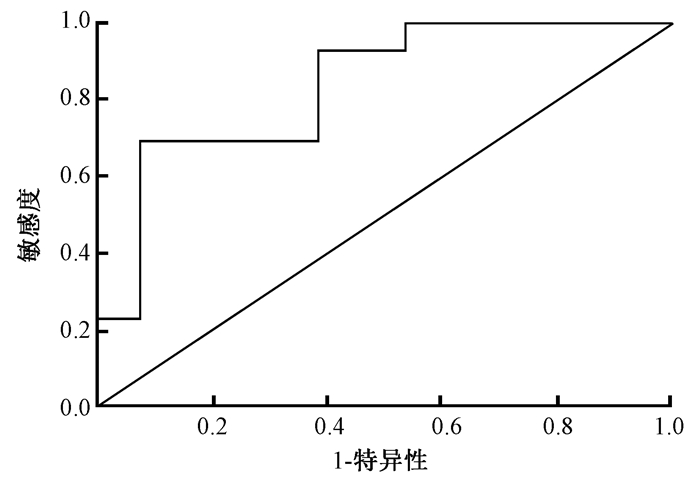
3.受试者特征曲线(ROC曲线)分析:将2与30 Gy照射后miR-150-5p表达的改变(2-ΔΔCT)进行ROC曲线分析,临界值为0.62(miR-150-5p下调的倍数),辐射剂量增加诱导miR-150-5p表达下调的敏感度为92%,特异性为62%,ROC曲线下面积为0.834,95%CI:0.676~0.992(P=0.003 8),见图 1。
|
图 1 miR-150-5p ROC曲线分析 Figure 1 ROC analysis of miR-150-5p expression |
电离辐射可以诱导一系列与DNA损伤相关的生物分子的改变,其中一种可能的机制是miRNA通过作用于DNA损伤相关基因参与调节辐射后DNA损伤[5]。早有研究证实电离辐射可诱导细胞中miRNA表达水平的变化[6],并且已在多种细胞系中(内皮细胞、胚胎干细胞、鳞状癌细胞、脑胶质瘤细胞等)得到验证[7]。目前的结论大多基于细胞或动物模型得出,照射模式一般为全身受照。而本研究选择早期乳腺癌放疗患者为研究对象,分析其外周血血浆中miRNA表达水平的变化。由于已有文献报道不同肿瘤组织中miRNA具有差异表达[8],因此本研究选择的样本均为分期较早,分型预后理想,放疗前行根治术及化疗,化疗后评估均达到无瘤生存状态,因此可模拟非均匀或局部辐射受照人员。Halimi等[9]关于乳腺癌放疗患者血浆中miR-21表达变化的研究也证实了选择此类样本的合理性,该研究选择了44例化疗后达到完全缓解(CR)的乳腺癌患者,同时选择20例健康志愿者作对照,发现患者术前血浆中miR-21的表达较正常人群高,而化疗结束5周后与正常人群无显著差异。
本研究的样本数量偏小,而且也不符合正态分布,因此采用秩和检验。研究发现与对照组相比(0 Gy),miR-150-5p单次照射(2 Gy)后表达水平没有显著变化,但随着照射剂量增加,其表达水平显著下调,分别为照射前的0.808、0.605、0.565。受试者特征曲线(ROC曲线)分析显示,miR-150-5p的表达改变与照射剂量增加有关。而miR-210-3p、miR-221-3p、miR-21-5p的表达水平在照射前后并没有明显改变。
miR-21和miR-221为致癌性miRNA,在多种肿瘤中异常高表达。Anastasov等[10]分别将两种不同的乳腺癌细胞系照射5 Gy后在不同的时间点分析miR-21的表达水平,发现8 h后其表达水平出现不同程度的上调;在孙凯等[11]关于结直肠癌细胞的研究中发现,X射线照射可以上调细胞中miR-221的表达,并且在一定范围内(0~8 Gy)呈剂量依赖性关系;在Templin等[12]关于放疗患者外周血细胞中miRNA表达改变的研究中,选择8例行1.25 Gy X射线全身照射患者,在照射后4 h取外周血淋巴细胞,发现miR-221与miR-21均表达上调,分别为照射前的3~3.4倍。在本研究中并没有得到与上述研究相类似的结论,其主要原因可能是本研究为局部照射,全身等效剂量尚不足以引起血浆中miR-21与miR-221表达的变化,也有可能因为细胞中miRNA对辐射的灵敏度较高而血浆中miRNA表达相对稳定。Halimi等[9]研究分析局部分次照射50 Gy后的乳腺癌患者外周血血清中miR-21的表达变化,发现其表达水平显著增加,而本研究中最高累积剂量为30 Gy,增大剂量是否会得到相同结果尚需进一步验证。
miR-210是目前一致公认的在乏氧的正常或肿瘤细胞中表达变化最显著的miRNA,分次放疗会引起肿瘤和周围正常组织乏氧,因此推断miR-210的表达可能会存在辐射效应关系,但本研究这一猜想未得到证实。目前关于miR-210与电离辐射关系的研究报道很少,但已有不少研究证实miR-210表达的改变可以调节细胞或组织的放射敏感性[13],因此电离辐射是否会影响miR-210的表达需要进一步研究。
miR-150在淋巴细胞和骨髓细胞生成的过程中起重要的调节作用,很多研究发现其异常表达很可能是血液系统恶性肿瘤的发病机制之一[14]。在Acharya等[15]的研究中发现小鼠在接受全身照射后,其外周血血清中miR-150的表达水平降低,此外,Jacob等[16]的研究不但发现miR-150表达下调,而且发现其表达还存在很好的剂量-效应关系,给予小鼠全身剂量1、2、4、6、8 Gy后24 h,miR-150表达水平分别为照射前的0.7、0.62、0.52、0.3、0.28。本研究的结论与上述研究基本一致,而单次照射后并未发现miR-150的表达下调,其原因可能是2 Gy局部照射剂量的全身等效剂量很小,尚不能引起外周血血浆中miRNA的表达改变。
本研究样本量较小,所以并未根据年龄分组,但已有研究表明,小鼠受电离辐射后血清中miR-34a的表达幼鼠比成年鼠上调量大[17];此外,HER2水平可能会调节乳腺癌细胞miRNA的表达[18],但本研究并没有发现阳性组与阴性组miRNA表达的不同。
综上所述,在本研究所选的4个miRNA中,电离辐射可诱导miR-150表达显著下调,且存在一定的剂量-效应关系,可能具有作为非均匀辐射致损伤早期标记物的潜在价值,但如何真正应用于临床诊断还需要进一步深入研究。
利益冲突 本研究进行“放射治疗对乳腺癌患者血浆中microRNAs表达的影响”相关研究,本人与本人家属、其他研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证 作者贡献声明 刘佳设计研究方案,进行实验,收集数据后统计并起草论文;高刚、朴春南、刘建香指导监督实验进行,修改论文;吴世凯协助提供符合入组病例,分析解释样本资料| [1] | Fenech M. Current Status, new Frontiers and challenges in radiation biodosimetry using cytogenetic, transcriptomic and proteomic technologies[J]. Radiat Meas, 2011, 46(9):737-741. |
| [2] | Mao A, Liu Y, Zhang H, et al. microRNA expression and biogenesis in cellular response to ionizing radiation[J]. DNA Cell Biol, 2014,33(10):667-679. DOI: 10.1089/dna.2014.2401. |
| [3] | Halimi M, Asghari SM, Sariri R, et al. Cellular response to ionizing radiation: A microRNA story[J]. Int J Mol Cell Med, 2012,1(4):178-184. |
| [4] | Zhu W, Qin W, Atasoy U, et al. Circulating microRNAs in breast cancer and healthy subjects[J]. BMC Res Notes, 2009,2:89. DOI: 10.1186/1756-0500-2-89. |
| [5] | Kraemer A, Anastasov N, Angermeier M, et al. MicroRNA-mediated processes are essential for the cellular radiation response[J]. Radiat Res, 2011,176(5):575-586.DOI:10.2307/41318226. |
| [6] | Cha HJ, Shin S, Yoo H, et al. Identification of ionizing radiation-responsive microRNAs in the IM9 human B lymphoblastic cell line[J]. Int J Oncol, 2009,34(6):1661-1668.DOI:10.3892/ijo_00000297. |
| [7] | Niemoeller OM, Niyazi M, Corradini S, et al. MicroRNA expression profiles in human cancer cells after ionizing radiation[J]. Radiat Oncol, 2011,6:29. DOI: 10.1186/1748-717X-6-29. |
| [8] | Mitchell PS, Parkin RK, Kroh EM, et al. Circulating microRNAs as stable blood-based markers for cancer detection[J]. Proc Natl Acad Sci USA, 2008,105(30):10513-10518. DOI: 10.1073/pnas.0804549105. |
| [9] | Halimi M, Parsian H, Asghari SM, et al. Clinical translation of human microRNA 21 as a potential biomarker for exposure to ionizing radiation[J]. Transl Res, 2014,163(6):578-584. DOI: 10.1016/j.trsl.2014.01.009. |
| [10] | Anastasov N, Höfig I, Vasconcellos IG, et al. Radiation resistance due to high expression of miR-21 and G2/M checkpoint arrest in breast cancer cells[J]. Radiat Oncol, 2012,7:206. DOI: 10.1186/1748-717X-7-206. |
| [11] | 孙凯, 张晓槟, 邓海军, 等. X线辐射剂量对结直肠癌细胞中microRNA-221和p57kip2表达的影响[J].肿瘤防治研究,2013,40(10):921-924. DOI: 10.3971/j.issn.1000-8578.2013.10.002. Sun K, Zhang XB, Deng HJ, et al. Effects of X-ray dose on expression of microRNA-221 and p57kip2 in human colorectal carcinoma cells[J].Cancer Res Prev Treat,2013,40(10):921-924. DOI: 10.3971/j.issn.1000-8578.2013.10.002. |
| [12] | Templin T, Paul S, Amundson SA, et al. Radiation-induced micro-RNA expression changes in peripheral blood cells of radiotherapy patients[J]. Int J Radiat Oncol Biol Phys, 2011,80(2):549-557. DOI: 10.1016/j.ijrobp.2010.12.061. |
| [13] | Yang W, Sun T, Cao J, et al. Downregulation of miR-210 expression inhibits proliferation, induces apoptosis and enhances radiosensitivity in hypoxic human hepatoma cells in vitro[J]. Exp Cell Res, 2012,318(8):944-954. DOI: 10.1016/j.yexcr.2012.02.010. |
| [14] | He Y, Jiang X, Chen J. The role of miR-150 in normal and malignant hematopoiesis[J]. Oncogene, 2014,33(30):3887-3893. DOI: 10.1038/onc.2013.346. |
| [15] | Acharya SS, Fendler W, Watson J, et al. Serum microRNAs are early indicators of survival after radiation-induced hematopoietic injury[J]. Sci Transl Med, 2015,7(287):287ra69. DOI: 10.1126/scitranslmed.aaa6593. |
| [16] | Jacob NK, Cooley JV, Yee TN, et al. Identification of sensitive serum microRNA biomarkers for radiation biodosimetry[J]. PLoS One, 2013,8(2):e57603. DOI: 10.1371/journal.pone.0057603. |
| [17] | Liu C, Zhou C, Gao F, et al. MiR-34a in age and tissue related radio-sensitivity and serum miR-34a as a novel indicator of radiation injury[J]. Int J Biol Sci, 2011,7(2):221-233. |
| [18] | Huang TH, Wu F, Loeb GB, et al. Up-regulation of miR-21 by HER2/neu signaling promotes cell invasion[J]. J Biol Chem, 2009,284(27):18515-18524. DOI: 10.1074/jbc.M109.006676. |
 2016, Vol. 36
2016, Vol. 36


