适应性反应(adaptive response)是指预先给予细胞或机体低剂量辐射(诱导剂量conditioning dose)刺激,使细胞或机体在一定时间间隔内对随后大剂量辐射(攻击剂量,challenging dose)产生的抗性或保护作用。适应性反应的主要表现形式包括细胞遗传损伤、基因突变、细胞存活以及DNA甲基化等生物学终点[1, 2, 3]。近年来,有研究表明,在相同照射剂量下,细胞组学指标核质桥(nucleoplasmic bridge,NPB)与双着丝粒染色体和着丝粒环的频率呈正相关[4],淋巴细胞核质桥在一定剂量范围内与吸收剂量呈现较好的线性关系,有可能成为新的电离辐射生物标志物[5]。本研究是以NPB为主要指标,试图探究电离辐射诱导人外周血淋巴细胞的适应性反应的是否发生及诱导剂量范围。
1.研究对象及血样采集:供血者为健康成年男性,26岁,无重大疾病史、无化学毒物接触史,采样前3个月未接受电离辐射。在知情同意情况下,抽取14 ml外周静脉血并立即注入肝素抗凝管中。本研究通过中国疾病预防控制中心辐射防护与核安全医学所伦理委员会的审查。
2.血液样品照射:将受试者血液平均分成14份,室温下用60Co γ射线进行照射,剂量分别0、20、50、75、100、150和200 mGy,照射源由中国计量科学研究院提供,放射性活度为9.25×1012 Bq,吸收剂量率为25 mGy/min,照射野直径为99.3 mm,源靶距为1.24 m。照射后置于37℃温箱培养,6 h后再进行2 Gy照射,照射源由北京市辐照中心提供,放射性活度为3.7×1014 Bq,吸收剂量率为1 Gy/min,源靶距为1.15 m。样品受照后置于37℃温箱中修复2 h。
3.细胞培养、收获与制片:取0.4 ml外周血加入到2 ml含有20%胎牛血清及0.2 %植物血凝素(PHA)的培养基中。在37℃的温箱中培育44 h后,加入终浓度为10 μg/ml的松胞素B,混匀后继续避光培养24 h(总培养时间为68 h)后收获。吸取上清后,加入0.075 mol/L低渗液,用吸管吹打均匀。用固定液(甲醇∶乙酸=3∶1)固定两次,每次20 min。最后将细胞悬液吸入1.5 ml的EP管中。常温下滴片,姬姆萨染色,将玻片编号。
4.阅片:盲法阅片。在光学显微镜下(放大400或1 000倍)每个剂量点观察3 000个双核细胞,记录含有一个或多个核质桥或微核(MN)细胞的坐标。双核细胞、NPB及MN的判断标准严格按照Fenech的标准[6]。
5.统计学处理:数据结果用x± s 表示。采用SPSS 19.0软件进行分析,所观察NPB及MN均符合泊松分布,各组间数目差异用U检验。P < 0.05为差异有统计学意义。
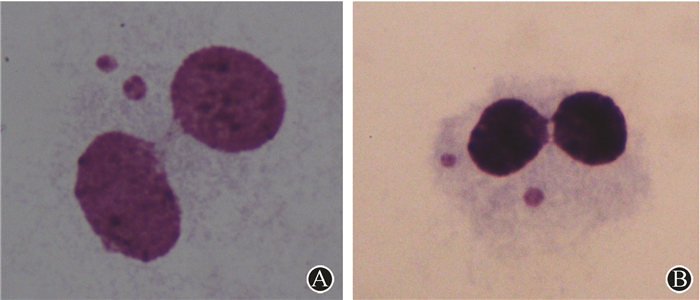
1.NPB形态学特征:NPB是双核细胞中两个细胞核之间的桥状连接,其宽度应小于主核直径的1/4,染色特性与主核一致,见图 1。本研究中在0~200 mGy低剂量范围内,每个细胞中观察到的NPB为0或1个。在单独2 Gy、诱导剂量后2 Gy照射的每个细胞中观察到的NPB为0~3个。
|
图 1 60Co γ射线诱导人外周血淋巴细胞中的核质桥及微核 姬姆萨染色×1 000 A. 双核细胞中有1个核质桥并伴有2个微核;B. 双核细胞中有3个核质桥并伴有2个微核 Figure 1 NPBs and MNs in human peripheral blood lymphocytes irradiated with 60Co γ-rays. The cells were stained with Giemsa and observed under a microscopy ×1 000 A. Binucleated lymphocyte with one NPB and two MNs;B. Binucleated lymphocyte with three NPBs and two MNs |
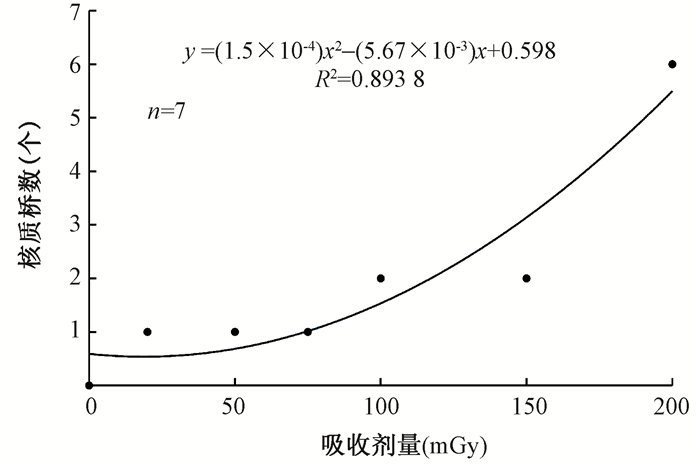
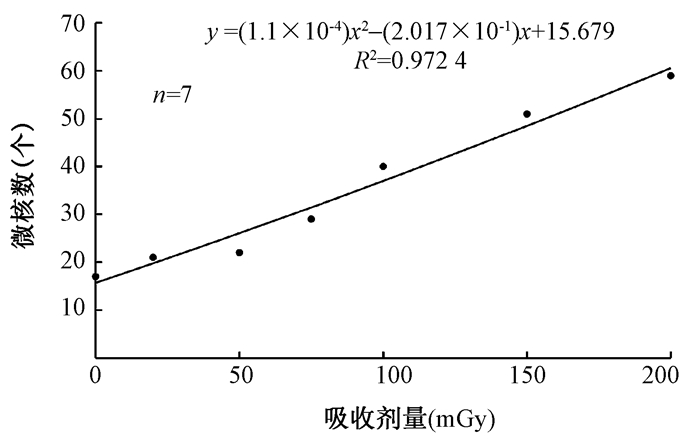
2.低剂量γ射线诱导的NPB和MN发生情况:用20、50、75、100、150和200 mGy分别照射外周血,胞质分裂阻滞(CBMN)法制备标本,光学显微镜下每个剂量点观察3 000个细胞,发现NPB和MN数目都随照射剂量的增大而增多,并且与吸收剂量符合线性平方关系,可拟合出剂量效应曲线,如图 2,图 3。NPB数目与吸收剂量间的剂量-效应关系符合线性平方模型,可拟合回归方程为y=(1.5×10-4)x2-(5.67×10-3)x+0.598(R2=0.893 8),其中x为吸收剂量,mGy;y为所观察的3 000个双核细胞中NPB的数目。MN数目与吸收剂量间的剂量-效应关系也符合线性平方模型,可拟合回归方程为:y=(1.1×10-4)x2+(2.017×10-1)x+15.679(R2=0.972 4),其中x为吸收剂量,mGy;y为所观察的3 000个双核细胞中MN的数目。
|
图 2 0~200 mGy 60Co γ射线诱导的人外周血双核淋巴细胞中核质桥剂量-效应曲线 Figure 2 Dose-response curve of the NPB yield in binucleated lymphocytes after 60Co γ-ray irradiation with an absorbed dose from 0 to 200 mGy |
|
图 3 0~200 mGy 60Co γ射线诱导的人外周血双核淋巴细胞中微核剂量-效应曲线 Figure 3 Dose-response curve of the MN yield in binucleated lymphocytes after 60Co γ-ray irradiation with an absorbed dose from 0 to 200 mGy |
3.低剂量γ射线诱导的人外周血淋巴细胞的适应性反应:当吸收剂量率为25 mGy/min时,诱导剂量在75~100 mGy范围内剂量可诱导适应性反应,表现为提前给予小剂量的诱导剂量可以减少随后大剂量照射产生的核质桥及微核数目。其中,100 mGy的诱导效果较明显,见表 1。
| 表 1 不同剂量60Co γ射线诱导人外周血淋巴细胞核质桥及微核数目 Table 1 The NPB and MN yields in binucleated lymphocytes with different absorbed doses of 60Co γ-rays |
随着工业及医疗卫生的发展,越来越多的人会在工作或生活中接触到较小剂量的电离辐射,相较于辐照事故中受到大剂量照射的人员数量较少,低剂量电离辐射在人群中更为常见,因此,低剂量的电离辐射逐渐引起人们的关注,这对受照人群的剂量估算和医疗救治有很大帮助。目前,对于低剂量辐射生物效应研究受到较多关注。低剂量辐射生物效应的研究涉及兴奋效应、适应性反应、旁效应等。
低剂量辐射诱导的适应性反应主要表现为:高本底地区人群染色体畸变率降低[7],减少细胞凋亡、增强细胞活性[2, 8],相关基因表达增强[9],减少基因突变[1, 10]、微核形成[11]等。目前,从遗传学角度来讲,研究较多的指标是染色体畸变和微核。
MN是分析细胞辐射损伤最常用的指标,其优点在于简单、便捷、对分析者要求较低,其缺点是易受性别、年龄等混杂因素的影响[12]。随着细胞组学的发展,核质桥逐渐用于染色体损伤标志物的分析[13]。NPB自发率较低[14, 15],受到电离辐射后会明显增多[4],显微镜下易于辨认。0~6 Gy范围内,NPB数目随吸收剂量的增加而增多,且具有较好的线性平方关系[5]。本研究首次以核质桥为指标,探究人外周血淋巴细胞的适应性反应。
在该研究中,观察0~200 mGy γ射线照射后核质桥数目,也可拟合出线性平方模型。在以往研究中,低剂量电离辐射诱发生物效应(如微核数目增多等)多与吸收剂量呈线性关系,但也有线性平方关系的相关研究[16]。在本研究中,因观察细胞数目偏少,拟合线性平方和模型效果远好于一般线性模型,因而选择了线性平方模型。若想获得与本实验室前期研究结果相似的曲线[17],还需增加观察的细胞数目。
有文献指出,以5 cGy的γ射线为诱导剂量,随后以2 Gy为攻击剂量,双核淋巴细胞中的微核数目比单纯受到攻击剂量的细胞明显减少[8]。当诱导剂量较大时,诱导剂量率应较低;同理,若诱导剂量较小,则剂量率较高才可诱导适应性反应。在本研究中,诱导剂量为25 mGy/min,20~200 mGy时,观察照后细胞可发现:提前给予人淋巴细胞20~150 mGy的诱导剂量可减少大剂量照射产生的NPB及MN数目,其中75~100 mGy减少效果较明显,与对照组(2 Gy)差异具有统计学意义,100 mGy的诱导效果最佳,可使核质桥减少幅度至43.2%。结果表明,低剂量电离辐射可诱导人外周血淋巴细胞核质桥的适应性反应,诱导剂量范围约为75~100 mGy。
本研究为电离辐射诱导的核质桥适应性反应的初步研究,确认该指标的适应性反应是存在的,但仍需要进一步系统研究。另外,本研究中分析细胞数相对较少,由于NPB自发率较低,若想在低剂量条件下拟合出效果较好的线性方程,应适当增加观察的双核细胞数目。
利益冲突 本人与本人家属、其他研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证 作者贡献声明 张梦凡设计研究方案,收集数据后统计并起草论文;赵骅、陆雪提供实验技术指导并协助数据统计;徐岩、封江彬采集样本;刘青杰负责论文修改及总体思路指导| [1] | Bao YZ, Chen HH, Hu YX, et al. Combination effects of chronic cadmium exposure and gamma-irradiation on the genotoxicity and cytotoxicity of peripheral blood lymphocytes and bone marrow cells in rats[J]. Mutat Res,2012,743(1-2):64-74. DOI:10.1016/j.mrgentox.2011.12.025. |
| [2] | Park HS, Seong KM, Kim JY, et al. Chronic low-dose radiation inhibits the cells death by cytotoxic high-dose radiation increasing the level of AKT and acinus proteins via NF-κB activation[J].Int J Radiat Biol,2013,89(5):371-377. DOI: 10.3109/09553002.2013.754560. |
| [3] | Ye S,Yuan DX,Xie YX,et al. Role of DNA methylation in long-term low-dose g-rays induced adaptive response in human B lymphoblast cells[J]. Int J Radiat Biol,2013,89(11):898-906. DOI:10.3109/09553002.2013.806832. |
| [4] | Thomas P,Umergaki K,Fenech M. Nucleoplasmic bridges are a sensitive measure of chromosome rearrangment in the cytokinesis-block micronucleus assay[J]. Mutagenesis,2003,18(2):187-194. DOI:10.1093/mutage/18.2.187. |
| [5] | Zhao H,Lu X,Li S,et al. Characteristics of nucleoplasmic bridges induced by 60Co γ-rays in human peripheral blood lymphocytes[J]. Mutagenesis,2013,29(1):49-55. DOI: 10.1093/mutage/get062. |
| [6] | Fenech M. The in vitro micronucleus technique[J]. Mutat Res,2000,455(1-2):81-95. DOI:10.1016/S0027-5107(00)00065-8. |
| [7] | 陈德清,戴连连,刘青杰,等. 阳江天然高本底辐射诱导人替淋巴细胞适应性反应[J]. 中华放射医学与防护杂志,1999,19(2):87-89. Chen DQ,Dai LL,Liu QJ,et al. Exposure to natural high background radiation in Yangjiang inducs adaptive response in human lymphocytes . Chin J Radiol Med Prot,1999,19(2):87-89. |
| [8] | Grdina DJ, Murley JS, Miller RC, et al. A survivin-associated adaptive response in radiation therapy[J]. Cancer Res, 2013,73(14):4418-4428. DOI: 10.1158/0008-5472.CAN-12-4640. |
| [9] | Cheng GH,Wu N,Jiang DF,et al. Increased level of p53 and PARP-1 in EL-4 cells probably releated with the immune adaptive response induced by low dose inozing radiation in vitro[J]. Biomed Environ Sci,2010,23(6):487-495. DOI: 10.1016/S0895-3988(11)60012-3. |
| [10] | Manesh SS,Sangsuwan T,Wojcik A,et al. Studies of adaptive response and mutation induction in MCF-10A cells following exposure to chronic or acute inoizing radiation[J]. Mutat Res,2015,780 : 55-59.DOI:10.1016/j.mrfmmm.2015.07.008. |
| [11] | Assadi N, Zabihi E, Khosravifarsani M, et al. Radioadaptive response in human lymphocyte cells[J]. Int J Mol Cell Med, 2014,3(1):57-60. |
| [12] | Fenech M. The advantages and disadvantages of the cytokinesis-block micronucleus method[J]. Mutat Res,1997,392(1-2):11-18. DOI:10.1016/S0165-1218(97)00041-4. |
| [13] | Fenech M. Cytokinesis-block micronucleus assay evolves into a "cytome" assay of chromosomal instability, mitotic dysfunction and cell death[J]. Mutat Res, 2006,600(1-2):58-66. DOI: 10.1016/j.mrfmmm.2006.05.028. |
| [14] | Donmez-Altuntas H, Bitgen N. Evaluation of the genotoxicity and cytotoxicity in the general population in Turkey by use of the cytokinesis-block micronucleus cytome assay[J]. Mutat Res, 2012,748(1-2):1-7. DOI: 10.1016/j.mrgentox.2012.05.013. |
| [15] | Nefic H,Handzic I. The effect of age,sex,and lifestyle factor on micronucleus frequency in peripheral blood lymphocytes of the Bosnian population[J]. Mutat Res,2013,753(1):1-11. DOI:10.1016/j.mrgentox.2013.03.001. |
| [16] | Jagetia GC, Ganapathi NG. Radiation-induced micronucleus formation in mouse bone marrow after low dose exposures[J]. Mutat Res, 1994,304(2):235-242.DOI:10.1016/0027-5107(94)90216-X. |
| [17] | Tian XL, Zhao H, Cai TJ, et al. Dose-effect relationships of nucleoplasmic bridges and complex nuclear anomalies in human peripheral lymphocytes exposed to 60Co γ-rays at a relatively low dose[J].Mutagenesis,2016,in press.DOI: 10.1093/mutage/gew001. |
 2016, Vol. 36
2016, Vol. 36


