放射治疗在脑部肿瘤治疗中起着不可替代的作用。在精确放疗时代,脑肿瘤周围正常组织不再接受较高剂量的照射,接受低剂量甚至超低剂量的区域不断增加,以往典型的放射性脑白质坏死与脱髓鞘改变的发生率明显下降,放疗引起的认知功能障碍逐渐成为研究的热点。目前,放疗引起的认知功能障碍的具体发生机制尚不十分清楚。研究表明,射线引起的海马区损伤与放疗后的认知功能障碍有密切关系[1]。
海马齿状回颗粒下层是大脑内终生产生新神经元的区域之一,新生的部分神经元与周围的神经元通过突起产生联系,并整合入神经环路中发挥传导神经信号的作用[2]。神经突起是神经元发挥功能最关键最直接的部位,神经突起结构的改变影响神经环路内信息传递,进而导致学习、记忆能力的下降。目前关于电离辐射对神经突起尤其是新生神经元树突结构的影响仍较少。本研究采用绿色荧光蛋白(GFP)-反转录病毒标记新生神经元,动态观察低剂量电离辐射对新生神经元树突结构的影响。
1.试剂: GFP-反转录病毒[和元生物技术(上海)有限公司],鸡抗GFP(英国Abcam公司),小鼠抗NeuN(美国Millipore公司),Alexa Fluor 488山羊抗鸡IgY(英国Abcam公司),Alexa Fluor 405驴抗小鼠IgG(美国Invitrogen公司)。
2.动物与分组:1月龄SPF级健康雄性SD大鼠(苏州大学动物实验中心提供),(100±10)g,按随机数字表法分为照射组和健康对照组,每组20只。实验动物操作均经过苏州大学实验动物伦理委员会通过。
3.照射条件:大鼠经3.6%水合氯醛溶液(360 mg/kg)腹腔注射麻醉后俯卧置于照射区域内,使用荷兰飞利浦SL-18型加速器全脑照射。使用4 MeV电子线,照射剂量为单次2 Gy,剂量率为210~220 cGy/min,源皮距为100 cm,具体照射技术与剂量测定参见文献[3]。
4.立体定向注射:照后24 h,大鼠经腹腔注射麻醉后置于大鼠脑立体定位仪上(美国Stoelting公司),消毒后沿中线切开头部皮肤暴露颅骨,清理干净颅骨表面,按照坐标(前囟点向后3.5 mm,旁开2.0 mm,深度3.6 mm)用微量进样器进行右侧海马立体定向注射GFP-反转录病毒1.5 μl,注射速率0.15 μl/min,病毒注射完毕留置微量进样器5 min。缝合皮肤并进行消毒后观察1 h,待大鼠活动正常后放回原饲养笼内。
5.切片及染色:照后2周、4周,两组大鼠均各取10只,经腹腔注射3.6%水合氯醛溶液麻醉后,相继用磷酸盐缓冲液(PBS)、4%多聚甲醛溶液进行心脏灌注。取出脑组织,置入4%多聚甲醛溶液中进行后固定,再经15%、30%蔗糖溶液梯度脱水后冷冻,切片,厚度为40 μm。每6张连续的脑片中选取1张脑片进行免疫荧光染色。切片经PBS漂洗3次,用胎牛血清封闭2 h,一抗孵育。24 h后,脑片经PBS漂洗3次,二抗孵育1 h后贴片。所用一抗为鸡抗GFP、小鼠抗NeuN,二抗为Alexa Fluor 488山羊抗鸡IgY、Alexa Fluor 405驴抗小鼠IgG。
6.图像采集与分析:使用激光共聚焦扫描显微镜(德国Leica公司TCS-SP2型)采集免疫荧光照片。新生神经元总数的计算方法为所选脑片新生神经元数量×6。Z轴方向每层扫描间隔区间为2 μm。将Z轴方向投射叠加的图片用软件Image J进行新生神经元树突复杂性的分析,所选的参数为:树突总长度、最长树突的长度和树突分支点数。
7.统计学处理:数据以x± s 表示。用GraphPad Prism 5.0软件进行统计分析,同一时间点两组间比较采用t检验。P <0.05为差异有统计学意义。
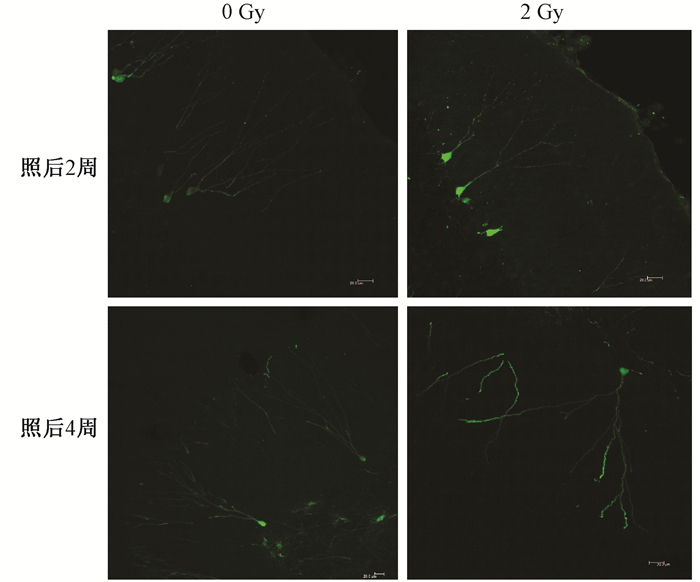
1.低剂量电离辐射后海马区新生神经元树突形态学特征的变化:全脑照射后大鼠海马区新生神经元树突的形态学变化特征见表 1,图 1。全脑照射后2周和4周,大鼠海马齿状回新生神经元树突的总长度及最长树突的长度较正常对照组相比均显著减少,差异有统计学意义(t=3.10、2.07、2.94、4.02,P <0.05)。全脑照射后2周,海马齿状回新生神经元树突分支点数与正常对照组相比明显减少(t=2.23,P <0.05),但是在照射后4周未观察到分支点数的明显变化。
| 表 1 2 Gy照射后不同时间大鼠海马区新生神经元树突形态学特征变化 Table 1 Morphological alteration of new born neurons in the rat hippocampus 2 weeks and 4 weeks after whole brain irradiation at a dose of 2 Gy |
|
图 1 2 Gy照射后不同时间各组大鼠海马区新生神经元形态学变化 免疫荧光染色 ×200 Figure 1 Morphological alteration of new born neurons in the rat hippocampus at different time points after 2 Gy irradiation Immunostaining image ×200 |
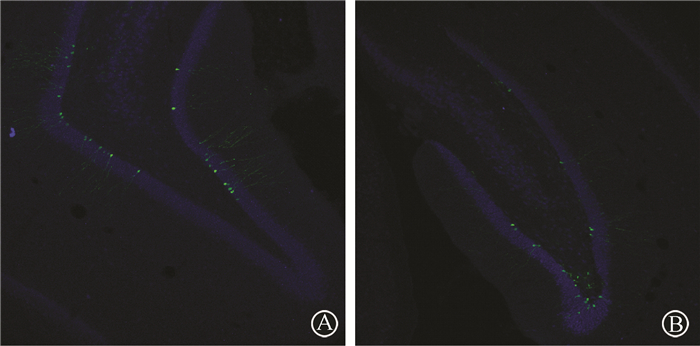
2.低剂量电离辐射后海马区新生神经元数量的变化:全脑照射后大鼠海马区新生神经元数量的改变见图 2。健康对照组2周、4周及照射组2周、4周海马区新生神经元数量分别为874.2±160.9、1 538.4±197.5和794.4±181.2、902.4±133.6。与同一时间健康对照组相比,照射后4周,大鼠海马齿状回新生神经元出现明显下降(t=8.43,P <0.05)。
|
注:绿色为GFP,蓝色为NeuN 图 2 2 Gy全脑照射后大鼠海马区新生神经元数量的变化免疫荧光染色 ×100 A.健康对照组照后4周; B.照射组照后4周 Figure 2 Numbers of new born neurons in the rat hippocampus after whole brain irradiation at a dose of 2 Gy Immunostaining image ×100 A. Sham control group 4 weeks after irradiation;B. Radiation group 4 weeks after irradiation |
本实验所用标记神经干细胞的病毒载体为反转录病毒,由于携带有GFP基因的反转录病毒载体的遗传缺陷特性,其需要将病毒基因整合至宿主细胞基因中才能复制,因而只有在立体定向注射时正在进行遗传物质复制(即处于分裂时期)的神经干细胞才能被反转录病毒转染。整合入神经干细胞的GFP基因表达绿色荧光蛋白,可在激发光照射下发出绿色荧光,但是在此条件下观察到的荧光相对较弱,通过抗GFP免疫荧光染色可以将此绿色荧光强度增强,利于进行神经元形态观察和分析。海马区存在神经干细胞并通过神经发生形成新的神经元,在成年人体海马中每天约有700个新生神经细胞生成[4]。GFP-反转录病毒将GFP基因整合入神经干细胞中,在神经干细胞向神经元的增殖分化过程中通过遗传物质的复制使新生神经元亦含有GFP基因。在被标记的细胞中GFP的表达可长达数月[5]。
电离辐射引起的认知功能障碍的确切发生机制目前尚不是十分清楚,被认为与之相关的因素有海马区神经发生受损,神经营养因子信号通路的改变以及神经系统的慢性炎症等[6]。随着放疗精度的提高,受到高剂量照射的大脑正常组织区域较之以往大为减少,肿瘤周围组织的受照剂量被控制在极低的范围。此前的大部分研究集中于较高剂量(≥5 Gy)电离辐射后认知功能障碍发生的机制。较高剂量照射后引起的海马区神经发生受损被认为是认知功能障碍发生的重要原因。但是有研究表明,在啮齿类动物模型中低剂量电离辐射也可以引发脑部持续的氧化应激状态以及认知功能障碍[7]。
中枢神经系统发挥功能依赖于精确连接的神经元网络。神经元通过神经突起及树突棘形成神经细胞周围的突触联系,从而形成神经信号环路传递动作电位。作为神经元之间突触形成的解剖学基础,树突决定着突触连接的数量和形式。神经元树突的改变可以进而影响神经系统的信号传导和信息处理能力。在阿尔茨海默病、亨廷顿病等许多病理情况下均可以观察到神经元树突结构的改变。在本研究中,借助立体定向注射技术利用GFP-反转录病毒转染幼年大鼠海马区处于增殖期的神经干、祖细胞,由此增殖分化而成的神经元也可以持续表达GFP,从而可以观察射线对新生神经元树突结构的影响[8]。
本实验结果表明,2 Gy全脑照射后2周和4周幼年大鼠海马区新生神经元树突的总长度、分支点数以及最长树突的长度均明显减少。此外,本实验观察到在低剂量照射情况下,海马区新生神经元的数量在照后4周出现明显下降。此前的许多研究均表明,较高剂量照射可以引起啮齿类动物海马区神经发生明显受到抑制[9, 10],这在射线所致认知功能障碍中占有重要地位。结合本实验研究结果推测,与高剂量照射情况不同,低剂量电离辐射后海马区齿状回神经元结构的改变与大鼠认知功能障碍的发生较之神经发生可能关系更为密切。
本研究使用神经科学研究中的立体定向注射GFP-反转录病毒技术更为形象直观地研究了电离辐射对大鼠海马区新生神经元树突结构的影响。但是在低剂量电离辐射所致大脑损伤的产生中,神经元结构的改变可能只是一个重要方面,有必要进行进一步研究,全面综合考虑氧化应激、神经系统炎症、神经营养因子等因素来阐明放射性脑损伤的具体发生机制。
利益冲突 本研究接受苏州市科技计划项目(SZS201509)资助,本人与本人家属、其他研究者,未接受其他机构提供的不当利益,在此对研究的独立性和科学性予以保证 作者贡献声明 张奇贤参与实验实施、整理数据、论文撰写;徐美玲、刘晓倩参与实验的实施;孙锐、田野负责提出研究思路、设计研究方案和论文修改| [1] | Greene-Schloesser D, Robbins ME. Radiation-induced cognitive impairment—from bench to bedside[J]. Neuro Oncol, 2012,14 Suppl 4:iv37-44. DOI: 10.1093/neuonc/nos196. |
| [2] | Espósito MS, Piatti VC, Laplagne DA, et al. Neuronal differentiation in the adult hippocampus recapitulates embryonic development[J]. J Neurosci, 2005,25(44):10074-10086. DOI: 10.1523/JNEUROSCI.3114-05.2005. |
| [3] | Tian Y, Shi Z, Yang S, et al. Changes in myelin basic protein and demyelination in the rat brain within 3 months of single 2-, 10-, or 30-Gy whole-brain radiation treatments[J]. J Neurosurg, 2008,109(5):881-888. DOI: 10.3171/JNS/2008/109/11/0881. |
| [4] | Spalding KL, Bergmann O, Alkass K, et al. Dynamics of hippocampal neurogenesis in adult humans[J]. Cell, 2013,153(6):1219-1227. DOI: 10.1016/j.cell.2013.05.002. |
| [5] | Zhao C, Teng EM, Summers RG, et al. Distinct morphological stages of dentate granule neuron maturation in the adult mouse hippocampus[J]. J Neurosci, 2006,26(1):3-11. DOI: 10.1523/JNEUROSCI.3648-05.2006. |
| [6] | Son Y, Yang M, Wang H, et al. Hippocampal dysfunctions caused by cranial irradiation: a review of the experimental evidence[J]. Brain Behav Immun, 2015,45:287-296. DOI: 10.1016/j.bbi.2015.01.007. |
| [7] | Tseng BP, Giedzinski E, Izadi A, et al. Functional consequences of radiation-induced oxidative stress in cultured neural stem cells and the brain exposed to charged particle irradiation[J]. Antioxid Redox Signal, 2014,20(9):1410-1422. DOI: 10.1089/ars.2012.5134. |
| [8] | van Praag H, Schinder AF, Christie BR, et al. Functional neurogenesis in the adult hippocampus[J]. Nature, 2002,415(6875):1030-1034. DOI: 10.1038/4151030a. |
| [9] | Kitamura T, Saitoh Y, Takashima N, et al. Adult neurogenesis modulates the hippocampus-dependent period of associative fear memory[J]. Cell, 2009,139(4):814-827. DOI: 10.1016/j.cell.2009.10.020. |
| [10] | Monje ML, Mizumatsu S, Fike JR, et al. Irradiation induces neural precursor-cell dysfunction[J]. Nat Med, 2002,8(9):955-962. DOI: 10.1038/nm749. |
 2016, Vol. 36
2016, Vol. 36


