中波紫外线(ultraviolet B,UVB)是指波长在280~320 nm的紫外辐射。虽然到达地球表面的紫外线中,UVB含量不到5%,但却是导致皮肤过度增生、炎症的重要因素。另外,UVB还可诱导辐射敏感基因表达改变,如miR-365、miR-21等,进而可能引起皮肤鳞癌的发生发展[1, 2]。由于工业生产过程的需要,相关职业人群接触UVB的频率越来越高,因此,研究UVB对细胞损伤的机制对于紫外辐射防护有重要意义。
研究表明,14-3-3σ基因是抑癌基因p53的下游靶基因,在DNA损伤诱导的细胞G2/M期阻滞过程中发挥重要作用,缺乏14-3-3σ会导致细胞的死亡[3]。前期研究发现,UVB能诱导HaCaT细胞14-3-3σ表达水平升高,为了进一步明确UVB诱导的14-3-3σ表达的改变是否会引起细胞增殖、周期等特性的变化,以及相关信号通路中功能蛋白的表达改变,本研究利用前期研究中已构建的14-3-3σ干扰HaCaT细胞(命名为HaCaTKD14-3-3σ细胞[4])来探索14-3-3σ在UVB诱导的HaCaT细胞辐射损伤中的作用。
1.主要试剂与设备:高糖DMEM培养液(美国GIBCO公司);新生牛血清(杭州四季青公司);胰蛋白酶(美国GIBCO公司);结晶紫(广州威佳生物公司);蛋白酶抑制剂(美国Roche公司);CCK-8试剂盒(北京TransGen Biotech公司);ECL显色液(德国Merck Millipore公司);细胞周期试剂盒(南京凯基生物公司);14-3-3σ单克隆抗体(德国Merck Millipore公司);周期蛋白相关蛋白抗体Cdc2、Cdc25c和Cyclin B1(德国Merck Millipore公司);核糖核酸酶(RNases A,美国Sigma公司);FACS guava流式细胞仪(德国Merck Millipore公司);细胞计数软件Adobe Photoshop CS3(美国Adobe公司);紫外照射源(上海顾村光电仪器厂)。
2.细胞来源与培养:人角质形成细胞HaCaT购自武汉典型培养物保藏中心(CCTCC)。稳定干扰细胞系HaCaTKD14-3-3σ由本实验室前期构建(详见参考文献[4])。正常HaCaT细胞培养在含体积分数为10%的新生牛血清、100 U/ml的青、链霉素双抗的DMEM培养液中,于37℃、体积分数为5%的CO2培养箱中常规培养,HaCaTKD细胞额外加入终浓度为100 μg/ml的Geneticin(G418)。
3.UVB照射:紫外光源波长为305 nm,样品与光源垂直距离40 cm时功率密度0.165 W/cm2。细胞接种于直径10 cm的培养皿中,待细胞长至70%~80%融合时,弃培养基,先用磷酸盐缓冲液(PBS)洗涤细胞2遍,然后加入5 ml PBS覆盖皿底,将培养皿放进紫外光源箱体指定位置照射,照完后弃PBS缓冲液并重新加入含体积分数10%新生牛血清的高糖DMEM培养液继续培养。
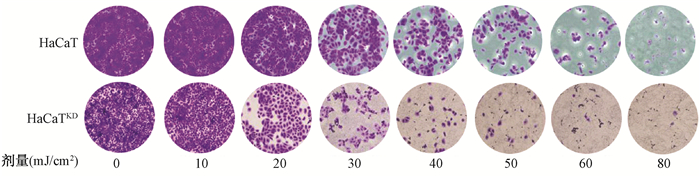
4.结晶紫染色:在3.5 cm的皿中,HaCaT细胞和HaCaTKD均按每皿3×105细胞接种,待HaCaT细胞长至70%~80%融合度时,两种细胞分别用0、10、20、30、40、50、60和80 mJ/cm2的剂量照射后48 h结晶紫染色,×200显微镜下随机拍照5个视野,计算平均细胞数,以未照组(0 mJ/cm2)为参照,实验重复3次。
5.CCK-8法检测细胞增殖:在96孔板中,HaCaT细胞和HaCaTKD按每孔接种8×103细胞,每孔100 μl的细胞悬液,培养24 h后UVB照射,分别在照后0、12、24、48和72 h时间点每孔加入10 μl的CCK-8溶液,继续培养2 h,测450 nm的吸光度(A450)值。实验重复3次。
6.PI单染检测细胞周期:HaCaT细胞和HaCaTKD按1×106细胞分别接种在6 cm皿中,在接种后0、6、12、18和24 h收集细胞,PI单染检测细胞周期。HaCaT细胞和HaCaTKD细胞按1×106细胞分别接种在6 cm皿中,待HaCaT细胞长至70%~80%融合度时,两组细胞分别接受30 mJ/cm2的UVB照射,在照后0、6、12、18和24 h收集细胞,PI单染检测细胞周期。PI单染检测细胞周期按试剂盒说明检测。实验重复3次。
7.Western blot蛋白检测:HaCaT细胞和HaCaTKD细胞按同种密度接种,待HaCaT细胞长至70%~80%融合度时,分别接受UVB照射。在照射后0、6、12、18和24 h收集细胞,提取细胞总蛋白。每孔加入20 μg蛋白,5%的浓缩胶和10%的分离胶进行电泳,并转移到聚偏二氟乙烯(PVDF)膜上,5%的脱脂奶粉室温封闭1 h,一抗4℃孵育过夜,TBST漂洗后用相应二抗室温孵育1 h,ECL发光试剂盒检测发光强度。实验重复3次。
8.统计学处理:结果以x± s 表示,采用SPSS 21.0软件分析。多个实验组与对照组均数的比较采用方差分析的Dunnett-t检验,两因素多时间点资料采用析因方差分析,两样本均数的比较采用独立样本t检验。P<0.05为差异有统计学意义。
1.不同剂量UVB照射后48 h HaCaT与HaCaTKD细胞密度的变化:结果见图 1,表 1。两种细胞的细胞密度均呈剂量依赖性下降(图 1)。由表 1可知,正常HaCaT细胞未照射与HaCaTKD细胞未照射相比,差异有统计学意义(t=10.58,P<0.05)。与未照射相比,正常HaCaT细胞在≥20 mJ/cm2照射后可出现显著抑制(t=19.18~46.91,P<0.05);HaCaTKD细胞中在≥10 mJ/cm2照射后即可出现显著抑制(t=8.83~49.63,P<0.05)。
|
图 1 不同剂量的UVB照后48 h HaCaT和HaCaTKD的细胞的汇合度 Figure 1 The confluence of HaCaT and HaCaTKD cells treated with different doses of UVB irradiation after 48 h incubation |
| 表 1 不同剂量的UVB照射后48 h HaCaT和HaCaTKD的细胞数 Table 1 The cells numbers after HaCaT, HaCaTKD cells being treated with different doses of UVB after 48 h |
2.未照射或30 mJ/cm2的UVB照射后HaCaT与HaCaTKD细胞增殖情况:经析因方差分析,正常HaCaT组和HaCaTKD组在不同时间点A值,分组和时间之间存在交互作用(F=2.98,P<0.05)。HaCaTKD细胞的增殖能力显著低于HaCaT细胞(F=32.89,P<0.01)。同一时间点对两组进行组间比较,除了48和72 h时间点HaCaT组值大于HaCaTKD组(F=9.47、11.85,P<0.05),其他时间点差异无统计学意义(P>0.05)。固定分组进行不同时间点比较,差异均有统计学意义(F=42.86、58.39,P<0.05),见表 2。
| 表 2 未照射的HaCaT和HaCaTKD细胞增殖情况 Table 2 The proliferation rates of HaCaT and HaCaTKD cells without irradiation |
照射后,经析因方差分析UVB+HaCaT组和UVB+HaCaTKD组在不同时间点A值的结果,分组和时间之间存在交互作用(F=31.33,P<0.05)。HaCaTKD细胞的增殖能力低于HaCaT细胞(F=269.5,P<0.05)。同一时间点对两组进行组间比较,除0 h外,其他时间点差异均有统计学意义(F=8.89、66.82、80.28、190.49,P<0.05)。固定分组进行不同时间点比较,差异均有统计学意义(F=28.85、10.23,P<0.05),见表 3。
| 表 3 30 mJ/cm2 UVB照射后HaCaT和HaCaTKD细胞增殖情况 Table 3 The proliferation of HaCaT, HaCaTKD cells treated with 30 mJ/cm2 UVB irradiation |
3.未照射和30 mJ/cm2 UVB照射后两组细胞培养不同时间G2/M期变化情况:见表 4,5。未照射情况下,HaCaT细胞中处于G2/M期的细胞在6 h开始升高,12 h出现一个峰值,18 h显著下降,且这3个点和0 h相比,差异均具有统计学意义(t=4.93、3.61、7.59,P<0.05),24 h回到0 h的水平,差异无统计学意义(P>0.05)。而HaCaTKD细胞各观察时间点与0 h相比,差异均无统计学意义(P>0.05)。
| 表 4 HaCaT和 HaCaTKD细胞分别培养不同时间细胞周期的分布情况 Table 4 Cell cycle distribution of HaCaT and HaCaTKD cells at different time points |
| 表 5 HaCaT和HaCaTKD细胞接受30 mJ/cm2UVB照射后不同时间点细胞周期的分布情况 Table 5 Cell cycle distribution of HaCaT and HaCaTKD cells at different time points after 30 mJ/cm2 UVB treatment |
UVB照射情况下,HaCaT细胞在照后6~18 h发生G2/M期细胞比例上升,与0 h相比,差异均有统计学意义(t=7.41、9.22、9.16,P<0.05);而HaCaTKD细胞在照后6 h时G2/M期短暂升高后逐渐下降,未见明显G2/M期阻滞作用(P>0.05)。
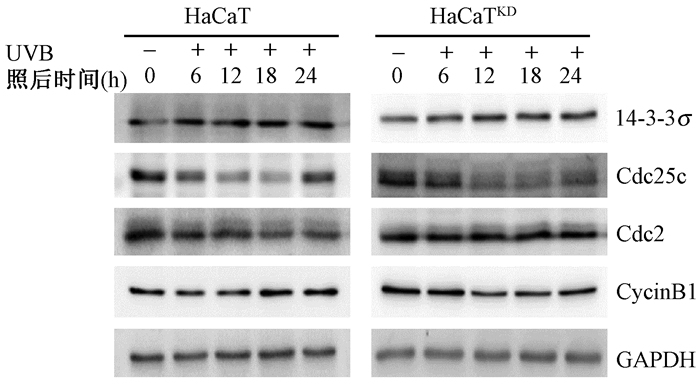
4.UVB照射后14-3-3σ及下游周期相关蛋白表达情况:结果见图 2。正常的HaCaT照后6、12、18、24 h与照射前比较,14-3-3σ表达量显著升高,Cdc2下调,24 h未见回升,Cdc25c、Cyclin B1下调,Cdc25c在24 h略有回升,Cyclin B1在18、24 h略有回升。在HaCaTKD细胞中,照后24 h与照射前比,14-3-3σ表达量升高较明显;照后12、18、24 h,Cdc25c、Cyclin B1下调,Cdc2表达量在各时间点无显著改变。
|
图 2 UVB照射后不同时间点HaCaT与HaCaTKD细胞中相关蛋白表达 Figure 2 The expression of proteins at different time points after HaCaT and HaCaTKD being irradiated with UVB |
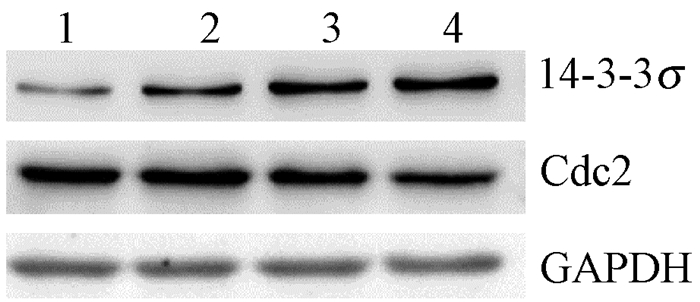
照射后24 h,HaCaTKD组、HaCaTKD+UVB组、HaCaT组与HaCaT+UVB组相比,HaCaTKD+UVB组的14-3-3σ表达量低于正常HaCaT组,HaCaTKD组与HaCaTKD+UVB组的Cdc2表达量不变,正常HaCaT组与HaCaT+UVB组的Cdc2表达量相对下降(图 3)。
|
注:1.HaCaTKD;2.HaCaTKD+UVB;3.HaCaT;4.HaCaT+UVB图3 两种细胞UVB照后24 h 14-3-3σ和Cdc2的表达 图 3 两种细胞UVB照后24 h 14-3-3σ和Cdc2的表达 Figure 3 The expression of 14-3-3σ and Cdc2 in four treatment groups at 24 h after UVB irradiation |
各种损伤引起细胞DNA破坏后,细胞一方面可通过启动凋亡信号通路诱导细胞凋亡,另一方面,不同细胞也可能会诱导周期阻滞,为DNA损伤修复提供条件[5]。14-3-3σ基因是抑癌基因p53的下游靶基因。研究发现,在DNA损伤诱导的细胞G2/M期阻滞中,14-3-3σ是发挥重要作用的蛋白之一,当缺乏14-3-3σ时,则会导致细胞增殖抑制,进而导致细胞死亡[6]。同时,14-3-3σ还可能通过bad和bcl-x的凋亡信号通路发挥抗凋亡作用[7]。本研究主要通过体外培养人角质形成细胞(HaCaT细胞),观察UVB辐射损伤后HaCaT细胞增殖、凋亡、周期等变化情况,并探讨14-3-3σ在其中发挥的作用。
结晶紫染色实验说明14-3-3σ的低表达能使细胞增殖能力下降,与CCK-8法观测的结果相一致。随着UVB照射剂量的增加,照后各组细胞的密度均呈剂量依赖性下降。HaCaTKD细胞10 mJ/cm2照射时就已经出现显著抑制,而正常HaCaT细胞在20 mJ/cm2照射时才可见显著抑制。CCK-8实验结果发现,在不经UVB照射的情况下,HaCaT细胞的增殖速率显著高于HaCaTKD细胞,因此,可以认为抑制14-3-3σ的表达会影响细胞增殖速率。进一步检测两组细胞在30 mJ/cm2的UVB照射后增殖情况发现,随着观察时间的延长,HaCaT细胞在照后24 h开始出现增殖,至72 h可达到照前的1.6倍。但UVB照后,HaCaTKD未见增殖,至72 h仍未见恢复,因此,可以认为14-3-3σ是影响增殖的重要基因,而它的缺失则可能导致HaCaT细胞对UVB辐射更加敏感。
细胞周期进程的改变是影响细胞增殖能力的因素之一,为明确HaCaTKD细胞的增殖抑制是否由细胞周期进程改变引起,本研究观察了两组细胞分别在不接受UVB照射和接受30 mJ/cm2的UVB照射后不同培养时间的细胞周期的分布情况。结果显示,未加UVB处理时,HaCaT细胞中处于G2/M期的细胞表现为先升高后恢复,这符合细胞增殖特性,但HaCaTKD细胞在接种的各个点,G2/M期的细胞均处于比较低的水平,即细胞未进入分裂期,与结晶紫及CCK-8实验的结果相一致,也和Vogel等[6]的研究结果相同。在接受UVB照射后,HaCaT细胞在6~18 h发生明显的G2/M期阻滞,而HaCaTKD细胞则未出现G2/M期阻滞。综合结晶紫、CCK-8和细胞周期的实验结果,可以推论,14-3-3σ是影响细胞增殖和细胞周期分布的关键因素之一,且其表达情况对HaCaT细胞接受UVB照射后的应答反应也发挥了重要作用。
Zhang等[8]指出,Cdc25c脱磷酸化激活Cdc2,进而激活MPF(Cdc2和Cyclin B1的复合体),促使细胞由G2期向M期转换。本研究中,观察到HaCaT和HaCaTKD细胞在UVB照后不同时间点的14-3-3σ及下游周期蛋白Cdc25c、Cyclin B1、Cdc2的差异表达,即HaCaT细胞中14-3-3σ在照后6 h即升高,并维持到24 h,伴随14-3-3σ升高,Cdc25c、Cyclin B1和Cdc2却自6 h明显下降,至24 h仅微弱恢复;HaCaTKD细胞在UVB照射后,14-3-3σ升高程度较弱,至24 h才升高较明显,Cdc2的表达无改变,Cdc25c和Cyclin B1表达的下降延迟到照后12 h,到24 h仍未见恢复。结合细胞周期的实验结果,可以推论UVB照射能诱导14-3-3σ的表达,从而下调Cdc2、Cdc25c和Cyclin B1的表达来诱导HaCaT细胞发生G2/M期阻滞,而下调14-3-3σ的表达,能解除其对Cdc2的抑制,并延迟Cdc25c和Cyclin B1的下调,从而解除G2/M期阻滞,诱导细胞发生凋亡或死亡。这和Gao等[9]研究的结果相一致,即DNA损伤后可诱导Cyclin B1的下降来影响周期的变化。但也有研究显示对Cdc25c在14-3-3σ诱导的G2/M期阻滞中的作用有相反的结果,Li等[10]、Ou等[11]、Telles等[12]认为是14-3-3蛋白家族中的其他亚型,而非14-3-3σ可调节Cdc25c的表达而发挥对细胞周期的作用。出现这种情况的原因可能是14-3-3σ在不同细胞中应答反应不同。
综上所述,UVB诱导的14-3-3σ的表达是HaCaT细胞对UVB辐射损伤应激的保护机制之一,其能通过抑制下游蛋白Cdc2、Cdc25c、Cyclin B1的表达诱导G2/M期阻滞以提高细胞存活率。
利益冲突 无利益冲突 作者贡献声明 黄海波为实验主要完成者;周良负责研究过程中指导;王同帅承担部分实验;周美娟提供课题思路、科研经费、实验技能指导| [1] | 周美娟,黄海波,林志祥,等. 紫外线B辐射敏感的miR-365在皮肤鳞癌发生中的作用研究[J].中华放射医学与防护杂志,2014,34(11):813-816. DOI:10.3760/cma.j.issn.0254-5098.2014.11.004. Zhou MJ, Huang HB, Lin ZX et al. The carcinogenic effect of UVB sensitive miR-365 in cutaneous squamous cell carcinoma[J]. Chin J Radiol Med Prot,2014,34(11):813-816. DOI:10.3760/cma.j.issn.0254-5098.2014.11.004. |
| [2] | 郭玲,吕超,何英杰. miR-21在UVB照射的人角质形成细胞和人表皮鳞癌细胞中的差异表达[J].中华放射医学与防护杂志,2010,30(6):674-676. DOI: 10.3760/cma.j.issn.0254-5098.2010.06.011. Guo L, Lv C, He YJ. Differential expression of miR-21 in UVB irradiated HaCaT cells and A431 cells[J]. Chin J Radiol Med Prot,2010,30(6):674-676. DOI: 10.3760/cma.j.issn.0254-5098.2010.06.011. |
| [3] | Meng L, Hsu JK, Tsai RY. GNL3L depletion destabilizes MDM2 and induces p53-dependent G2/M arrest.[J]. Oncogene, 2011, 30(14): 1716-1726. DOI:10.1038/onc.2010.550. |
| [4] | 周美娟,丁振华. 14-3-3σ干扰逆转录病毒载体的构建及其稳定转染HaCaT细胞系的建立[J]. 现代生物医学进展,2011,11(9):1601-1604. DOI:10.13241/j.cnki.pmb.2011.09.033. Zhou MJ, Ding ZH. Construction of RNAi recombinant retroviral vector of 14-3-3σ and its stably transfected HaCat cell lines[J]. Prog Modern Biomed,2011,11(9):1601-1604. DOI:10.13241/j.cnki.pmb.2011.09.033. |
| [5] | Ortolan TG, Menck CF. UVB-induced cell death signaling is associated with G1-S progression and transcription inhibition in primary human fibroblasts[J]. PLoS One, 2013,8(10):e76936. DOI:10.1371/journal.pone.0076936. |
| [6] | Vogel S, Herzinger T. The epithelium specific cell cycle regulator 14-3-3sigma is required for preventing entry into mitosis following ultraviolet B[J]. Photodermatol, 2013, 29(6):300-310. DOI:10.1111/phpp.12071. |
| [7] | Li YL, Liu L, Xiao Y, et al. 14-3-3σ is an independent prognostic biomarker for gastric cancer and is associated with apoptosis and proliferation in gastric cancer[J]. Oncol Lett, 2015, 9(1):290-294. DOI:10.3892/ol.2014.2676. |
| [8] | Zhang R, Loganathan S, Humphreys I, et al. Benzyl isothiocyanate-induced DNA damage causes G2/M cell cycle arrest and apoptosis in human pancreatic cancer cells[J]. J Nutr, 2006, 136(11):2728-2734. |
| [9] | Gao XL, Lin H, Zhao W, et al. JA, a new type of polyunsaturated fatty acid isolated from Juglans mandshurica Maxim, limits the survival and induces apoptosis of heptocarcinoma cells[J].Apoptosis, 2016,21(3):340-350. DOI: 10.1007/s10495-015-1202-5. |
| [10] | Li Z, Liu JY, Zhang JT. 14-3-3sigma,the double-edged sword of human cancers[J]. Am J Transl Res,2009, 1(4):326-340. |
| [11] | Ou TT, Wang CJ, Lee YS, et al. Gallic acid induces G2/M phase cell cycle arrest via regulating 14-3-3β release from Cdc25C and Chk2 activation in human bladder transitional carcinoma cells[J]. Mol Nutr Food Res, 2010, 54(12):1781-1790. DOI: 10.1002/mnfr.201000096. |
| [12] | Telles E, Hosing AS, Kundu ST. A novel pocket in 14-3-3 epsilon is required to mediate specific complex formation with cdc25C and to inhibit cell cycle progression upon activation of checkpoint pathways[J]. Exp Cell Res, 2009, 315(8):1448-1457. DOI:10.1016/j.yexcr.2009.01.018. |
 2016, Vol. 36
2016, Vol. 36


