室管膜瘤(ependymoma,EPs)是比较少见的中枢神经系统胶质瘤,可发生于成人和儿童,占颅内原发肿瘤的3%~9%[1, 2]。室管膜瘤多起源于脑室系统和脊髓中央管的室管膜细胞及其下的胶质上皮细胞。主要治疗手段是手术治疗,放射治疗是重要辅助手段,尤其对于肿瘤残存或间变性室管瘤患者,放射治疗是增加局部控制率的有效方法。本研究回顾性分析了本院收治的31例颅内室管膜瘤术后患者的临床特点和治疗转归,探讨预后影响因素。
1. 一般资料:2009年1月—2012年6月本院放疗、并经病理证实的初治颅内室管膜瘤31例,放疗前患者均行脊髓磁共振成像(MRI)或脑脊液检查排除播散。其中,男22例,女9例,年龄3~60岁(平均18岁)。18例发生于儿童(年龄<14岁)。中位随访51个月。患者术前KPS评分≥80者24例,60~80分者7例。按照世界卫生组织(WHO)病理分级标准,室管膜瘤Ⅱ级8例,Ⅲ级23例。按照室管膜瘤的手术切除程度,分为全切术(术后48 h内MRI复查结果提示Flair序列中异常信号完全切除)和次全切除术(术后48 h内MRI复查结果提示Flair序列中尚存残留病灶)两组;17例患者采用全切术,14例患者采用次全切除术。术后均行放射治疗,20例患者放疗剂量≤55 Gy,11例患者放疗剂量>55 Gy。2例患者放疗结束后1个月行化疗。术后主要并发症包括:肢体运动障碍3例,间断呕吐1例,语言功能障碍1例。
2. 放疗方法:患者平均于术后2个月内接受放疗,均行颅内病灶局部放疗。采用热塑头膜固定,荷兰Philips Brilliance BigBore 16排大孔径CT定位扫描,采用美国瓦里安公司生产的医用直线加速器(Varian 21 EX型 影像引导下调强放射治疗),放射源为高能6 MV X射线。采用3D-CRT治疗8例,IMRT治疗23例,每次照射1.8~2.0 Gy,每周5次,总剂量为48.6~60.0 Gy,平均剂量53.9 Gy。放疗的范围依据手术前后影像学MRI表现、术中所见、切除程度及病理诊断而定。肿瘤体积(GTV)为术前肿瘤侵犯的解剖区域和术后MRI信号异常区域,临床靶区(CTV)为GTV外扩10~20 mm安全边界。计划靶区体积(PTV)为CTV 外扩5 mm,95%的PTV等剂量线覆盖的靶体积定为处方参考剂量线。
3. 随访情况:放疗后每3个月(2年以内)或6个月(2 ~5年)规律性行头颅±全脊髓磁共振平扫加增强扫描,以随访评价。采用门诊及电话随访,随访时间从放疗结束之日开始计算,随访截至2015年6月30日,随访率100%,中位随访时间51个月。
4. 疗效观察指标:观察患者3和5年的疾病无进展时间、总生存时间及复发部位、放疗后不良反应等情况。疾病无进展时间定义为放疗结束至随访期间出现疾病复发或转移的时间,总生存时间定义为放疗结束至死亡的时间。
5. 统计学处理:采用SPSS 17.0软件进行分析,Kaplan-Meier法计算生存率并绘制生存曲线,Log-Rank法检验单因素生存率之间的差异,采用Cox比例风险模型,并用Forward∶Wald筛选法评估独立预后因素。P<0.05为差异有统计学意义。
1. 随访结果:7例患者术后放疗后复发,复发时间为6~47个月,平均40.5个月,5例为原位复发,2例发生全中枢播散; 其中,2例患儿复发后行第二次手术切除。随访中,死亡患者6例,4例为儿童第Ⅳ脑室间变性室管膜瘤患者,1例为成人左枕间变性室管膜瘤患者,1例为成人第Ⅳ脑室2级室管膜瘤患者。
2. 无进展生存及总生存情况:本组病例3和5年无进展生存率 (PFS)分别为 80.6%(24/31)、75.9%(23/31),3和5年总生存率 (OS) 分别为83.9% (25/31)、76.2%(24/31)。
3. 影响因素分析:Log-Rank检验单因素分析各临床特征与5年无进展生存率、5年总生存率的关系列于表 1。
| 表 1 单因素分析31例颅内室管膜瘤患者的临床特征与预后 Table 1 Univariate analysis of 31 cases intracranial EPs clinical charactors and prognoses |
根据手术切除程度,手术全切组(17/31)和次全切除组(14/31)的3年无进展生存率分别为94.1%和64.3%,差异具有统计学意义(χ2=4.685,P<0.05);手术全切组和次全切除组的3年总生存率分别为94.1%和71.4%,差异无统计学意义(χ2=2.973,P>0.05)。手术全切组和次全切除组的5年无进展生存率分别为90.9%和57.1%,两组比较差异具有统计学意义(χ2=6.311,P<0.05);手术全切组和次全切除组的5年总生存率分别为83.3%和64.3%,两组比较差异具有统计学意义(χ2=4.238,P=0.040),见表 2。
| 表 2 手术全切组和次全切除组患者3和5年PFS及OS(%) Table 2 Three-year and five-year PFS and OS (%) between GTR and STR patients |
4.放疗剂量对患者预后的影响:放疗剂量≤55 Gy(20/31)和>55 Gy(11/31)两组患者的3年无进展生存率分别为70.0%和100%(χ2=3.802,P>0.05),两组比较差异无统计学意义;两组患者的3年总生存率分别为75.0%和100%,差异无统计学意义(χ2=3.072,P>0.05)。放疗剂量≤55Gy和>55Gy两组患者的5年无进展生存率分别为64.2%和100.0%,两组比较差异有统计学意义(χ2=4.210,P<0.05)(图 1);两组患者的5年总生存率分别为65.6%和100.0%,两组比较差异无统计学意义(χ2=3.437,P>0.05)。
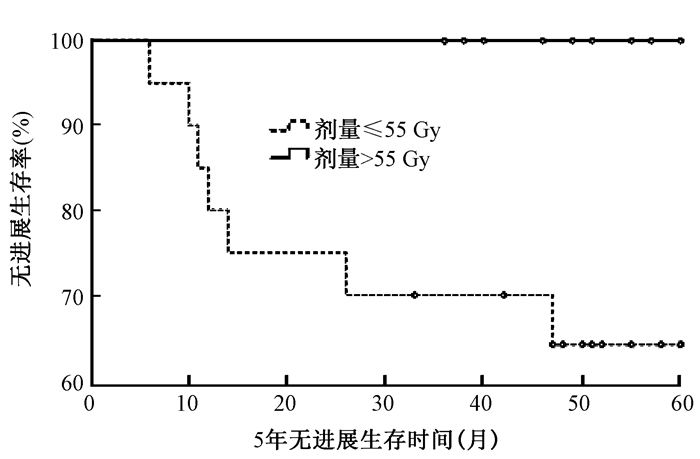
|
注:两组比较,χ2=4.210,P<0.05 图 1 两组患者不同放疗剂量照射后5年无进展生存率 Figure 1 Five-year PFS between two different radiotherapy dose groups |
Log-Rank检验分析结果显示,手术切除程度对3和5年无进展生存率及5年总生存率具有显著性影响,手术全切患者预后明显好于次全切除患者。放疗剂量≤55 Gy和>55 Gy两组患者的5年无进展生存率分别为64.2%和100.0%,两组差异有统计学意义(χ2=4.210,P<0.05)。性别、年龄(<14岁组和≥14岁组)、发病部位(幕上12例和幕下19例)、病理级别(8例2级EPs和23例3级EPs)、放疗方式(8例CRT和23例IMRT)、化疗(2例化疗)既不影响无进展生存率,也不影响总生存率。
5. 预后分析:根据本组Log-Rank单因素检验分析结果,将手术切除程度、放疗剂量2个影响预后的变量带入Cox比例风险模型进行多因素预后分析。结果显示手术切除程度、放疗剂量均不是影响此组病例生存时间的独立预后因素(表 3)。
| 表 3 31例颅内室管膜瘤患者预后的Cox比例风险模型分析 Table 3 Prognostic factors of 31cases intracranial EPs with Cox proportional hazards model |
室管膜瘤好发于男性,男女比例为1.2∶1。儿童与青少年以Ⅳ室及中脑导水管常见,成人则以脊髓内多见,均较少发生其他部位的种植转移。
室管膜瘤的治疗手段包括手术、放疗和化疗等组成的综合治疗。近年来,随着手术技术的提高、切除范围的扩大,放疗设备的进步、化疗方案的更新,室管膜瘤患者的预后得到了较大改善,但是室管膜瘤的治疗效果仍不理想。本研究中,总结室管膜瘤术后放疗患者的3年无进展生存率和总生存率及5年无进展生存率和总生存率,与以往的报道基本一致[3]。
为了延长室管膜瘤患者的生存时间,需要确定哪些因素会影响颅内室管膜瘤患者的预后,以帮助预测患者结局,并制定相应的治疗方案。据近年的研究报道,手术切除程度、病理级别、肿瘤部位、患者年龄、放疗及化疗的应用等因素可能影响室管膜瘤患者的预后[4, 5]。本研究对31例术后放疗后的颅内室管膜瘤患者进行随访,分析各临床因素和预后之间的相关性,为临床治疗提供参考。
手术是室管膜瘤的首选治疗方法。近年的病例分析表明,手术的切除程度是影响室管膜瘤预后最重要的因素[6],必要时可行二次手术,以达到完整切除。本组手术全切组与次全切除组的5年生存率,差异有统计学意义,与文献[5]报道一致。
近年的研究多倾向于认为低级别室管膜瘤预后优于间变性室管膜瘤患者[7, 8]。本组研究对象中,2级与3级室管膜瘤患者的5年生存率分别为87.5%和68.8%,存在一定差别,但差异无有统计学意义。值得注意的是,6例死亡患者中5例为间变性室管膜瘤。本研究未得出病理级别对预后影响的阳性结果,可能与样本量小有关。切除标本的大小、病理学范畴对间变定义的不同、将室管膜下瘤包括在内等因素,均可引起室管膜瘤病理级别范围和分级标准的差别,临床统计结果也表现出分歧。
肿瘤部位对室管膜瘤患者预后的影响,报道不一[9]。本组病例中,67.0%肿瘤来源于幕下,多位于第Ⅳ脑室,幕下患者与幕上患者的5年生存率分别为71.1%和91.7%,幕上患者的生存率高于幕下患者,但两组患者预后的差异无统计学意义。肿瘤的切除程度有时取决于肿瘤发生的部位。幕上室管膜瘤多位于侧脑室内和脑室旁的脑实质内,顶、额叶多见,一般能做到手术全切。幕下室管膜瘤多见于第Ⅳ脑室。由于紧邻脑干及多组颅神经,肿瘤生长易侵犯侧孔而与延髓、后组颅神经粘连,手术常难以切净,此处肿瘤残余是术后复发的常见原因。相反,也有报道幕上患者的预后较差,尤其是成人幕上肿瘤位于脑室外的患者[4],可能与幕上肿瘤临床病程较长、肿瘤体积大、病理级别高和播散转移机会较多有关。
目前,关于年龄对室管膜瘤患者预后影响的研究较少,尚无明确的结论。本研究对象年龄范围3~60岁(平均年龄18岁),其中18例发生于儿童(年龄<14岁)。儿童组与成人组5年无进展生存率分别为74.1%、76.9%,5年总生存率分别为66.7%、84.6%,差异无统计学意义。
术后辅助放疗明显提高室管膜瘤患者的局部控制率,提高总生存时间,是重要的辅助治疗手段。2013年美国国立综合癌症网络(NCCN)指南推荐中枢神经系统肿瘤3级室管膜瘤和未完全切除2级室管膜瘤患者术后行辅助放疗,放疗方式常规行局部放射治疗,放疗前脊髓MRI或脑脊液检查阳性的患者行全脑全脊髓照射。推荐颅内原发肿瘤局部剂量54.0~59.4 Gy,单次剂量1.8~2.0 Gy;脊髓播散患者行全脑全脊髓放疗,剂量为36.0 Gy,脊髓局部病灶加量至45 Gy,单次剂量1.8 Gy。本组研究对象照射总剂量为48.6~60.0 Gy,均为肿瘤局部照射,2例患者复发后行全脊髓照射36.0 Gy。放疗剂量≤55 Gy和>55 Gy两组患者的5年无进展生存率分别为64.7%和100%,Log-Rank检验分析提示差异有统计学意义(P<0.05);两组患者5年总生存率分别为65.6%和100%,差异无统计学意义(P>0.05)。
化疗在室管膜瘤中的疗效尚不肯定[10]。目前化疗主要用于年幼(<3岁)不宜行放疗者或复发患者,常用药物为替莫唑胺、长春新碱、顺铂、依托泊苷等。替莫唑胺作为高级别胶质瘤患者的辅助化疗药物,对室管膜瘤患者的临床获益尚缺乏明确的有利证据。
综上所述,本研究通过对31例颅内室管膜瘤术后放疗患者的预后分析,总结出手术切除程度和放疗剂量对颅内室管膜瘤患者预后具有显著性影响。手术切除程度是影响室管膜瘤预后的重要因素,术后放射治疗是重要辅助手段,尤其对于肿瘤残存或间变性室管瘤患者,高剂量的术后放射治疗是增加局部控制率的有效方法。
利益冲突 本研究进行颅内室管膜瘤术后放射治疗的预后分析,本人与本人家属、其他研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证 作者贡献说明 宋丽楠设计研究方案,收集数据后统计并起草论文;房彤指导、监督试验进行,修改论文;孙保锦负责进行试验,设计放疗计划;陈力、侯栋梁协助提供符合入组病例| [1] | Gurney JG, Smith MA, Bunin GR. CNS and miscellaneous intracranial and intraspinal neoplasms:NIH Pub. No. 99-4649. SEER Pediatr Monogr[R]. USA:National Institutes of Health, 2011(Chapter Ⅲ):61-74. |
| [2] | Armstrong TS, Vera-Bolanos E, Bekele BN, et al. Adult ependymal tumors:prognosis and the MD Anderson Cancer Center experience[J]. Neuro Oncol, 2010,12(8):862-870. DOI:10.1093/neuonc/noq009. |
| [3] | Chan MD, Mcmullen KP. Multidisciplinary management of intracranial ependymoma[J]. Curr Probl Cancer, 2012, 36(1):6-19.DOI:10.1016/j.currproblcancer.2011.10.013. |
| [4] | Sayegh ET, Aranda D, Kim JM, et al. Prognosis by tumor location in adults with intracranial ependymomas[J]. J Clin Neurosci, 2014, 21(12):2096-2101. DOI:10.1016/j.jocn.2014.05.011. |
| [5] | Swanson EL, Amdur RJ, Morris CG, et al. Intracranial ependymomas treated with radiotherapy:long-term results from a single institution[J]. J Neuro Oncol, 2010, 102(3):451-457. DOI:10.1007/s11060-010-0344-0. |
| [6] | Kim YJ, Kim JY, Lim DH, et al. Retrospective analysis of treatment outcome of pediatric ependymomas in Korea:analysis of Korean multi-institutional data[J]. J Neurooncol, 2013, 113(1):39-48. DOI:10.1007/s11060-013-1087-5. |
| [7] | Merchant TE, Jenkins JJ, Burger PC, et al. Influence of tumor grade on time to progression after irradiation for localized ependymoma in children[J]. Int J Radiat Oncol Biol Phys, 2002, 53(1):52-57. DOI:10.1016/s0360-3016(01)02801-2. |
| [8] | Jung JH, Choi W, Ahn SD, et al. Postoperative radiotherapy for ependymoma[J]. Radiat Oncol, 2012, 30(4):158-164. DOI:10.3857/roj.2012.30.4.158. |
| [9] | Timmermann B, Kortmann RD, Kuhl J, et al. Combined postoperative irradiation and chemotherapy for anaplastic ependymomas in childhood:results of the German prospective trials HIT 88/89 and HIT 91[J]. Int J Radiat Oncol Biol Phys, 2000,46(2):287-295. DOI:s0360-3016(99)00414-9. |
| [10] | Wright KD, Gajjar A. Current treatment options for pediatric and adult patients with ependymoma[J]. Curr Treat Options Oncol,2012,13(4):465-477. DOI:10.1007/s11864-012-0205-5. |
 2016, Vol. 36
2016, Vol. 36


