髓母细胞瘤是10岁以下儿童常见的颅内肿瘤,男女发病率的比例约为1.5~2 ∶1。髓母细胞瘤对放疗十分敏感,术后行全脑全脊髓放疗是髓母细胞瘤治疗的“金标准”。血液学不良反应是全脑全脊髓放疗过程中最常出现的,也是制约放疗能否连续进行的主要影响因素。本研究回顾性分析首都医科大学附属世纪坛医院放疗科自2011年1月至2014年1月行全脑全脊髓放疗的87例儿童髓母细胞瘤患者的临床及随访资料,探讨髓母细胞瘤患者放疗的血液学不良反应及影响预后的相关因素。
1.一般临床资料:87例髓母细瘤患者术后患者放疗前均未行化疗。其中男56例,女31例,男∶女=1.8∶1。年龄4~18岁,中位年龄8岁。临床及随访资料完整,放疗前复查肝肾功能和血常规均在正常范围内。放疗前患者均行全脑全脊髓磁共振成像(MRI)或脑脊液检查排除播散。全组病例均属于低风险组(年龄>3岁,术后局部残留肿瘤<1.5 cm3,病变局限于后颅窝无远处转移)。属于Chang′s M分期中的M0期。
2.放疗方法:所有病例均行全脑全脊髓放疗。患者均取俯卧位,采用额颏枕和体部垫板,全脑照射采用左右两侧野等中心对穿照射,下界在第4颈椎下缘水平,上界开放至颅骨外3 cm,每照射10 Gy,全脑照射野在y轴方向上、下各缩小1 cm。脊髓照射野采用俯卧位,电子线垂直照射,根据脊髓长度分上下两段,两段中间间隔1 cm,上界为全脑射野的下界,下界在骶4下缘水平,两侧外界在椎弓根的外缘,男性患者骶骨区域采用铲形野垂直照射,女性患者为保护卵巢骶骨区域采用等中心两侧水平对穿照射。脊髓野每照射10 Gy向头侧移动1 cm,并保持与全脑照射野有1 cm间隙。放疗剂量每周5次,每次1.7~1.8 Gy,全中枢照射30.6~36 Gy后缩野至后颅窝,加量照射至48.6~54 Gy,再次缩野至瘤床区,加量照射至55.8~56 Gy。
3.血液学不良反应评价标准及随访情况:放疗期间每2~3天复查血象,血液学不良反应按美国肿瘤放射治疗协作组(RTOG)早期放射反应标准评分进行评价。患者放疗结束后每3个月(2年以内)或6个月(2~5年)复查颅脑±全脊髓MRI。采用门诊随访及电话随访,随访时间从放疗结束之日开始计算,随访截止日期为2015年8月15日,随访率90%,中位随访时间30个月。
4.观察指标:记录患者在放疗期间的血液学不良反应分级,血液学不良反应分级标准参照RTOG急性放射损伤分级标准,并统计患者1、2、3年的总生存率(OS)和无进展生存率(PFS)。定义生存时间为患者手术至死亡或随访终止的时间。无进展生存时间定义为手术至随访终止或者出现疾病复发或转移的时间。
5.统计学处理:采用SPSS 20.0统计软件分析,Kaplan-Meier法计算生存率并绘制生存曲线,Log-Rank法检验单因素生存率之间的差异。P<0.05为差异有统计学意义。
1.血液学不良反应:所有患者行全脑全脊髓放疗期间均出现不同程度骨髓抑制(表 1)。其中90.8%的患者出现2~3级的白细胞下降,未见4级的白细胞下降。70.1%的患者出现1~2级的血小板下降,1.1%的患者出现3级的血小板下降。16.1%的患者出现1~2级的血红蛋白下降,未出现3~4级的血红蛋白下降。
| 表 1 87例患者全脑全脊髓放疗期间血液学不良反应分级 Table 1 Haematological toxicity for 87 patients treated with craniospinal irradiation |
2.随访和生存情况:截止到随访结束为止,87例患者中死亡11例,其中8例复发后死亡,从复发到死亡的时间间隔不超过2个月。2例行全脊髓MRI检查发现脊髓播散,化疗后目前带瘤生存,1例小脑复发后再次手术切除,目前生存良好。本研究中的1、2、3年OS分别为95%、92.4%和84.9%,PFS分别为93.7%、89.8%和80.8%(图 1~2)。
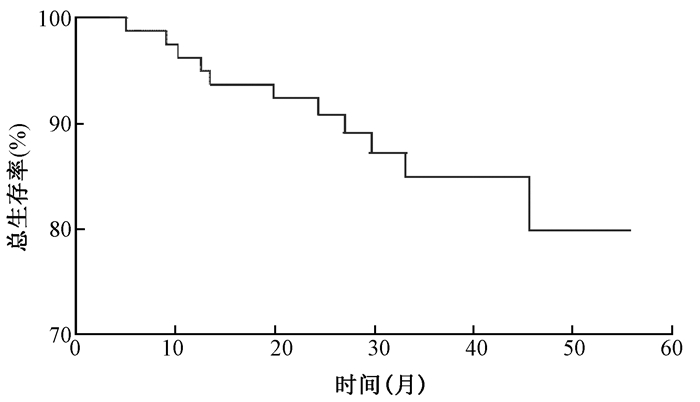 | 图 1 87例髓母细胞瘤术后全脑全脊髓放疗的3年总生存率 Figure 1 Three year-overall survival rate in 87 medulloblastoma patients treated with craniospinal irradiation |
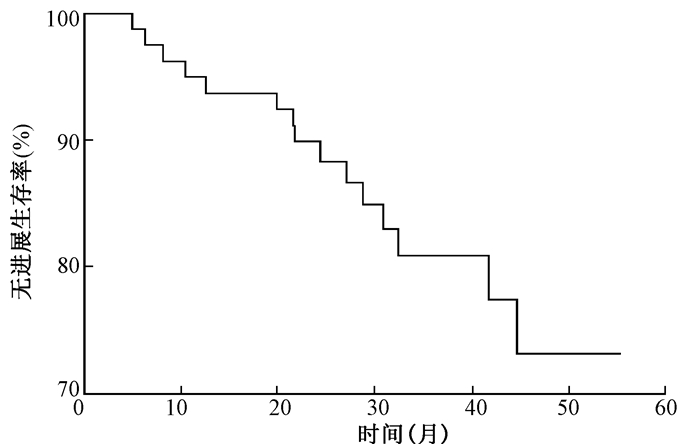 | 图 2 87例髓母细胞瘤术后全脑全脊髓放疗的3年无进展生存率 Figure 2 Three year-progression-free survival rate in 87 medulloblastoma patients treated with craniospinal irradiation |
3.不同影响因素对生存的影响:Log-Rank检验单因素分析各临床特征与3年OS和PFS的关系。
Log-Rank检验单因素分析显示:患者性别、年龄(<8岁或≥8岁)、肿瘤部位(小脑蚓部或四室)、手术到放疗的时间间隔(<60 d或≥60 d)、照射顺序(先行后颅窝照射或先行全中枢照射)和白细胞不良反应分级(0~2级或3~4级)对3年OS和PFS均没有影响。
放疗中断时间(<3 d或≥3 d)、血小板和血红蛋白不良反应分级对3年OS或PFS有一定的影响(P < 0.05,表 2)。
| 表 2 87例髓母细胞瘤术后全脑全脊髓放疗患者的预后影响因素 Table 2 Prognostic factors of 87 medulloblastoma patients treated with craniospinal irradiation |
全脑全脊髓放疗是治疗沿脑脊液或者脑膜播散倾向的中枢神经系统恶性肿瘤的重要手段,被广泛用于治疗髓母细胞瘤,生殖细胞瘤、松果体母细胞瘤和颅内原始神经外胚层肿瘤等恶性神经系统肿瘤。髓母细胞瘤是儿童后颅窝常见的中枢神经系统恶性肿瘤。约占儿童中枢神经系统肿瘤的20%~25%[1]。髓母细胞瘤恶性度高,由于主要位于第四脑室内和小脑蚓部,与脑干关系密切,手术不易完整切除,并且容易沿蛛网膜下腔播散[2],因此,术后行全脑全脊髓放疗和化疗是国内外公认的治疗髓母细胞瘤的“金标准”。
关于髓母细胞瘤术后全脑全脊髓放疗的远期不良反应,国际上已多有报道[3, 4, 5, 6],而对于行全脑全脊髓放疗期间的急性血液学不良反应以及对预后的影响,却鲜有报道。Jeffries等[7]于1998年首次报道了全脑全脊髓放疗的血液学不良反应,发现有33%的放疗患者出现3~4级的血液学不良反应,发生率在放疗开始第2周最高,单因素分析发现年龄、放疗前化疗、大剂量放疗与血液学不良反应相关。相比较成人,儿童的血液学不良反应发生率更高。本研究纳入的研究对象为18岁以下的儿童肿瘤患者,行全脑全脊髓放疗前未行任何药物化疗,放疗剂量在30.6~36.0 Gy之间。本研究发现,放疗对白细胞的影响最大,白细胞下降的发生率最高,但未出现4级的白细胞下降。其次为血小板,而对血红蛋白的影响相对较小。对于血液学不良反应出现的时间,放疗期间最早发生的是白细胞下降,大约放疗开始20 d左右即可出现。血小板发生降低的时间比白细胞降低的时间晚5~7 d。放疗对血红蛋白的影响较小,本研究组的所有病例在放疗前血红蛋白均在正常值范围内,放疗期间也未出现3~4级的血红蛋白下降,可能与红细胞的半衰期较长,短期内并不出现红细胞数量的明显减少及血红蛋白的明显变化。对本组患者进一步统计分析发现,年龄和放疗剂量并不影响血液学不良反应的分级,而性别与血小板的下降有关系,女性患者发生2级以上的血小板下降更常见。
虽然髓母细胞瘤患者行全脑全脊髓放疗期间的血液学不良反应比较常见,但是否会对生存率有影响,目前国内外还没有研究报道。本研究结果显示,放疗期间白细胞下降程度与3年的OS和PFS无关,而血小板分级在0~1级和2~4级的3年PFS差异具有统计学意义;血小板分级在0~1级和2~4级的3年OS差异无统计学意义。因此,放疗期间血小板低于75×109/L会影响患者3年的PFS,对3年OS没有影响。本研究结果同时提示,放疗期间血红蛋白下降的程度会对患者的3年OS和PFS产生影响,放疗期间血红蛋白低于110 g/L会降低3年OS和PFS。由于患者出现骨髓抑制,经常会导致放疗间断。本研究中全组患者放疗期间中断放疗的时间为0~16 d,中位时间为3 d。统计结果显示,中断时间 < 3 d和≥3 d的两组患者3年PFS比较差异具有统计学意义;3年OS比较差异无统计学意义。因此,放疗间断时间超过3 d,将会影响患者的3年PFS,而对3年OS无影响。
关于影响髓母细胞瘤预后的因素,目前已经确定的有:临床分期、术后残留肿瘤大小、放疗总剂量以及是否加用化疗[8];年龄、性别和原发肿瘤大小对预后影响尚存争议。del Charco等[9]认为延长手术到放疗的时间间隔对髓母细胞瘤的生存率有不利影响,而Back等[10]研究认为从手术到开始放疗的时间间隔并不影响患者的无复发生存率。本研究分析了手术到术后放疗的时间间隔对3年OS和PFS的影响,结果表明,手术与放疗间隔时间对髓母细胞瘤的3年OS和PFS不存在影响,可能与随访时间短有关系。在临床实际工作中,由于患者术后恢复的时间和程度不尽相同,部分患者术后短期内无法俯卧和制动,不能配合完成全脑全脊髓放疗,为避免延长手术到放疗的时间间隔给患者带来不利的影响,一般会进行1~2个周期的化疗。总之,手术到放疗的时间间隔对患者生存的影响还需要进一步的随机对照试验和更长的随访时间进行研究。
患者行全脑全脊髓放疗时,对年龄比较小,并且KPS评分 < 80的患者采取先行后颅窝照射,再行全脑全脊髓放疗,最后缩野到后颅窝瘤床区加量照射的放疗方式;而对于年龄比较大,或者一般状况比较好,KPS>80的患者采取先行全脑全脊髓放疗,再行后颅窝及瘤床区加量照射的放疗方式。本研究结果显示,以上两种放疗方式不会对患者的3年OS和PFS存在影响,并且患者的耐受性较好,不会出现比较严重的血液学不良反应。
利益冲突 本研究未受任何科研机构和任何企业任何形式的资助,所有研究者均未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证 作者贡献声明 侯栋梁设计研究方案,收集数据后统计并起草论文;房彤指导、监督研究工作;宋丽楠提供研究方法,协助进行研究设计;孙保锦、陈力指导研究思路,协助修改论文| [1] | Tabori U, Sung L, Hukin J, et al. Distinctive clinical course and pattern of relapse in adolescents with medulloblastoma[J]. Int J Radiat Oncol Biol Phys,2006,64(2):402-407. DOI:10.1016/j.ijrobp.2005.07.962. |
| [2] | Whelan HT, Krouwer HG, Schmidt MH, et al. Current therapy and new perspectives in the treatment of medulloblastoma[J].Pedatr Neurol,1998, 18(2):103-115.DOI:10.1016/S0887-8994(97)00221-X. |
| [3] | Halberg FE,Wara WM,Fippin LF,et al.Low-dose craniospinal radiation therapy for medulloblastoma[J].Int J Radiat Oncol Biol Phys,1991,20(4):651-654. DOI:10.1016/0360-3016(91)90004-N. |
| [4] | Heikens J, Michiels EM, Behrendt H, et al. Long-term neuro-endocrine sequelae after treatment for childhood medulloblastoma[J]. Eur J Cancer, 1998, 34(10):1592-1597. DOI:10.1016/S0959-8049(98)00212-3. |
| [5] | Maher CO, Raffel C. Early vasculopathy following radiation in a child with medulloblastoma[J]. Pediatr Neurosurg, 2000, 32(5):255-258. DOI:10.1159/000028947. |
| [6] | Merchant TE, Kun LE, Krasin MJ, et al.A multi-institution prospective trial of reduced-dose craniospinal irradiation (23.4 Gy) followed by conformal posterior fossa (36 Gy) and primary site irradiation (55.8 Gy) and dose-intensive chemotherapy for average-risk medulloblastoma[J].Int J Radiat Oncol Biol Phys, 2008,70(3):782-787. DOI:10.1016/j.ijrobp.2007.07.2342. |
| [7] | Jeffries S, Rajan B, Ashely S, et al. Haematological toxicity of cranio-spinal irradiation[J]. Radiother Oncol, 1998, 48(1):23-27. DOI:10.1016/S0167-8140(98)00024-3. |
| [8] | Derek J,Shabanah MA,Shail EA,et al.Prognostic factors for medulloblastoma[J].Int J Radiat Oncol Biol Phys, 2000,47(3):573-584.DOI:10.1016/S0360-3016(00)00431-4. |
| [9] | del Charco JO,Bolek TW,McCollough WM,et al.Medulloblastoma:time-dose relationship based on a 30-year review[J].Int J Radiat Oncol Biol Phys, 1998,42(1):147-154.DOI:10.1016/S0360-3016(98)00197-7. |
| [10] | Back M, Ahern V, Berry M, et al.Importance of radiation time and dose factors on outcome for childhood medulloblastoma[J]. Australas Radiol, 2005, 49(4):298-303. DOI:10.1111/j.1440-1673.2005.01468.x. |
 2016, Vol. 36
2016, Vol. 36


