放疗是食管癌主要的治疗方法,然而肿瘤细胞的辐射敏感性与放疗疗效密切相关。有研究认为肿瘤干细胞(cancer stem cell,CSC)在其中扮演着重要角色[1, 2],CSC对辐射产生抗性,使存活CSC再增殖,导致疗后肿瘤复发或远处转移。本实验采用无血清培养基(serum-free medium,SFM)富集食管癌干细胞(esophageal cancer stem cells,ECSC),并分析ECSC与普通肿瘤细胞辐射应答的差异,探讨ECSC的辐射抗性与相关蛋白表达的关系。
1. 主要试剂与仪器:人食管癌细胞系ECA109购自上海生物细胞库。RPMI 1640培养基、胎牛血清和胰酶购自美国GIBCO公司;表皮生长因子(epidermal growth factor,EGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)均购于美国PeproTech公司;B27购自美国Invitrogen公司;NS398购自美国Cayman公司;CD44-FITC流式抗体、CD271-PE-Cy7流式抗体、Bmi-1小鼠抗人单克隆抗体、c-Myc兔抗人单克隆抗体、兔抗人单克隆抗体Cyclin D1、辣根过氧化物酶标记山羊抗兔IgG(H+L)均购自美国Abcam公司;鼠抗β-catenin单克隆抗体、鼠抗β-肌动蛋白单克隆抗体均购自美国Santa Cruz公司;辣根过氧化物酶标记山羊抗小鼠IgG购自上海碧云天生物技术公司;德国西门子Primus-H型医用直线加速器。
2. 细胞培养和无血清培养:食管癌细胞系ECA109的贴壁细胞培养用含10%胎牛血清、100 U/ml青霉素及100 U/ml链霉素的RPMI 1640培养基。无血清培养基由RPMI 1640(1∶1)、B27(1∶50)、EGF(20 ng/ml)、bFGF(20 ng/ml)、胰岛素(5 μg/ml)、转铁蛋白(10 μg/ml)、0.5%BSA组成,培养方法同前期实验[3]。
3. 细胞表面标记物CD44+、CD271+的检测:收集培养3代以上的ECA109细胞球和亲本细胞,消化和机械吹打为单细胞悬液,离心半径 9 cm,1 000 r/min 离心3 min,PBS重悬,调整细胞密度为1×l06/100 μl,两组细胞分别加入鼠抗人CD44-FITC、CD271-PE-Cy7标记的单克隆抗体(亲本细胞CD44+组、亲本细胞CD271+组、细胞球CD44+组、细胞球CD271+组),以不加抗体为空白组,每组设3个平行样本,4℃避光孵育,30 min后PBS洗涤两遍去除未结合的抗体,流式细胞仪检测,实验重复3次。
4. MTT检测细胞增殖能力:收集亲本细胞和细胞球,消化后配置单细胞悬液,调整细胞密度为4×104/ml,按每孔200 μl接种96孔板,亲本细胞和细胞球分别分为对照组、NS398+0 Gy组、NS398+4 Gy组和NS398+8 Gy组,每组设5个平行样本,并设置一空白孔(只加培养基,无细胞)。待细胞完全贴壁后吸尽培养基,24 h后予以不同照射剂量0、4和8 Gy。采用德国西门子Primus-H型医用直线加速器照射,6 MV X射线,射野为30 cm×30 cm,吸收剂量率1 Gy/min,源靶距细胞生长面100 cm。在37℃,5%CO2条件下培养,分别于24、48和72 h后用酶标仪测定吸光度A490值,每次检测取各孔的平均值,并计算细胞生长抑制率。生长抑制率(IR)(%)=(对照组A490-实验组A490)/对照组A490×100%,实验重复3次。
5. 克隆形成实验:收集ECA109亲本细胞和细胞球并调整细胞悬液浓度,按照射剂量0、2、4、6、8和10 Gy分别接种不同细胞密度(2×102、5×102、1×103、2×103、5×103、1×104/孔)于6孔板中,亲本细胞和细胞球分别分为照射组和NS398+照射组,每组不同细胞密度设3个平行样本。照射后更换培养基,以后每隔2~3 d更换1次培养基。14 d后用4%的甲醇固定15 min后,结晶紫染色20 min,冲洗干燥后计数>50个细胞的克隆数。应用Graphpad prism 5 Demo软件拟合细胞存活曲线,采用单击多靶模型S=1-(1-e-D/ D0)N拟合后获得平均致死剂量(D0)、细胞受损所需准阈剂量(Dq)、存活分数(SF2)和辐射增敏比(SERD0)等参数。并计算相应参数,实验重复3次。
6. Western blot检测细胞内蛋白表达水平:收集蛋白样品,亲本细胞和细胞球分别分为4组(对照组、4 Gy照射组、20 μmol/L NS398组、20 μmol/L NS398+4 Gy照射组),BCA法测定蛋白浓度。取蛋白样品上样于8%的SDS-聚丙烯酰胺凝胶中电泳,4℃转膜约45 min,取出有Bmi-1、c-Myc、Cyclin D1和β-肌动蛋白的PVDF膜,用 5%脱脂奶粉封闭2 h,β-catenin的PVDF膜继续转膜45 min后封闭。分别加入相应的特异性一抗(Bmi-1 1∶300、c-Myc 1∶5 000、β-catenin 1∶500、Cyclin D1 1∶5 000、β-肌动蛋白1∶1 000稀释)4℃摇床过夜,TBST洗膜3次,加入HRP耦联的二抗(1∶1 000稀释)室温摇床孵育2 h,TBST洗膜3次。采用显色试剂盒显色反应,于暗室内进行曝光、显影、定影,胶片扫描后采用Image J分析软件进行半定量分析,实验重复3次。
7. 统计学处理:数据均以( ± s)表示。采用SPSS 18.0统计软件检验分析,两组间比较采用t检验,多组间比较采用方差分析。P < 0.05为差异有统计学意义。
± s)表示。采用SPSS 18.0统计软件检验分析,两组间比较采用t检验,多组间比较采用方差分析。P < 0.05为差异有统计学意义。
1. 流式检测细胞CD44+、CD271+的表达:亲本细胞CD44+的表达为(0.29±0.05)%、CD271+为(1.41±1.96)%,细胞球CD44+的表达为(0.37±0.05)%,CD271+为(10.44±3.60)%,细胞球CD271+高于亲本细胞,差异具有统计学意义(t=3.81,P < 0.05)(图 1,表 1)。
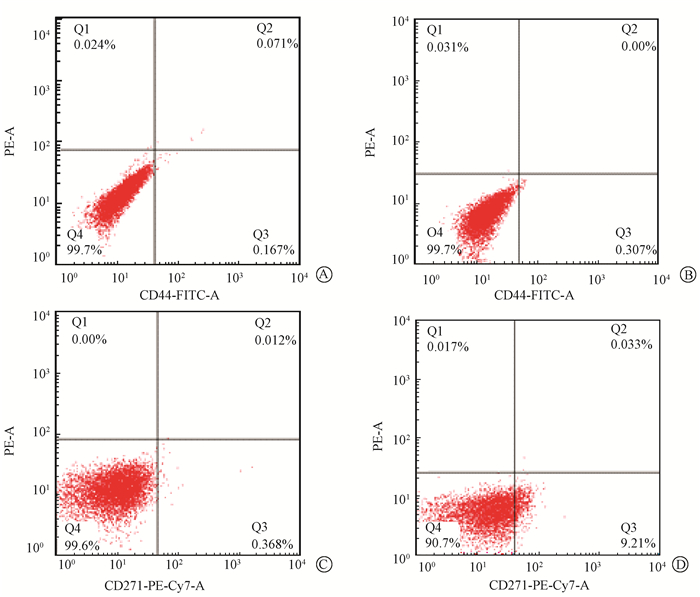 | 图 1 ECA109细胞CD44+、CD271+的表达水平 A.亲本细胞CD44+组;B.细胞球CD44+组;C.亲本细胞CD271+组;D. 细胞球CD271+组 Figure 1 Expression levels of ECA109 cell surface maker CD44+、CD271+ |
| 表 1 细胞中CD44+、CD271+的表达水平 Table 1 Expression levels of cell surface maker CD44+、CD271+ |
2. MTT法检测NS398联合照射对细胞增殖能力的影响:由表 2可见,X射线照射对亲本细胞和细胞球增殖能力的抑制作用均具有剂量依赖性。亲本细胞和细胞球随照射剂量的增大,增殖能力逐渐减弱。照射后细胞球的增殖能力仍大于亲本细胞。
| 表 2 NS398联合照射对ECA109细胞增殖能力(A490值)的作用 Table 2 Cell proliferation of ECA109 treated with 20 μmol/L NS398 combined with irradiation |
(1)NS398联合不同照射剂量0、4和8 Gy时,亲本细胞在24、48和72 h增殖能力均有差异(F=80.63、166.98、58.56,P < 0.05);细胞球在24和48 h时增殖能力有差异(F=12.21、14.04,P < 0.05)。
(2)在NS398+0 Gy组中,仅在72 h时细胞球增殖能力大于亲本细胞,差异具有统计学意义(t=5.06,P < 0.05);在NS398+4 Gy组和NS398+8 Gy组中,细胞球增殖能力在不同时间点时均大于亲本细胞,差异具有统计学意义(t=5.34、11.25、10.89,P < 0.05;t=13.61、23.31、8.26,P < 0.05)。实验表明细胞球具有较强的的辐射抗性。
3. 克隆形成实验:随着照射剂量的增加,存活分数逐渐降低,并且各组细胞存活能力随剂量增加差异也加大(图 2)。由表 3可见,NS398+照射组与照射组相比,亲本细胞的D0、Dq和SF2均减小(t=3.32、3.33、3.37,P < 0.05),细胞球D0、SF2减小(t=3.23、3.18,P < 0.05)。NS398+照射组中,亲本细胞的D0、Dq和SF2均小于细胞球(t=12.76、2.91、4.59,P < 0.05),表明细胞球比亲本细胞具有较强的辐射抗性。在D0照射剂量时,NS398对细胞球的辐射增敏比小于亲本细胞。
 | 图 2 ECA109细胞存活曲线 Figure 2 The survival curve of ECA109 cells |
| 表 3 ECA109细胞辐射增敏参数及增敏比SERTable 3 Radiosensitization parameters and SER of ECA109 cells |
4.Western blot检测细胞内蛋白表达水平:对照组中,Bmi-1、c-Myc、β-catenin和Cyclin D1在ECA109细胞球中表达水平较亲本细胞均升高(t=8.09、7.90、7.50、7.15,P < 0.05)。4 Gy照射组与对照组相比,亲本细胞和细胞球内Cyclin D1表达水平升高(t=9.74、6.67,P < 0.05)。NS398+4 Gy照射组与4 Gy照射组相比,亲本细胞β-catenin和Cyclin D1表达水平降低(t=10.15、12.12,P < 0.05),细胞球β-catenin和Cyclin D1表达水平亦降低(t=3.23、7.45,P < 0.05),但细胞球内β-catenin降低的幅度比亲本细胞小(图 3)。
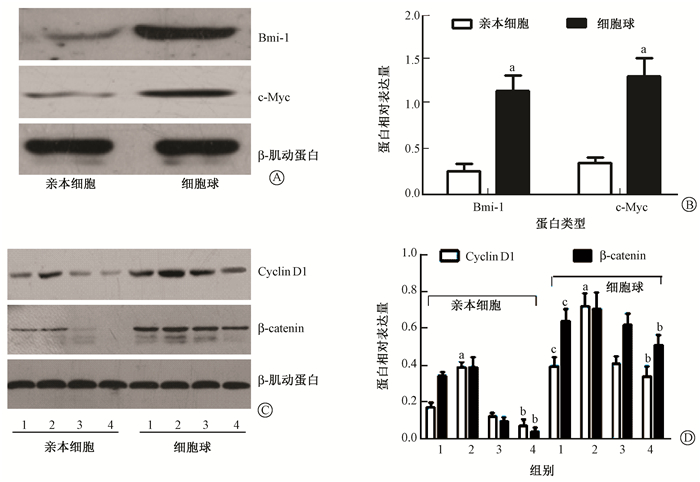 | 注:A.Western blot检测无NS398和照射时Bmi-1、c-Myc的电泳图;B.无NS398和照射时Bmi-1、c-Myc的蛋白相对表达量。a与亲本细胞相比,t=8.09、7.90,P < 0.05。C.Western blot检测β-catenin、Cyclin D1的电泳表达图;D.β-catenin、Cyclin D1的蛋白相对表达量。a与对照组比,t=9.74、6.67,P < 0.05;b与4 Gy照射组比,t=10.15、12.12、3.23、7.45,P < 0.05;与亲本细胞对照组比较,t=7.5、7.15,P < 0.05。1.对照组;2.4 Gy照射组;3.NS398组;4.NS398+4 Gy照射组 图 3 ECA109细胞内蛋白表达水平 Figure 3 The expression levels of proteins in ECA109 cells |
无血清培养法是利用CSC能够在SFM中悬浮生长并形成干细胞球,而普通的肿瘤细胞则无法耐受这种无血清的培养条件,利用这种特性富集CSC。在本实验的前期研究中已成功运用SFM分离出食管癌KYSE150、TE1的CSC,并鉴定其CSC特性和放射生物学特性,发现CSC对辐射产生抵抗可能与细胞周期调控有关[3]。同时,本实验已在SFM分离食管癌ECA109的CSC基础上,从不同的角度分析20 μmol/L NS398对ECSC和贴壁细胞辐射增敏效应的差异以论证ECSC的辐射抗性[4]。本研究将通过NS398进一步深入论证ECSC辐射抗性与相关分子蛋白的关系,对其分子机制进行初步的探讨,完善ECSC辐射抗性相关机制的研究。
NS398是环氧合酶-2(cyclooxygenase-2,Cox-2)特异性选择抑制剂,可抑制Cox-2、β-catenin和AKT等分子蛋白,诱导辐射后肿瘤细胞的凋亡[5, 6]。Bmi-1是进化高度保守的多梳家族PcGs中核心成员之一,在胚胎发育和干细胞的自我更新中起着重要作用,在多种类型的CSC中呈高表达状态。有研究发现,Bmi-1在CD133+肝癌细胞中处于高表达状态,对SP细胞的维持和扩增有决定性的作用[7]。β-catenin是Wnt信号通路中的重要枢纽分子,在胞质内积累到一定浓度时向胞核转移,并与核内转录因子Tcf/Lef结合使β-catenin下游靶基因c-Myc、Cyclin D1、Gastrin、MMP7和ITF-2等激活,最终导致细胞的异常增殖[8]。β-catenin在ECSC组织中呈高表达状态,参与食管癌的恶性增殖、迁移和侵袭[9]。β-catenin的高表达是导致干细胞自我更新的重要因素,干细胞的残存再增殖使肿瘤细胞不断扩增[10, 11, 12]。c-Myc是编码与细胞周期调控有关的核内DNA结合蛋白的癌基因,在调节CSC的增殖,抑制细胞分化及维持CSC表型中发挥重要作用[13]。从口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)中分选的SP细胞具有更强的克隆增殖能力和致瘤性,高表达干细胞基因Bmi-1、Nanog和ABCG2,c-Myc通过直接作用于超氧化物歧化酶(superoxide dismutase,SOD)介导CSC的侵袭和迁移[14]。通过上调β-catenin的表达水平可诱导Cox的高表达,而抑制β-catenin的表达则可以逆转食管癌对辐射的抵抗[15]。Cyclin D1是细胞周期蛋白,具有严格的周期顺序性,能与特定的细胞周期素依赖性激酶(cyclin-dependent kinase,CDK)结合成复合体。Cyclin D1的高表达状态在大多数类型的肿瘤细胞中都有标志性的出现,常被作为判断肿瘤患者预后的分子指标[16]。Cyclin D1的表达水平在头颈部鳞状细胞癌(head neck squamous cell carcinoma,HNSCC)的放疗疗效中发挥一定的负面作用,Lo等[17]发现Cyclin D1在EZH2/Oct4介导的辐射抗性中扮演着关键的角色,通过EZH2/Oct4小干扰RNA(small interfering RNA,siRNA)降低Cyclin D1的表达水平,能增强HNSCC中CSC的辐射敏感性。
本研究中亲本细胞即普通贴壁肿瘤细胞,细胞球即具有肿瘤干细胞特性的一群细胞。实验发现经分选的细胞球高表达干细胞表面标记物CD271(P75NTR)和干细胞相关蛋白Bmi-1、c-Myc、β-catenin和Cyclin D1,表明经无血清培养法分离的细胞球具有肿瘤干细胞特性。通过MTT实验发现,亲本细胞和细胞球在仅有NS398作用时,增殖能力无明显差异;在NS398联合照射的条件下增殖能力才出现了差异,且细胞球的增殖能力更强。克隆形成实验发现细胞存活率随照射剂量的增高呈指数性降低,照射后细胞球的存活率大于亲本细胞;NS398对亲本细胞辐射增敏比大于细胞球。上述实验结果表明,食管癌干细胞对射线导致的细胞损伤反应较小,且保持较强的增殖能力,从而使NS398对食管癌干细胞的辐射增敏效应小于普通肿瘤细胞,证明了食管癌干细胞具有较强的辐射抗性。本研究还发现,一定的照射剂量能使细胞周期蛋白Cyclin D1的表达水平升高,而NS398联合照射可以降低β-catenin和Cyclin D1的表达水平,实验表明,照射能使肿瘤干细胞在分子蛋白水平上增强辐射抗性,其辐射抗性的机制可能是通过上调β-catenin分子并激活其下游靶蛋白Cyclin D1调控的。
ECSC的辐射抗性的相关机制较为复杂,各种分子相互作用、共同协作参与对ECSC的调控[18]。目前对ECSC辐射抗性的调控机制研究还比较少,需要更深入、更全面的研究,为临床放疗提供理论依据,提高肿瘤患者的治疗疗效。
利益冲突 本研究接受南京医科大学附属常州第二人民医院江苏省卫生厅指导性科研项目资助,进行“食管癌干细胞辐射抗性与相关蛋白表达”的相关研究,本人与本人家属、其他研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证 作者贡献声明 邱琪设计研究方案,进行试验,收集数据后统计并起草论文;孙苏平、于静萍指导实验思路,修改论文;汪建林,提供实验方法,协助进行实验操作;孙志强指导、监督试验进行| [1] | Bütof R, Dubrovska A, Baumann M. Clinical perspectives of cancer stem cell research in radiation oncology[J]. Radiother Oncol, 2013, 108(3):388-396.DOI:10.1016/j.radonc.2013.06.002. |
| [2] | Wang Y, Li W, Patel SS, et al. Blocking the formation of radiation-induced breast cancer stem cells[J]. Oncotarget, 2014, 5(11):3743-3755. |
| [3] | 汪建林, 孙志强, 于静萍,等. 食管癌细胞株中肿瘤干性细胞群的放射生物学特性[J]. 中华肿瘤杂志, 2014, 36(8):575-581. DOI:10.3760/cma.j.issn.0253-3766.2014.08.004. Wang JL,Sun ZQ,Yu JP,et al.Radiobiological characteristics of cancer stem cells from esophageal cancer cell lines[J].Chin J Oncol, 2014, 36(8):575-581.DOI:10.3760/cma.j.issn.0253-3766.2014.08.004. |
| [4] | 邱琪, 孙苏平, 汪建林,等. 食管肿瘤干细胞抗辐射特性的实验研究[J]. 南京医科大学学报(自然科学版), 2015, 35(3):326-331. DOI:10.7655/NYDXBNS20150306. Qiu Q,Sun SP,Wang JL,et al. Experiment on the radioresistance of esophageal cancer stem cells[J].J Nanjing Med Univ,2015, 35(3):326-331.DOI:10.7655/NYDXBNS20150306. |
| [5] | Che SM, Zhang XZ, Hou L, et al. Cyclooxygenase-2 inhibitor NS398 enhances radiosensitivity of radioresistant esophageal cancer cells by inhibiting AKT activation and inducing apoptosis[J]. Cancer Invest, 2010, 28(7):679-688.DOI:10.3109/07357907.2010.483504. |
| [6] | Che SM, Zhang XZ, Liu XL, et al. The radiosensitization effect of NS398 on esophageal cancer stem cell-like radioresistant cells[J]. Dis Esophagus, 2011, 24(4):265-273.DOI:10.1111/j.1442-2050.2010.01138.x. |
| [7] | Chiba T, Zheng YW, Kita K,et al. Enhanced self-renewal capability in hepatic stem/progenitor cells drives cancer initiation[J]. Gastroenterology, 2007, 133(3):937-950.DOI:10.1053/j.gastro.2007.06.016. |
| [8] | Kolligs FT, Bommer G, G ke B. Wnt/beta-catenin/tcf signaling:a critical pathway in gastrointestinal tumorigenesis[J]. Digestion, 2002, 66(3):131-144.DOI:10.1159/000066755. |
| [9] | Ren HZ, Wang JS, Pan GQ,et al. Comparative proteomic analysis of beta-catenin-mediated malignant progression of esophageal squamous cell carcinoma[J]. Dis Esophagus, 2010, 23(2):175-184.DOI:10.1111/j.1442-2050.2009.01001.x. |
| [10] | Nguyen NP, Almeida FS, Chi A,et al. Molecular biology of breast cancer stem cells:potential clinical applications[J]. Cancer Treat Rev, 2010, 36(6):485-491.DOI:10.1016/j.ctrv.2010.02.016. |
| [11] | Yu Z, Pestell TG, Lisanti MP,et al. Cancer stem cells[J]. Int J Biochem Cell Biol, 2012, 44(12):2144-2151.DOI:10.1016/j.biocel.2012.08.022. |
| [12] | Oishi N, Yamashita T, Kaneko S. Molecular biology of liver cancer stem cells[J]. Liver Cancer, 2014, 3(2):71-84.DOI:10.1159/000343863. |
| [13] | Akita H, Marquardt JU, Durkin ME,et al. MYC activates stem-like cell potential in hepatocarcinoma by a p53-dependent mechanism[J]. Cancer Res, 2014, 74(20):5903-5913.DOI:10.1158/0008-5472.CAN-14-0527. |
| [14] | Liu Z, He Q, Ding X,et al. SOD2 is a C-myc target gene that promotes the migration and invasion of tongue squamous cell carcinoma involving cancer stem-like cells[J]. Int J Biochem Cell Biol, 2015, 60:139-146.DOI:10.1016/j.biocel.2014.12.022. |
| [15] | Li HZ, Gao XS, Xiong W,et al. Identification of differentially expressed genes related to radioresistance of human esophageal cancer cells[J]. Chin J Cancer, 2010, 29(10):882-888. |
| [16] | Cao W, Feng Z, Cui Z,et al. Up-regulation of enhancer of zeste homolog 2 is associated positively with cyclin D1 overexpression and poor clinical outcome in head and neck squamous cell carcinoma[J]. Cancer, 2012, 118(11):2858-2871.DOI:10.1002/cncr.26575. |
| [17] | Lo WL, Chien Y, Chiou GY,et al. Nuclear localization signal-enhanced RNA interference of EZH2 and Oct4 in the eradication of head and neck squamous cell carcinoma-derived cancer stem cells[J]. Biomaterials, 2012, 33(14):3693-3709.DOI:10.1016/j.biomaterials.2012.01.016. |
| [18] | Moncharmont C, Levy A, Gilormini M,et al. Targeting a cornerstone of radiation resistance:cancer stem cell[J]. Cancer Lett, 2012, 322(2):139-147.DOI:10.1016/j.canlet.2012.03.024. |
 2016, Vol. 36
2016, Vol. 36


