神经营养因子受体(neurotrophin receptor p75 interacting MAGE homologue,NRAGE),又称MAGED1或Dlxin-1,属于黑色素瘤相关抗原MAGE家族Ⅱ类,最初作为一个抑癌基因在细胞存活、凋亡、细胞周期和分化中发挥重要调节功能[1]。近几年的研究发现,NRAGE在胃癌、黑色素瘤、结肠癌等癌组织中过表达,并存在与抑癌基因截然相反的作用[2, 3]。本组前期研究发现,NRAGE在食管癌放射抗拒细胞TE13R120中表达升高[4],并提示NRAGE亚细胞定位改变可能促进食管癌放射抗拒细胞TE13R120放射抗性的形成[5]。
上皮间质转化(epithelial to mesenchymal transition,EMT)表现为上皮细胞失去细胞间的黏附性和极性,获得迁移特性,具有更强的侵袭和转移能力[6]。目前已有多项研究证实EMT与放疗抗性的形成相关[7]。Kumar 等[2]发现在正常乳腺上皮细胞EMT期间NRAGE的亚细胞定位发生改变。但NRAGE亚细胞定位改变与EMT及食管癌细胞放射抗性形成存在何种机制尚无报道。本研究旨在进一步探讨食管癌细胞中NRAGE亚细胞定位改变在EMT与放射抗性形成中的作用。
1. 细胞系与材料:人食管鳞状细胞癌细胞系TE13为北京大学高献书教授实验室惠赠,TE13R120经反复照射,累积剂量120 Gy,并验证放射抗性稳定遗传后获得[8]。两株细胞均置于含10%胎牛血清、100 U/ml青霉素、100 U/ml链霉素的RPMI 1640培养基内,在37℃、5%CO2饱和湿度的培养箱内培养。转化生长因子-β1(TGF-β1)和MAGED1多克隆抗体均购自美国Peprotech公司;E-钙黏蛋白(E-cadherin)多克隆抗体购自美国Santa Cruz公司;波形蛋白(Vimentin)多克隆抗体购自北京博奥森公司;DAB显色剂及一步法聚合物检测系统均购自北京中杉金桥公司;引物设计购自上海捷瑞公司;PrimeScriptTM Ⅱ反转录试剂盒与SYBR Premix Ex TaqTM均购自日本TaKaRa公司。光学倒置显微镜及照相系统购自日本SANYO公司,Real-time PCR仪购自安捷伦科技有限公司,全数字引导直线加速器购自瑞典医科达公司。
2. TGF-β1诱导TE13细胞发生EMT建立EMT模型细胞:TE13细胞常规消化后接种适量细胞于6孔板中,在37℃、5%CO2饱和湿度条件下培养过夜。无血清培养基饥饿培养6~8 h,加入TGF-β1(10 ng/ml)处理48 h后在相差显微镜下观察细胞形态变化并拍照。
3. Real-time PCR:取对数生长期的TE13细胞、TE13R120细胞和EMT模型细胞,利用Trizol试剂提取总RNA,NanoDrop2000测量检测RNA纯度和浓度,使A260/A280比值控制在1.8~2.0之间。Real-time PCR操作步骤按照TaKaRa说明书进行。采用GAPDH做内参对照,Real-time PCR引物序列为:GAPDH上游:5′CATGAGAAGTATGACAACAGCCT 3′,下游:5′ AGTCCTTCCACGATAC
CAAAGT 3′ ;E-cadherin 上游:5′ CAGCGTGTGTGACTGTGAAG 3′ ,下游:5′ AAACAGCAAGAGCAGCAGAA 3′ ;Vimentin上游:5′ CCTGCAGGATGAGATTCAGA 3′ ,下游:5′ GGCAGAGAAATCCTGCTCTC 3′ ;NRAGE上游:5′ TGCCAGTGAGGCTGTCCTCT 3′ ,下游:5′ CATCTGCAGCCTCCATGAACT 3′ 。
Real-time PCR反应体系为:95℃ 30 s 1个循环;95℃ 5 s,60℃ 20 s 40个循环;起始温度 60℃,目标温度 95℃。以上实验重复3次。
4.Western blot检测:细胞裂解液裂解同上3种细胞,4℃ 12 000×g离心10 min取上清,BCA蛋白定量试剂盒检测蛋白浓度,变性,-20℃储存。按每孔上样量30 μg进行SDS-PAGE电泳,90 V恒压转膜90 min,3%脱脂奶粉封闭1 h。一抗4℃孵育过夜(E-cadherin 1∶1 000,Vimentin 1∶1 000,MAGED1 1∶1 000),用TBST在脱色摇床上洗膜15 min×3次,加辣根酶羊抗鼠(1∶2 000)或羊抗兔(1∶2 000)IgG,37℃孵育1 h后,用TBST洗膜5 min×3。ECL显色试剂盒显影。以上实验重复3次。
5.统计学处理:数据以 ± s表示,采用SPSS 17.0统计软件进行分析,计量资料两组间比较采用t检验,多组间的比较采用Kruskal-Wallis秩和检验。P < 0.05为差异有统计学意义。
± s表示,采用SPSS 17.0统计软件进行分析,计量资料两组间比较采用t检验,多组间的比较采用Kruskal-Wallis秩和检验。P < 0.05为差异有统计学意义。
1.TGF-β1诱导TE13细胞形态学变化观察:TE13细胞在TGF-β1处理48 h后,通过相差显微镜观察,未处理的TE13细胞呈不规则的多边形,细胞间边界不清,呈片状生长,细胞间结合紧密,表现为不规则的上皮细胞形态;经TGF-β1刺激后,大部分细胞呈纺锤形,细胞排列较乱,细胞间连接疏松,呈现明显的间质细胞形态(图 1)。
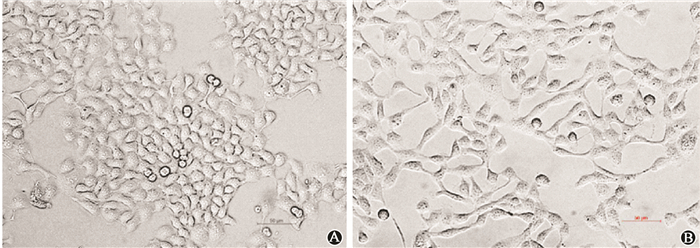 | 图 1 TE13细胞未处理(A)和处理后(B)的形态学变化 ×200 Figure 1 Morphology of TE13 cells before (A) and after (B) TGF-β1 treatment ×200 |
2.TE13细胞、EMT模型细胞、TE13R120细胞上皮及间质标记蛋白表达的情况:经过TGF-β1处理48 h后,Real-time PCR和Western blot结果显示,细胞上皮标记蛋白E-cadherin的mRNA水平和总蛋白水平均下调,间质标记蛋白Vimentin的mRNA水平和总蛋白水平均上调,且差异有统计学意义(t=13.56、-232.84,P < 0.05,表 1,图 2)。表明TGF-β1诱导TE13发生EMT的细胞模型建立成功。Real-time PCR和Western blot结果显示,与亲本TE13细胞相比,TE13R120细胞中E-cadherin和Vimentin mRNA及总蛋白出现同EMT模型细胞相似的趋势,且差异具有统计学意义(t=15.84、-54.54,P < 0.05,表 1,图 2)。提示食管癌放射抗性细胞TE13R120已经具有的EMT样表型。
| 表 1 3组细胞中E-cadherin和Vimentin mRNA水平表达 Table 1 The mRNA expression of E-cadherin and Vimentin in three groups |
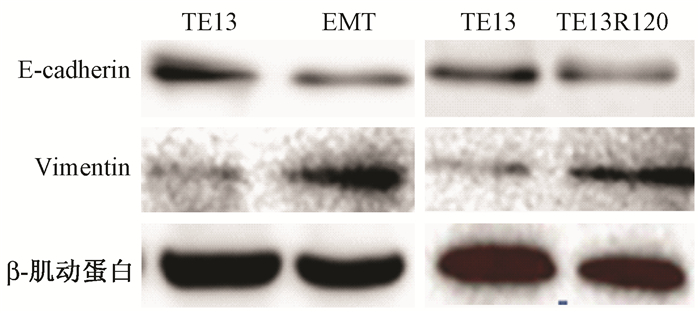 | 图 2 TE13细胞、EMT模型细胞和TE13R120细胞中E-cadherin及Vimentin 蛋白表达水平 Figure 2 The protein expressions of E-cadherin and vimentin in TE13 cells, EMT model cells and TE13R120 cells |
3. NRAGE mRNA和总蛋白在TE13细胞、EMT模型细胞和TE13R120细胞中的表达:Real-time PCR结果显示,与TE13细胞相比,NRAGE在后两种细胞中mRNA水平的表达量均上调 (t=-8.73、-5.62,P < 0.05);Western blot检测结果显示,TE13R120细胞和EMT模型细胞NRAGE的总蛋白表达量较TE13细胞水平上调,见图 3。在TE13R120和EMT模型细胞中均发现NRAGE的过表达现象(t=-0.88,P>0.05),提示食管癌放射抗性细胞极可能由于EMT的发生参与了NRAGE的过表达,进而促使放射抗性产生。
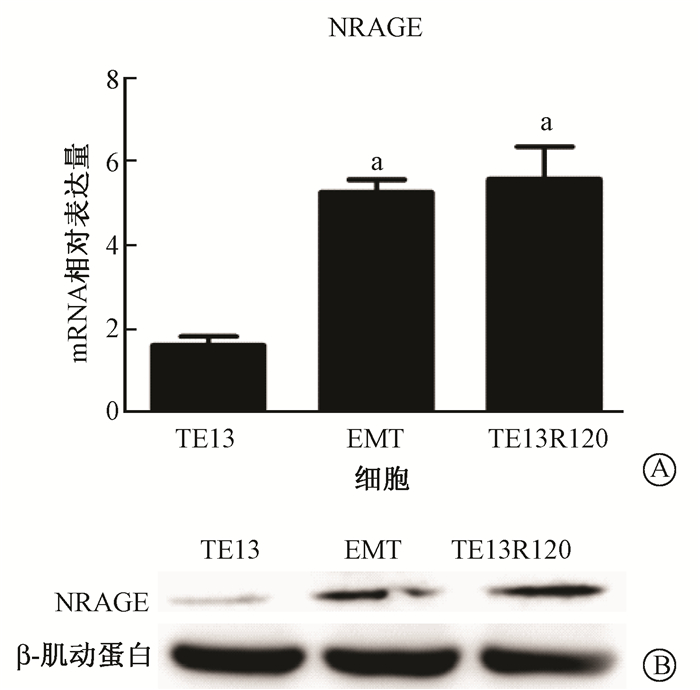 | 注:a与TE13细胞同一基因比较,t=-8.73、-5.62,P < 0.05图 3 TE13细胞、EMT细胞模型及TE13R120细胞中NRAGE mRNA(A)和总蛋白(B)表达情况 Figure 3 Expressions of NRAGE mRNA (A)and its protein (B) in TE13 cells, EMT model cells and TE13R120 cells |
4. NRAGE胞质胞核蛋白在TE13细胞、EMT模型细胞和TE13R120细胞中的表达:进一步检测其内胞质胞核表达情况,三者胞质蛋白NRAGE表达量无明显差别,而胞核蛋白NRAGE表达量TE13R120细胞和EMT模型细胞较TE13细胞明显增多,且TE13R120细胞和EMT模型细胞间没有差别(图 4)。提示,EMT的发生促使NRAGE亚细胞定位发生改变。
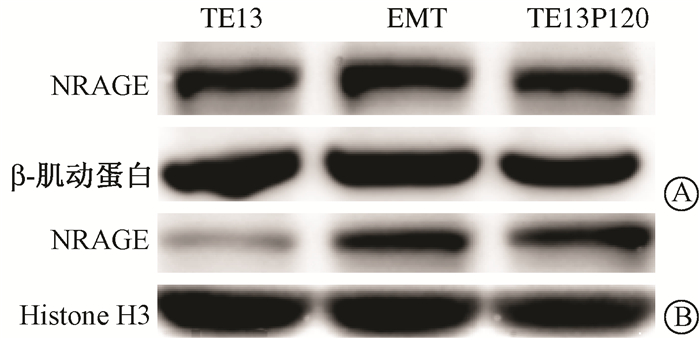 | 图 4 TE13细胞、EMT细胞模型及TE13R120细胞中胞质蛋白(A)和胞核蛋白(B)表达情况 Figure 4 Expressions of NRAGE protein in cytoplasm (A) and nuclei (B) of TE13 cells, EMT model cells and TE13R120 cells |
放射抗性是肿瘤放疗失败的主要原因,同时也是食管癌放射生物学研究的焦点,对其分子机制的研究备受关注。多项研究证实肿瘤细胞受照射后可发生EMT[9],并证实EMT可促进放射抗性的形成[10]。而且在具有放射抗性的肿瘤细胞,如鼻咽癌、前列腺癌、食管癌等细胞中存在EMT样表型[11, 12]。本实验在具有放射抗性的食管癌细胞TE13R120中发现并验证了EMT样表型的存在。
在本组的前期研究中,应用基因芯片技术分析了食管鳞状细胞癌细胞TE13与其建立的放射抗性细胞TE13R120的差异表达基因,发现NRAGE在TE13R120细胞中高表达,显示NRAGE的高表达与放射抗性相关[5],但NRAGE亚细胞定位参与放射抗性的分子机制尚无文献报道。在关于NRAGE与细胞黏附、侵袭转移方面的研究中,发现多种肿瘤细胞表现出EMT样表型[13],且有研究证实,在乳腺上皮细胞EMT形成期间NRAGE的表达发生改变,即核移位[2]。就此猜测NRAGE、食管癌放射抗拒细胞、EMT三者间存在某种联系。
为研究NRAGE在EMT参与放射抗性的分子机制,本实验对3株细胞NRAGE的转录水平和翻译水平进行检测,结果显示,TGF-β1成功诱导TE13细胞发生EMT后,NRAGE在细胞核中的表达明显上调,且与同样具有EMT样表型的放射抗拒细胞TE13R120中NRAGE核表达变化相一致。可见EMT的发生可能通过参与NRAGE亚细胞定位改变,促进放射抗性的形成。但其发生的详细分子机制尚不清楚。有报道证实,过表达NRAGE可抑制上皮标记蛋白E-cadherin 和β-catenin的表达[13],E-cadherin的下调作为EMT形成过程中的标志性事件[7],可能通过NRAGE改变E-cadherin和β-catenin的表达参与EMT的形成,这种亚细胞定位的改变与EMT及放射抗性的形成是通过何种方式进行调控,仍需进一步研究。
近几年,有关NRAGE核移位的研究开始受到关注。Matsuda等[14]研究发现NRAGE可以与Ror2的C端结合,共定位于近细胞膜,而Ror2表达下调或缺失时,NRAGE基因移位入细胞核,与Msx2结合,启动其转录活性。Kumar等[2]发现锚定蛋白Ankyrin-G N端锚蛋白重复区域与E-cadherin结合,并将NRAGE定位于细胞质中,当上皮细胞发生EMT后,Ankyrin-G的表达受到抑制,可允许小部分NRAGE转移至细胞核。说明NRAGE的功能比较复杂,在细胞内有不同的定位,参与调控不同的信号通路,发挥不同的生物学功能,NRAGE的核移位可能赋予了NRAGE不同的角色。对于其亚细胞定位的改变机制,可从上述研究中寻找关键分子对NRAGE在细胞核和细胞质之间穿梭机制进一步探讨。
综上所述,本实验通过体外实验发现了NRAGE可能通过参与EMT促进放射抗性的形成的机制。本实验虽然为研究放射抗性形成发现了新的靶点,但仍有许多问题有待进一步研究,其中包括缺乏体内实验的验证;放射治疗如何提高细胞内NRAGE的表达量;NRAGE进入细胞核是否影响其他基因的转录。尽管如此,该发现在放射抗性的形成、EMT与放射抗性形成机制研究中提供了新的方向,对放射增敏药物的研发提供了新的靶点。
利益冲突 本人与本人家属、其他研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证 作者贡献声明 张亚芳、薛晓英设计研究方案,收集数据后统计并起草论文;张歌,协助实验部分的完成;常晓静、薛晓英指导、监督试验进行;周欢娣、薛晓英论文修改;盖晓惠负责放疗计划的设计| [1] | Yang Q, Ou C, Liu M, et al. NRAGE promotes cell proliferation by stabilizing PCNA in a ubiquitin-proteasome pathway in esophageal carcinomas[J]. Carcinogenesis,2014,35(7):1643-1651. DOI:10.1093/carcin/bgu084. |
| [2] | Kumar S, Park SH, Cieply B, et al. A pathway for the control of anoikis sensitivity by E-cadherin and epithelial-to-mesenchymal transition[J]. Mol Cell Biol, 2011,31(19):4036-4051.DOI:10.1128/MCB.01342-10. |
| [3] | 张占化,闫爱华,张占薪,等. NRAGE基因在胃癌组织中表达与病理特征的关系[J]. 医药论坛杂志,2007,28(19):17-18.DOI:10.3969/j.issn.1672-3422.2007.19.008. Zhang ZH, Yan AH, Zhang ZX, et al. Expression of NRAGE gene in gastric carcinoma and its regulation role in apoptosis. J Medical Forum, 2007,28(19):17-18. DOI:10.3969/j.issn.1672-3422.2007.19.008. |
| [4] | 薛晓英,高献书,周志国,等. 食管癌细胞系TE13R120放射抗性与HDAC3、NF-kB和NRAGE关系的研究[J]. 中华放射医学与防护杂志,2005,25(1):31-34.DOI:10.3760/cma.j.issn.0254-5098.2005.01.008. Xue XY, Gao XS, Zhou ZG,et al.A study of the relationship of the radioresistance of esophageal carcinoma cell line TE13R120 with HDAC3, NF-kB and NRAGE[J]. Chin J Radiol Med Prot, 2005,25(1):31-34.DOI:10.3760/cma.j.issn.0254-5098.2005.01.008. |
| [5] | Xue XY, Liu ZH, Jing FM, et al. Relationship between NRAGE and the radioresistance of esophageal carcinoma cell line TE13R120[J]. Chin J Cancer, 2010, 29(10):900-906. DOI:10.5732/cjc.010.10141. |
| [6] | Thiery JP. Epithelial-mesenchymal transitions in tumour progression[J]. Nat Rev Cancer,2002,2(6):442-454. DOI:10.1038/nrc822. |
| [7] | Marie-Egyptienne DT, Lohse I, Hill RP. Cancer stem cells, the epithelial to mesenchymal transition (EMT) and radioresistance:potential role of hypoxia[J]. Cancer Lett,2013,341(1):63-72. DOI:10.1016/j.canlet.2012.11.019. |
| [8] | 杨延灵,薛晓英,冉玉格,等. 反复照射建立食管癌放射抗性细胞系方法的重复性和稳定性研究[J]. 河北医科大学学报,2015(3):300-303. DOI:10.3969/j.issn.1007-3205.2015.03.015. Yang YL, Xue XY, Ran YG, et al. Repeatability and stability of repeated irradiation method to establish the radioresistant esophageal cancer cell line[J]. J Hebei Med Univ, 2015(3):300-303.DOI:10.3969/j.issn.1007-3205.2015.03.015. |
| [9] | Barcellos-Hoff MH, Derynck R, Tsang ML, et al. Transforming growth factor-beta activation in irradiated murine mammary gland[J]. J Clin Invest,1994,93(2):892-899. DOI:10.1172/JCI117045. |
| [10] | Theys J, Jutten B, Habets R, et al. E-Cadherin loss associated with EMT promotes radioresistance in human tumor cells[J]. Radiother Oncol,2011,99(3):392-397. DOI:10.1016/j.radonc.2011.05.044. |
| [11] | Chang L, Graham PH, Hao J, et al. Acquisition of epithelial-mesenchymal transition and cancer stem cell phenotypes is associated with activation of the PI3K/Akt/mTOR pathway in prostate cancer radioresistance[J]. Cell Death Dis,2013,4:e875. DOI:10.1038/cddis.2013.407. |
| [12] | 李果, 刘勇, 粟忠武,等.放射线照射诱导鼻咽癌细胞上皮-间质转化的作用研究[J].中华耳鼻咽喉头颈外科杂志, 2013, 48(8):662-667. DOI:10.3760/cma.j.issn.1673-0860.2013.08.011. Li G, Liu Y, Su ZW, et al. Irradiation induced epithelial-mesenchymal transition in nasopharyngeal carcinoma in vitro[J]. Chin J Otorhinol Head Neck Surg, 2013, 48(8):662-667. DOI:10.3760/cma.j.issn.1673-0860.2013.08.011. |
| [13] | Chu CS, Xue B, Tu C, et al. NRAGE suppresses metastasis of melanoma and pancreatic cancer in vitro and in vivo[J]. Cancer Lett, 2007,250(2):268-275. DOI:10.1016/j.canlet.2006.10.020. |
| [14] | Matsuda T, Suzuki H, Oishi I, et al. The receptor tyrosine kinase Ror2 associates with the melanoma-associated antigen (MAGE) family protein Dlxin-1 and regulates its intracellular distribution[J]. J Biol Chem,2003,278(31):29057-29064. DOI:10.1074/jbc.M302199200. |
 2016, Vol. 36
2016, Vol. 36


