放射性肺损伤的细胞因子学说提出,由细胞因子介导的多细胞间相互作用引导并贯穿放射性肺损伤的整个过程[1]。转化生长因子β1 (TGF-β1)被认为是细胞因子网络的核心,大量研究证实放射性肺损伤的发生发展与组织内TGF-β1的表达水平相关[2, 3]。Smads蛋白则是目前所知的TGF-β1受体胞内唯一的激酶底物,可介导TGF-β1的下游细胞内信号传导[4]。前期研究发现,肿节风对小型猪放射性肺损伤具有防护作用[5]。本研究运用HE染色观察肺组织病理改变,应用实时荧光定量PCR及免疫印迹技术分别从mRNA和蛋白水平检测放射性肺损伤小型猪肺组织内TGF-β1、Smad2、Smad3和Smad7的表达情况,进一步从分子水平探讨肿节风的防护机制。
1. 实验动物及分组:本次实验动物为广西医科大学医学动物实验中心所提供的实验用巴马小型猪75只,雄性,年龄2~3个月,体重6.0~7.0 kg,动物合格证号:SCXK桂2009-0002;将小型猪按随机数字表法均分为健康对照组、单纯照射组、肿节风+照射组(药物+照射组)3组,每组25只。每个大组再平分为5个平行组,每组5只。
2.主要试剂和仪器:肿节风配方颗粒由广西培力药业有限公司提供,产品批号为A00884-01,规格为每瓶200 g,每克配方颗粒相当于5 g肿节风药材;TRIzol和引物(美国Invitrogen公司);ReverTra Ace反转录反应试剂盒和SYBR Green实时定量PCR试剂盒(日本Toyobo公司);兔抗猪TGF-β1、Smad2及Smad3多克隆抗体(美国Cell Signaling公司);羊抗猪Smad7多克隆抗体(美国Santa Cruz公司);HRP标记的鼠抗兔和鼠抗羊IgG二抗(北京晶美生物技术有限公司);硝酸纤维素膜及ECL化学发光试剂盒(美国Piecee公司);其他部分试剂由广西医科大学实验中心提供。酶标仪(Multiskan MK3,美国热电公司); Ultrospec3000紫外分光光度计(英国Pharmacia生物技术公司)。
3.给药及照射方法:药物+照射组于照射前1周开始按0.3 g·kg-1·d-1口服肿节风配方颗粒,至右肺被取出,健康对照组和单纯照射组予等量的生理盐水替代。
将小型猪用3%戊巴比妥钠(30 mg/kg体重)腹腔麻醉后摆成俯卧位并用真空袋固定,用常规X射线机模拟定位,用60Co(GWXJ80型,中国核动力研究设计院设备制造厂)γ射线对右肺进行照射,射野为9 cm×10 cm,源皮距为80 cm,吸收剂量率3 Gy/min,单纯照射组和药物+照射组小型猪右肺照射剂量均为15 Gy,健康对照组只给予麻醉,不予照射。
4.标本采集及处理:5个平行组分别于照后2、4、8、12及24周取右肺,-80℃保存。将上述各时间点取出的右肺组织制成组织蜡块,切片,HE染色,梯度乙醇脱水,透明,封固,镜下观察。
5.Real-time PCR检测肺组织TGF-β1、Smad2、Smad3及Smad7 mRNA表达水平:取各组不同时间点的小型猪右肺组织75 mg,按照TRIzol试剂说明书方法提取总RNA,用分光光度计检测RNA含量和纯度;取1 μl总RNA,采用ReverTra Ace反转录试剂盒将RNA反转录为cDNA,再用分光光度计检测cDNA浓度;取cDNA样品2 μl,按Real-time PCR试剂盒说明书用PCR仪进行扩增,40个循环。引物序列、产物长度及退火温度见表 1。每个样本重复3次实验,通过各样本的平均Ct值和△Ct值,计算2-△△Ct,其数值表示目的样本表达值相对于对照组表达值的相对倍数。
| 表 1 各基因实时PCR引物序列及相关参数 Table 1 Real-time PCR primer sequences and related parameters of genes |
6.Western blot检测肺组织TGF-β1、Smad2、Smad3及Smad7蛋白表达水平:取各组不同时间点的小型猪右肺组织100 mg放入10 ml EP管中,充分裂解并提取总蛋白后,采用二喹啉甲酸(BCA)法测定蛋白浓度。将各样本取0.5 ml按3∶1的体积比加入4×上样缓冲液,95℃加热3 min使蛋白质变性;各取30 μl样品和10 μl Marker分别加样,然后进行十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳。电泳完毕后,切出含有目的蛋白的凝胶,电转移到硝酸纤维素膜,用含5%脱脂奶粉和TBST缓冲液在室温下摇床上摇动封闭1 h后分别加入经稀释的TGF-β1、Smad2、Smad3和Smad7多克隆抗体(目的蛋白抗体为1∶200,β-肌动蛋白抗体为1∶2 000),室温摇动反应2 h,4℃冰箱中过夜;同上述方法准备二抗稀释液与膜接触,室温下在摇床上孵育1 h,取出硝酸纤维素膜,置于DAB显色液中显色,定影。分析显色后的硝酸纤维素膜,蛋白含量用Quantity One 4.62(美国Bio-Rad公司)成像软件进行图像分析,目的蛋白条带的灰度值与内参蛋白条带灰度值的比值表示目的蛋白的相对表达量,上述实验重复 3 次,取其均值。
7.统计学处理:应用SPSS 16.0软件进行数据处理,结果均用 ± s表示,各组数据间比较用ANOVA分析,组间两两比较用LSD-t检验,P<0.05为差异有统计学意义。
± s表示,各组数据间比较用ANOVA分析,组间两两比较用LSD-t检验,P<0.05为差异有统计学意义。
1.小型猪肺组织HE染色:健康对照组小型猪肺组织结构清晰,肺泡腔、肺泡壁完整,无炎症及纤维化表现;单纯照射组小型猪照射后第2周开始出现肺间质炎症改变,毛细血管扩张充血,少量炎性细胞浸润;照射后第4周肺泡间隔水肿增宽,肺泡腔及肺间质内炎性细胞浸润增多;照射后第8周,肺泡间隔明显增宽,肺泡壁明显增厚,肺泡腔内可见少量出血和纤维素样渗出;照射后第12周肺组织炎症逐渐加重,局部肺泡塌陷,肺泡间隔增宽伴融合,并可见大量炎性细胞浸润,小血管及毛细血管扩张充血,局部肺实变;照射后第24周,肺组织的渗出减少,病变以增生为主,肺间质内可见大量单核细胞浸润,局部可见散在分布条索状、旋涡状淡红染色的纤维素样病灶,肺部病变较严重;而药物+照射组各时间点肺组织病理改变均较单纯照射组减轻(图 1)。
 | 图 1 各组小型猪受照后不同时间肺组织病理改变 HE染色 ×100 Figure 1 Pathological changes of miniature pig lung tissues at different time after irradiation HE staining ×100 |
2. 小型猪肺组织内TGF-β1 mRNA及蛋白表达水平分析:如表 2、表 3和图 2所示,健康对照组TGF-β1 mRNA和蛋白始终保持在较低的表达水平,而药物+照射组和单纯照射组受照射后其表达水平持续升高,药物+照射组的上升趋势不及单纯照射组明显。单纯照射组与健康对照组比较,其mRNA和蛋白表达水平分别从照射后第2和4周开始差异有统计学意义(P < 0.05),而药物+照射组分别与健康对照组和单纯照射组比较,其表达水平均分别从照射后第4周和第8周起差异有统计学意义(P < 0.05),说明肿节风可以抑制放射性肺损伤后小型猪肺组织内TGF-β1 mRNA和蛋白表达。
| 表 2 肿节风对受照射后不同时间小型猪肺组织TGF-β1 mRNA表达水平的影响 Table 2 Effect of Sarcandra Glabra on the mRNA expression of TGF-β1 in miniature pig lung tissue at different time after irradiation |
| 表 3 肿节风对受照射后不同时间小型猪肺组织TGF-β1蛋白表达水平的影响 Table 3 Effect of Sarcandra Glabra on the protein expression of TGF-β1 in miniature pig lung tissue at different time after irradiation |
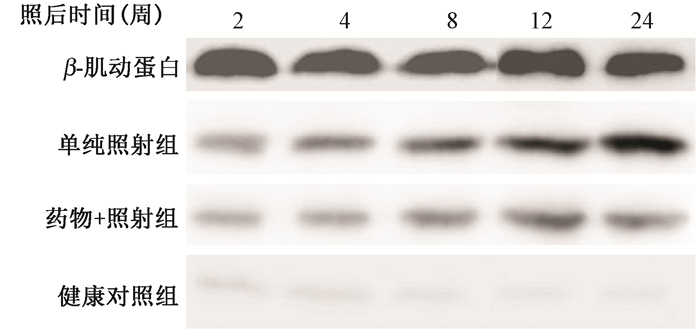 | 图 2 各组小型猪肺组织中TGF-β1蛋白的表达水平 Figure 2 The expressions of TGF-β1 protein in lung tissue of miniature pigs |
3. 小型猪肺组织内Smad2 mRNA及蛋白表达水平分析:如表 4、表 5和图 3所示,在整个实验过程中,健康对照组和药物+照射组Smad2 mRNA和蛋白表达一直处于较低水平,两组间mRNA表达水平在照射后第12周开始差异有统计学意义(P < 0.05),而其蛋白表达水平在各个观察点比较,差异均无统计学意义(P>0.05)。单纯照射组Smad2 mRNA和蛋白表达水平在实验后期,特别是照射后12周明显上升,分别与健康对照组和药物+照射组比较,差异均有统计学意义(P < 0.05),说明Smad2可能在放射性肺损伤后期才发挥作用,而肿节风可以明显抑制小型猪肺组织内Smad2 mRNA和蛋白表达。
| 表 4 肿节风对受照射后不同时间小型猪肺组织Smad2 mRNA表达水平的影响 Table 4 Effect of Sarcandra Glabra on the mRNA expression of Smad2 in miniature pig lung tissue at different time after irradiation |
| 表 5 肿节风对受照射后不同时间小型猪肺组织Smad2蛋白表达水平的影响 Table 5 Effect of Sarcandra Glabra on the protein expression of Smad2 in miniature pig lung tissue at different time after irradiation |
 | 图 3 各组小型猪肺组织中Smad2蛋白的表达水平 Figure 3 The expressions of Smad2 protein in lung tissue of miniature pigs |
4. 小型猪肺组织内Smad3 mRNA及蛋白的表达水平分析:如表 6、表 7和图 4所示,与健康对照组比较,单纯照射组和药物+照射组Smad3 mRNA的蛋白表达水平均分别从照射后第2周和第4周开始显著升高(P < 0.05),但第8周后上升趋势明显减弱;而单纯照射组和药物+照射组间在各个观察点差异均无统计学意义(P>0.05),说明在放射性肺损伤早期,Smad3 mRNA和蛋白表达明显升高,而在放射性肺损伤后期上升趋于平缓,且肿节风的干预对小型猪肺组织内Smad3 mRNA和蛋白表达无明显影响。
| 表 6 肿节风对受照射后不同时间小型猪肺组织Smad3 mRNA表达水平的影响 Table 6 Effect of Sarcandra Glabra on the mRNA expression of Smad3 in miniature pig lung tissue at different time after irradiation |
| 表 7 肿节风对受照射后不同时间小型猪肺组织Smad3蛋白表达水平的影响 Table 7 Effect of Sarcandra Glabra on the protein expression of Smad3 in miniature pig lung tissue at different time after irradiation |
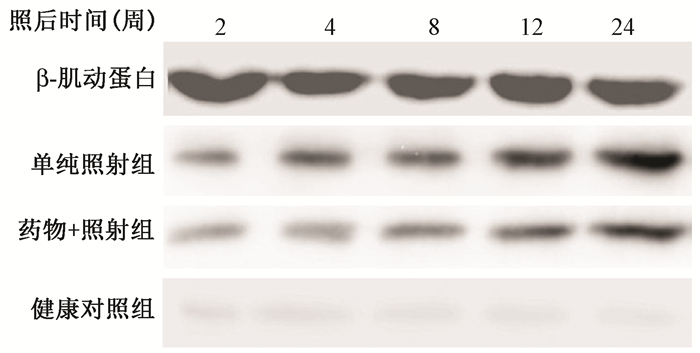 | 图 4 各组小型猪肺组织中Smad3蛋白的表达水平 Figure 4 The expressions of Smad3 protein in lung tissue of miniature pigs |
5. 小型猪肺组织内Smad7 mRNA及蛋白的表达水平分析:如表 8、表 9和图 5所示,健康对照组和单纯照射组Smad7 mRNA和蛋白表达始终保持在较低水平,但经肿节风干预后,药物+照射组的表达水平自从照射后就明显升高,与健康对照组比较,mRNA和蛋白水平分别从照后第2周和4周开始差异有统计学意义(P < 0.05);与单纯照射组比较,则均从照后第4周开始差异有统计学意义(P < 0.05);而单纯照射组与健康对照组比较均至照射后第24周才差异有统计学意义(P < 0.05),该结果说明,在放射性肺损伤的发生发展过程中,Smad7在Smad2与Smad3均过度表达时才开始表达,而肿节风可明显上调小型猪肺组织内Smad7 mRNA和蛋白表达。
| 表 8 肿节风对受照射后不同时间小型猪肺组织Smad7 mRNA表达水平的影响 Table 8 Effect of Sarcandra Glabra on the mRNA expression of Smad7 in miniature pig lung tissue at different time after irradiation |
| 表 9 肿节风对受照射后不同时间小型猪肺组织Smad7蛋白表达水平的影响 Table 9 Effect of Sarcandra Glabra on the protein expression of Smad7 in miniature pig lung tissue at different time after irradiation |
放射性肺损伤是胸部肿瘤放疗过程中最常见的并发症,亦是限制其应用最主要的因素。肺泡是其主要损伤的部位,早期病变主要是充血、水肿、炎性细胞浸润及肺泡腔塌陷和萎陷,晚期病变以肺泡间隔的进行性纤维化为主要特征。本研究采用不仅在解剖和生理方面与人类相近,而且单次照射的剂量-效应关系也与人类相似的小型猪作为实验对象[6]。通过HE染色发现,于照射后第2周开始出现放射性肺炎的病理改变,至第12周逐渐出现纤维化病变,说明成功地建立了小型猪放射性肺损伤模型。
TGF-β1在放射性肺损伤过程中发挥了重要作用,其与细胞的增殖、凋亡、活化、迁移、细胞外基质合成有密切关系,参与放射性肺损伤的各个环节[7],其生物学功能主要是通过TGF-β1/Smads信号通路转导来实现[8]。近年来,已有不少国内外研究证实了TGF-β1/Smads信号通路在系统性硬化症、皮肤纤维化、肝纤维化、肾纤维化和放射性肺纤维化等疾病的发生发展过程中发挥着重要的作用[9, 10, 11, 12, 13]。Meng等[12]研究发现在肾纤维化过程中,高度活化的Smad3通过E3-泛素连接酶依赖的降解机制抑制Smad7的表达,而这种Smad3与Smad7之间的失衡直接导致大量的肌成纤维细胞活化并聚集,分泌过量细胞外基质,从而导致进行性肾纤维化。因此,Smad7分子已被应用于各种肾纤维化动物模型的治疗。而另一个正向信号转导分子Smad2通过与Smad3竞争性抑制机制阻碍肾纤维化发展而发挥保护作用。Park等[13]通过合成TGF-β1受体ALK5的小分子抑制剂EW-7191作用于小鼠模型,然后检测胶原蛋白、α-平滑肌动蛋白、纤维连接蛋白、4-HNE等纤维化相关分子以及Smad2/3与p-Smad2/3的表达情况,结果发现EW-7191作为TGF-β1/Smad2/3信号通路的阻滞剂,可以通过阻碍其信号传导而在小鼠的肝、肾及肺纤维化过程中发挥抗纤维化作用。本研究发现,TGF-β1/Smads信号通路主要信号转导分子TGF-β1、Smad2、Smad3以及Smad7的mRNA和蛋白表达水平均随照射后时间延长而升高,其中TGF-β1和Smad3在照射后第2周就开始明显升高,而Smad2的蛋白表达水平从照射后第12周起才明显上升,Smad7的表达水平均在照射后第24周才与健康对照组有明显差异,因此,推测在放射性肺损伤的发展过程中,各信号分子扮演着不同的角色。TGF-β1启动信号通路并参与放射性肺损伤的全过程,Smad3可能偏向于在早期放射性肺炎阶段发挥作用,随着病情的发展,Smad2开始发挥竞争性抑制作用,Smad3表达上升开始减缓,所以Smad2更侧重于在晚期放射性肺纤维化过程中发挥功效。负反馈调节分子Smad7在正常生理状态或者放射性肺损伤早期时低表达,随着正向信号转导分子的过度表达和放射性肺损伤的进展,其表达水平才开始升高,并对TGF-β1/Smads信号转导通路发挥负向调控作用。
肿节风为金粟兰科植物草珊瑚的干燥全草,别名草珊瑚、九节茶、接骨金粟兰等,具有活血化瘀、消肿散结、凉血止血的功效。从西医角度具有镇痛、抗菌、抗肿瘤、抗氧化、抗辐射损伤、抑制炎症反应和血小板降低等广泛的药理活性[14, 15, 16]。前期研究发现,肿节风通过清除自由基、还原活性氧簇、改善氧化应激状况、减轻炎症反应对射线导致的小型猪腮腺损伤具有显著的防护作用[17, 18]。本研究中,经肿节风干预后,肺组织内TGF-β1/Smads信号通路上主要信号转导分子与单纯照射组比较,TGF-β1和Smad2的表达水平明显下降,Smad3的表达水平无明显变化,而Smad7的表达水平则明显升高,其中TGF-β1 mRNA和蛋白表达水平分别从照射后第4周和第8周起差异有统计学意义,Smad2 mRNA和蛋白表达水平分别从照射后第8周和第12周起差异有统计学意义,Smad7 mRNA和蛋白表达水平均从照射后第4周起差异有统计学意义。推测肿节风可能通过抑制TGF-β1过度表达,上调负反馈信号分子Smad7的表达,并在放射性肺损伤的后期抑制正向信号转导分子Smad2的表达,从而降低TGF-β1/Smads信号通路的转导效率,进而减少放射性肺损伤的发生率和减轻程度,最终发挥对小型猪放射性肺损伤的防护作用。
综上所述,肿节风在小型猪放射性肺损伤过程中通过调节TGF-β1/Smads信号通路上主要信号转导分子的表达水平而发挥放射防护作用,但由于肿节风成分复杂,而且本研究仅在蛋白和mRNA水平检测了各信号转导分子表达水平的变化,未行离体或基因敲除实验。因此,其确切的作用机制还有待于进一步的深入研究。
利益冲突 全体作者无学术纷争,所写内容均中立客观,不存在任何利益冲突 作者贡献声明 胡凯负责建立动物模型、部分实验操作及论文撰写;岳海英负责实时荧光定量PCR及蛋白免疫印迹;梁菲菲负责数据收集、统计分析;刘文其和王仁生负责整体实验设计、论文撰写指导及修改| [1] | Rübe CE, Rodemann HP, Rübe C. The relevance of cytokines in the radiation-induced lung reaction. Experimental basis and clinical significance[J]. Strahlenther Onkol, 2004, 180(9):541-549. DOI:10.1007/s00066-004-1279-1. |
| [2] | Zhao L, Wang L, Ji W, et al. Elevation of plasma TGF-beta1 during radiation therapy predicts radiation-induced lung toxicity in patients with non-small-cell lung cancer:a combined analysis from Beijing and Michigan[J]. Int J Radiat Oncol Biol Phys, 2009, 74(5):1385-1390. DOI:10.1016/j.ijrobp.2008.10.065. |
| [3] | Kim JY, Kim YS, Kim YK, et al. The TGF-β1 dynamics during radiation therapy and its correlation to symptomatic radiation pneumonitis in lung cancer patients[J]. Radiat Oncol, 2009, 4:59.DOI:10.1186/1748-717X-4-59. |
| [4] | Derynck R, Zhang YE. Smad-dependent and Smad-independent pathways in TGF-beta family signalling[J]. Nature, 2003, 425(6958):577-584.DOI:10.1038/nature02006. |
| [5] | 张雪燕,刘美莲,蒋健. 肿节风对小型猪放射性肺损伤的防护作用研究[J].中华放射医学与防护杂志, 2014, 34(3):180-184.DOI:10.3760/cma.j.issn.0254-5098. 2014.03.006. Zhang XY, Liu ML, Jiang J. Effect of Sarcandrae on radiation pneumonnopathy in miniature pigs[J]. Chin J Radiol Med Prot, 2014, 34(3):180-184.DOI:10.3760/cma.j.issn.0254-5098. 2014.03.006. |
| [6] | Hopewell JW, Rezvani M, Moustafa HF. The pig as a model for the study of radiation effects on the lung[J]. Int J Radiat Biol, 2000, 76(4):447-452. DOI:10.1080/095530000138439. |
| [7] | Prud'homme GJ. Pathobiology of transforming growth factor beta in cancer, fibrosis and immunologic disease, and therapeutic considerations[J]. Lab Invest, 2007, 87(11):1077-1091. DOI:10.1038/labinvest.3700669. |
| [8] | Lim MJ, Ahn J, Yi JY, et al. Induction of galectin-1 by TGF-β1 accelerates fibrosis through enhancing nuclear retention of Smad2[J]. Exp Cell Res, 2014, 326(1):125-135. DOI:10.1016/j.yexcr.2014.06.001. |
| [9] | Kajihara I, Jinnin M, Honda N, et al. Scleroderma dermal fibroblasts overexpress vascular endothelial growth factor due to autocrine transforming growth factor β signaling[J]. Mod Rheumatol, 2013, 23(3):516-524. DOI:10.1007/s10165-012-0698-6. |
| [10] | Kajihara I, Jinnin M, Makino T,et al. Overexpression of hepatocyte growth factor receptor in scleroderma dermal fibroblasts is caused by autocrine transforming growth factor β signaling[J]. Biosci Trends, 2012, 6(3):136-142. DOI:10.5582/bst.2012.v6.3.136. |
| [11] | Balta C, Herman H, Boldura OM,et al. Chrysin attenuates liver fibrosis and hepatic stellate cell activation through TGF-β/Smad signaling pathway[J]. Chem Biol Interact, 2015, 240:94-101. DOI:10.1016/j.cbi.2015.08.013. |
| [12] | Meng XM, Tang PM, Li J, et al. TGF-β/Smad signaling in renal fibrosis[J]. Front Physiol, 2015, 6:82. DOI:10.3389/fphys.2015.00082. |
| [13] | Park SA, Kim MJ, Park SY, et al. EW-7197 inhibits hepatic, renal, and pulmonary fibrosis by blocking TGF-β/Smad and ROS signaling[J].Cell Mol Life Sci, 2015, 72(10):2023-2039. DOI:10.1007/s00018-014-1798-6. |
| [14] | 南京中医药大学. 中药大辞典[M]. 2版.上海:上海科学技术出版社, 2006. Nanjing University of Chinese Medicine. Dictionary of traditional Chinese Medicine[M]. Second edition. Shanghai:Shanghai Scientific & Technical Publishers, 2006. |
| [15] | 冷永涛,吕圭源,陈素红.肿节风抗肿瘤相关作用及机制研究[J].中国现代药物应用, 2010, 4(6):232-234. DOI:10.3969/j.issn.1673-9523. 2010.06.220. Leng YT, Lv GY, Chen SH. Research related to the effectiveness of anti-tumor effect of Herba Sarcandrae[J]. Chin J Mod Drug App, 2010, 4(6):232-234. DOI:10.3969/j.issn.1673-9523. 2010.06.220. |
| [16] | 董伟,徐国良,张启云,等.肿节风的药理作用及其在血小板减少性疾病中的应用[J].中药药理与临床,2013,29(1):176-178. Dong W, Xu GL, Zhang QY, et al. Pharmacological effects of Sarcand Glabra and its application in thrombocytopenia[J]. Pharm Clin Chin Mat Med, 2013,29(1):176-178. |
| [17] | 张海东,王仁生,梁菲菲,等.肿节风颗粒对小型猪腮腺急性放射损伤防护作用的实验研究[J].时珍国医国药, 2011, 22(9):2075-2077.DOI:10.3969/j.issn.1008-0805.2011.09.007. Zhang HD, Wang RS, Liang FF, et al. Experimental Study on the Effect of Sarcandra glabra Particle on Acute Irradiation Injury in Parotid Gland of Miniature Pig[J]. Lishizhen Med Mat Med Res, 2011, 22(9):2075-2077.DOI:10.3969/j.issn.1008-0805.2011.09.007. |
| [18] | 秦俭,王仁生,滕家安,等.肿节风浸膏对腮腺急性放射损伤的作用[J].中华放射医学与防护杂志, 2008, 28(4):351-353.DOI:10.3760/cma.j.issn.0254-5098.2008.04.010. Qin J, Wang RS, Teng JA, et al. Experimental study on the effect of Sarcandra glabra extracts on radiation-induced acute injury to parotid gland[J]. Chin J Radiol Med Prot, 2008, 28(4):351-353.DOI:10.3760/cma.j.issn.0254-5098.2008.04.010. |
 2016, Vol. 36
2016, Vol. 36


