放射治疗是肿瘤治疗的重要手段,但放疗在杀死肿瘤细胞的同时可损伤周围正常组织,并出现一些特殊的、长期的放疗并发症。与肿瘤邻近的骨组织是比较常见的受照组织,可产生不同程度的骨损伤,导致增加骨折危险性。放疗后骨折发生率的增加多发生在前列腺癌、宫颈癌和子宫内膜癌等患者接受放疗后[1, 2, 3]。动物实验研究也显示,电离辐射照射后早期即可出现快速的骨量丢失,引起骨小梁微结构的破坏,最终导致骨密度下降与骨折危险性增加[4, 5]。电离辐射可致骨重建失衡,一些研究认为是以骨形成受阻为主要表现,另一些研究则认为照射后早期主要表现为骨吸收亢进,出现一过性的破骨细胞数量增加和活性增强,还有文献推测骨骼受照后出现的以破骨细胞过度活跃为特征的高骨转换率可能是由于细胞趋化因子如CX3CL1调控增加外周血单核细胞即破骨前体细胞募集启动分化有关[6, 7, 8]。但有关破骨细胞在电离辐射致骨重建失衡中的作用及机制报道不多,得到的研究结论也不一致[9, 10]。本实验选用易于获得的破骨细胞前体即人外周血单核细胞(human peripheral blood mononuclear cells,PBMCs),观察在离体培养条件下,电离辐射对破骨细胞分化潜能的影响,探讨PBMCs向破骨细胞分化诱导作为放射性骨质疏松症骨重建状态及疗效评估指标的可行性,为临床放射性骨代谢异常的有效防治提供参考。
1. 试剂和仪器:α-MEM培养基和胎牛血清(美国GIBCO公司),PBS、1%甲苯胺蓝(国产分析纯自配),人淋巴细胞分离液(上海华精生物高科技有限公司),RANKL、M-CSF(美国Peprotech公司),抗酒石酸酸性磷酸酶(TRAP)染色试剂盒(美国Sigma公司),TRAcP-5b ELISA试剂盒(美国R&D公司),RNA抽提及反转录试剂盒(北京天根生化科技有限公司),引物(上海生工生物公司),SYBR Premix EX Tag(大连宝生物工程公司),实时荧光定量PCR仪(瑞士Roche公司)。
2. 照射条件及方法:照射条件为137Cs γ辐射源,Gammacell 40(加拿大Nordion公司),放射源出厂活度为1.27×1014 Bq,吸收剂量率为0.75 Gy/min。照射方法为将培养板放入自封袋中密闭以免污染,装入托盘中带进137Cs源室,置于辐射源正下方,给予不同剂量的γ射线照射。
3. 人外周血单核细胞分离:招募10名健康志愿者,每人抽取肘部正中静脉血21 ml,其中1 ml用于血常规分析仪检查,白细胞计数均在正常范围。用等体积PBS混匀稀释抗凝血后,置于按1:1添加人淋巴细胞分离液的上层,水平离心机室温下1 000×g离心20 min,吸取中间白膜层到新的离心管中,至少按1:5添加PBS稀释,300× g离心10 min,再重复离心洗涤1次。弃上清液将沉淀细胞重悬,调整细胞密度至5×105/ml,接种于48孔板内。
4. 破骨细胞培养与诱导:将人外周血单核细胞接种4 h后换液,加入含RANKL(50 ng/ml)、M-CSF(25 ng/ml)的10% FBS α-MEM诱导液,诱导培养。
5. CCK-8法检测破骨细胞存活率:取人外周血单核细胞铺96孔板共6块,每块铺孔16个,铺板密度为2×105/孔,适应性培养24 h,给予不同剂量的γ射线照射,继续破骨细胞诱导培养,7 d后弃培养液每孔加CCK-8孵育液(100 μl无血清培养基+10 μl CCK-8溶液),同时设置调零孔(孔内无细胞),继续培养2 h后酶标仪读取吸光度(A值),计算细胞存活率。
6. TRAP染色及计数:破骨细胞诱导培养7 d,按TRAP染色试剂盒操作说明进行染色,冲洗晾干后显微镜下观察。每个培养孔随机选择10个视野(×200)光镜下观察,双人盲法独立计破骨细胞数,计数标准为含有3个及以上细胞核的TRAP染色阳性细胞,每组6个复孔,取其平均值。
7. 骨吸收陷窝及甲苯胺蓝染色:接种细胞于100 μm厚象牙骨片上10 d,取出骨片,2.5%戊二醛固定7 min,超声清洗3 min,乙醇梯度脱水各30 s,自然晾干,1%甲苯胺蓝室温染色5 min,去离子水洗净,光镜观察。
8. 破骨细胞相关基因表达:细胞经诱导培养7 d,收集细胞,按试剂盒方法提取总RNA,紫外分光光度计测定260 nm和280 nm处的光密度值,计算RNA溶液浓度和纯度。按试剂盒说明进行反转录和荧光实时定量PCR,以各组的GAPDH作为内参基因,用ΔΔCt法进行相对定量分析破骨细胞相关基因组织蛋白酶K和integrin β3的mRNA表达情况。引物序列见表 1。
| 表 1 引物序列 Table 1 Primer sequence |
9. 培养上清液中TRAcP-5b浓度:采用酶联免疫吸附(ELISA)双抗体夹心法试剂盒测定培养液上清中TRAcP-5b浓度。操作步骤按试剂盒说明书进行,用酶标仪在450 nm波长下测定吸光度(A值),通过标准曲线计算样品中蛋白浓度。
10. 统计学处理:采用SPSS 20.0统计软件,实验数据用 ± s表示,组间差异采用t检验进行比较。P<0.05为差异有统计学意义。
± s表示,组间差异采用t检验进行比较。P<0.05为差异有统计学意义。
1. 实验照射剂量的选择:为观察γ射线照射对细胞存活能力的影响,选取5个不同剂量(0.5、0.75、1、2、3 Gy)照射细胞。结果表明,小剂量(0.5、0.75 Gy)照射后细胞存活能力有一定增加,0.75 Gy照射组与对照组(0 Gy)相比,两组吸光度的差异有统计学意义(t=3.030,P<0.05)。但1 Gy以上剂量照射时,细胞存活能力有一定下降。后续实验中选择了0.75和2 Gy两个照射剂量观察电离辐射对破骨细胞分化潜能的影响。
2. 破骨细胞诱导与鉴定:诱导培养至第7天,倒置相差显微镜下可见多核细胞形成,细胞体积明显大于周边单核细胞,形态不一,有漏斗形、圆形或不规则形,并可见部分伪足。TRAP染色后光镜下观察显示,细胞核有几个至几十个不等,细胞质为紫红色颗粒样沉淀,可见部分伪足,即TRAP染色阳性;诱导培养至第10天时,取基质象牙骨片经甲苯胺蓝染色,光镜下观察显示骨吸收陷窝呈圆形或不规则形,大小不等,提示可体外诱导生成具有骨吸收能力的破骨样细胞,见图 1。
 | 图 1 人外周血单核细胞诱导后不同时间破骨样细胞形态及功能鉴定 ×200 A. 7 d,倒置相差显微镜;B. 7 d,TRAP染色; C. 10 d,骨吸收陷窝, 甲苯胺蓝染色 Figure 1 Morphological features and functional identification of osteoclast-like cells derived from PBMCs after induction different days ×200 A. At 7 d, inverted phase contrast microscope; B. At 7 d, TRAP staining; C. At 10 d, Bone resorption pits stained by toluidine blue |
3. γ射线对破骨样细胞数量的影响:0.75 Gy照射后TRAP阳性的多核破骨样细胞计数为(243±19)个,对照组(0 Gy)为(195±16)个,两组比较差异具有统计学意义(t=3.451,P<0.05);而2 Gy照射组TRAP阳性的多核破骨样细胞计数为(174±9)个,少于对照组,但差异无统计学意义(t=2.078,P>0.05),见图 2。
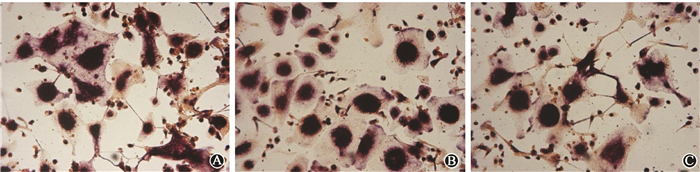 | 图 2 不同剂量γ射线对TRAP阳性多核细胞数量的影响 TRAP染色 ×200 A. 0 Gy; B. 0.75 Gy;C. 2 Gy Figure 2 Effect of different doses γ-rays irradiation on the number of TRAP positive multinucleated cells TRAP staining, ×200 A. 0 Gy; B. 0.75 Gy; C. 2 Gy |
4. γ射线对培养上清液中TRAcP-5b含量的影响:对照组(0 Gy)细胞培养上清液中TRAcP-5b浓度为(1.183±0.143) U/L,0.75 Gy照射组为(1.710±0.207) U/L,两组比较差异具有统计学意义(t=3.631,P<0.05);而2 Gy照射后细胞培养上清液中TRAcP-5b浓度为(1.003±0.177) U/L,较对照组(0 Gy)降低,但差异无统计学意义(t=1.372,P>0.05)。
5. γ射线对破骨细胞特征标志基因表达的影响:0.75和2 Gy γ射线照射人外周血单核细胞,经RANKL和M-CSF诱导培养7 d,行实时荧光定量PCR分析,观察电离辐射对破骨细胞特征标志基因组织蛋白酶K和integrin β3表达的影响。与对照组(0 Gy)相比,0.75 Gy照射组细胞组织蛋白酶K和integrin β3的mRNA表达明显升高,且差异有统计学意义(t=2.343、2.728,P<0.05);但2 Gy照射组细胞组织蛋白酶K和integrin β3的mRNA表达较对照组降低,尤其是integrin β3的mRNA表达下调明显,差异具有统计学意义(t=2.765,P<0.05),见表 2。
| 表 2 不同剂量γ射线对破骨细胞特征标志基因组织蛋白酶K和integrin β3 mRNA表达的影响 Table 2 Relative expression of osteoclasts characteristic marker genes Cathepsin K and integrin β3 at different doses |
骨代谢的动态平衡主要是由成骨细胞介导的骨形成过程和破骨细胞介导的骨吸收过程所决定,破骨细胞功能的变化将会导致骨重建异常。破骨细胞主要通过微环境的酸化和分泌酶来完成对骨矿盐和骨有机质的降解,其中组织蛋白酶K和integrin β3在破骨细胞的骨吸收过程中发挥着重要的作用[11]。组织蛋白酶K在破骨细胞中高度选择性表达,在酸性条件下激活,是对Ⅰ胶原等骨有机质成分进行降解的主要成分。而上述骨降解发生的前提是破骨细胞与骨基质之间形成封闭区,integrin β3参与破骨细胞的迁移黏附,介导封闭区的形成。
本研究观察不同剂量γ射线照射对人外周血单核细胞向破骨细胞分化潜能的影响,发现γ射线对破骨细胞分化潜能的影响可能表现为双向效应,1 Gy以下剂量(0.75 Gy)照射后可观察到TRAP阳性多核破骨样细胞数量的明显增加,并伴随有破骨细胞特征标志基因组织蛋白酶K和integrin β3表达的升高,且细胞培养上清液中TRAcP-5b浓度也明显增加。表明小剂量照射可增加人外周血单核细胞向破骨样细胞的分化潜能,但较大剂量(2 Gy)γ射线照射后,TRAP阳性多核破骨样细胞数量、特征标志基因和细胞培养上清液中TRAcP-5b浓度均有不同程度下降。可能是由于受到较大剂量照射后细胞存活能力下降所致。
Yang等[12]研究显示,2 Gy的γ射线照射后RAW 264.7细胞的integrin β3和RANK mRNA表达升高、CTR mRNA表达减少,但是在有RANKL诱导RAW 264.7的情况下,integrin β3和RANK mRNA表达降低,CTR mRNA表达升高,从而认为电离辐射可以促进破骨细胞前体细胞的增殖和成熟,增加其活性,但是对破骨细胞的增殖、成熟和活性却具有抑制作用。然而,刘华清[13]研究却发现,在RANKL诱导RAW 264.7分化为破骨细胞的过程中,给予1~4 Gy的γ射线照射可以直接促进破骨前体细胞RAW 264.7分化形成破骨细胞,并且与剂量呈正相关,其机制可能是通过升高细胞内ROS和Ca2+水平,进而间接促进破骨细胞的分化。
骨重建状态标志物主要是以胶原裂解产物和代表破骨细胞活性的TRAcP-5b为指标,虽然可在血或尿中监测和追踪,但灵敏度不够,且变异性大。选择和建立合适的骨代谢标志物以实时监测骨重建状态,有助于确定临床干预的合适时间点,以保护骨代谢平衡。目前的研究证明,外周血单核细胞在M-CSF和RANKL存在的条件下可体外诱导生成破骨细胞,其数量和活性,以及相关基因和蛋白表达改变可作为监测骨吸收活性的有效指标。结合骨密度和骨代谢生化指标的相关性分析,可实时监测骨重建状态,可望成为骨质疏松及其骨折发生发展中骨重建状态及临床疗效评估的新型指标。
综上,目前电离辐射对破骨细胞的研究主要集中在效应方面,有关电离辐射对破骨细胞影响的分子机制尚不明确。另外,对电离辐射照射后成骨与破骨、成骨与免疫系统,以及破骨与免疫系统之间耦联关系的研究,有助于解释电离辐射致骨重建失衡的机制,有望为临床放疗后骨质疏松和骨折的预防提供可行的药理靶向,有效防治和降低放疗后的骨丢失和骨折危险。
利益冲突 本研究未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证 作者贡献声明 陈军祥,参与实验、收集数据后统计并起草论文;朱国英,设计研究方案,指导、监督试验进行,修改论文;王建平,参与、指导细胞实验;翟江龙,负责辐射源的安全与防护、γ射线的照射| [1] | Shih KK, Folkert MR, Kollmeier MA, et al. Pelvic insufficiency fractures in patients with cervical and endometrial cancer treated with postoperative pelvic radiation[J]. Gynecol Oncol,2013,128(3):540-543. DOI:10.1016/j.ygyno.2012.12.021. |
| [2] | Tokumaru S, Toita T, Oguchi M, et al. Insufficiency fractures after pelvic radiation therapy for uterine cervical cancer:an analysis of subjects in a prospective multi-institutional trial, and cooperative study of the Japan Radiation Oncology Group (JAROG) and Japanese Radiation Oncology Study Group (JROSG)[J]. Int J Radiat Oncol Biol Phys,2012,84(2):e195-e200. DOI:10.1016/j.ijrobp.2012.03.042. |
| [3] | Elliott SP, Jarosek SL, Alanee SR, et al. Three-dimensional external beam radiotherapy for prostate cancer increases the risk of hip fracture[J]. Cancer,2011,117(19):4557-4565. DOI:10.1002/cncr.25994. |
| [4] | Jia D, Gaddy D, Suva LJ, et al. Rapid loss of bone mass and strength in mice after abdominal irradiation[J]. Radiat Res,2011,176(5):624-635. DOI:10.1667/RR2505.1. |
| [5] | Kondo H, Searby ND, Mojarrab R, et al. Total-body Irradiation of postpubertal mice with 137Cs acutely compromises the microarchitecture of cancellous bone and increases osteoclasts[J]. Radiat Res,2009,171(3):283-289. DOI:10.1667/RR1463.1. |
| [6] | He J, Qiu W, Zhang Z, et al. Effects of irradiation on growth and differentiation-related gene expression in osteoblasts[J]. J Craniofac Surg,2011,22(5):1635-1640. DOI:10.1097/SCS.0b013e31822e5f66. |
| [7] | Willey JS, Livingston EW, Robbins ME, et al. Risedronate prevents early radiation-induced osteoporosis in mice at multiple skeletal locations[J]. Bone,2010,46(1):101-111. DOI:10.1016/j.bone.2009.09.002. |
| [8] | Han KH, Ryu JW, Lim K, et al. Vascular expression of the chemokine CX3CL1 promotes osteoclast recruitment and exacerbates bone resorption in an irradiated murine model[J]. Bone,2014,61(4):91-101. DOI:10.1016/j.bone.2013.12.032. |
| [9] | Willey JS, Lloyd SAJ, Robbins ME, et al. Early increase in osteoclast number in mice after whole-body irradiation with 2 Gy X rays[J]. Radiat Res,2008,170(3):388-392. DOI:10.1667/RR1388.1. |
| [10] | Sawajiri M, Mizoe J, Tanimoto K. Changes in osteoclasts after irradiation with carbon ion particles[J]. Radiat Environ Biophys,2003,42(3):219-223. DOI:10.1007/s00411-003-0204-9. |
| [11] | Nakamura I, Takahashi N, Jimi E, et al. Regulation of osteoclast function[J]. Mod Rheumatol, 2012,22(2):167-177. DOI:10.1007/s10165-011-0530-8. |
| [12] | Yang B, Zhou H, Zhang XD, et al. Effect of radiation on the expression of osteoclast marker genes in RAW264.7 cells[J]. Mol Med Rep,2012,5(4):955-958. DOI:10.3892/mmr.2012.765. |
| [13] | 刘华清. γ电离辐射对破骨细胞代谢的效应及机理研究[D]. 苏州大学, 2012. DOI:10.7666/d.y2134222. Liu HQ. Study on effect and mechanism of γ ionizing radiation on osteoclastic metabolism[D]. Suzhou University,2012. DOI:10.7666/d.y2134222. |
 2016, Vol. 36
2016, Vol. 36


