乳腺癌是女性最常见的恶性肿瘤,全球乳腺癌发病率几乎以每年2%的速度递增,我国乳腺癌发病率及死亡率也均呈上升趋势。放射治疗是乳腺癌综合治疗的重要组成部分,也是晚期乳腺癌患者姑息治疗的主要手段。研究表明,放疗作为术后辅助性治疗手段,可减少局部复发率和死亡危险[1]。然而,在放疗过程中,肿瘤细胞会通过多种机制产生放疗抵抗,从而影响放疗的疗效。
DNA修复能力直接影响细胞的放射敏感性,聚腺苷二磷酸核糖聚合酶-1(PARP-1)和乳腺癌易感基因(breast cancer susceptibility gene,BRCA)分别控制着DNA单链和双链的修复,在照射所致DNA损伤的修复过程中起到了关键的作用,直接影响到肿瘤细胞的敏感性[2]。而BRCA与乳腺癌发生和发展关系密切。BRCA基因突变的携带者在一生中有80%的乳腺癌患病可能性,分别有32%和13%的乳腺癌病例被认为与BRCA1和BRCA2的基因突变有关[3]。
本研究利用合成致死现象,观察PARP-1抑制剂3-氨基苯甲酰胺(3-AB)对于BRCA基因突变及非突变的乳腺癌细胞放射敏感性的影响,探讨PARP-1和BRCA基因在照射引起的乳腺癌细胞DNA损伤修复中的作用及调控机制,为提高BRCA突变和非突变乳腺癌的放射敏感性作有益探索。
1. 细胞培养与照射:BRCA突变细胞MDA-MB-436和BRCA非突变细胞MDA-MB-231(购于中国科学院典型培养物保藏委员会细胞库),用含有10%胎牛血清(美国GIBCO公司)及1%青霉素-链霉素(美国Hyclone公司)的改良型RPMI 1640培养液(美国Hyclone公司)于37℃、5%CO2培养箱内进行培养。细胞照射在室温下进行,实验中细胞照射采用6 MV X射线(瑞典医科达直线加速器)照射,源瘤距SSD=100 cm,剂量率200 cGy/min。
2. 主要试剂:PARP-1抑制剂3-amino benza-mide(3-AB)购于美国Sigma公司,Annexin V-FITC凋亡试剂盒购于江苏南京碧波公司,鼠抗人单克隆抗体γ-H2AX和Cy3-羊抗鼠单克隆抗体购于美国Cell Signal公司。
3. 流式细胞仪检测细胞凋亡:将细胞分为对照组(CTRL组)、单纯药物组(3-AB组,10 mmol/L)[4]、单纯照射组(IR组,8 Gy)以及药物联合照射组(3-AB+IR组),分别种植在6孔板内,进行相应处理(药物处理为3-AB 10 mmol/L,照射方法参照前述的的照射方案),48 h后将细胞用PBS冲洗后消化,然后以1 500 r/min,离心半径10 cm离心 5 min,去上清,将沉淀的细胞用PBS洗涤2次,然后用500 μl结合液重悬细胞,加入5 μl的Annexin V-EGFP混匀,再加入5 μl碘化丙啶(PI)混匀,室温避光孵育10 min后,进行流式细胞仪(美国BD公司)检测。
4. 克隆形成实验:将细胞消化之后分别以每孔200、400、1 000、2 000、4 000、8 000个细胞种在6孔板内,细胞贴壁后加3-AB或者不加3-AB(药物加入培养基中,并在细胞培养过程中维持相同浓度),然后以0、2、4、6、8、10 Gy的剂量对细胞进行照射,14 d后,将细胞用4%多聚甲醛固定30 min,然后用0.1%结晶紫进行染色,镜下观察计数,细胞数>50记为一个克隆。利用GraphPad Prism 5软件对数据进行分析,通过单击多靶模型拟合剂量存活曲线,SF=1-(1-e-D/D0)N。式中,SF为细胞存活分数;D为照射剂量;e为自然对数底;D0为平均死亡剂量;N为外推值,最后通过SF2计算放射增敏比(SER)。
5. γ-H2AX免疫荧光实验:将细胞消化之后种植在铺有圆玻片的24孔板内,每孔1×105细胞,细胞贴壁后加药或者不加药处理,然后照射0或2 Gy剂量。照射后1 h收集细胞,PBS冲洗3次后,用4%多聚甲醛4℃固定15 min,再用PBS冲洗3次后,用0.2%的Triton-X 100于4℃破膜15 min,PBS冲洗3次后,使用5%BSA封闭1 h,然后加入鼠抗γ-H2AX一抗(1∶1 000,1%BSA配制)4℃孵育过夜,在用PBS冲洗3次后,孵育Cy3标记羊抗鼠二抗(1∶500,1%BSA配制)1 h,最后用PBS冲洗3次,封片,荧光显微镜下观察、计数。
6. 统计学处理:所有的实验数据至少重复3次独立实验,数据以 ± s形式表示。采用SPSS 16.0软件进行分析。不同的处理组以及不同细胞之间比较均使用t检验。P<0.05为差异有统计学意义。
± s形式表示。采用SPSS 16.0软件进行分析。不同的处理组以及不同细胞之间比较均使用t检验。P<0.05为差异有统计学意义。
1. PARP-1抑制剂3-AB对MDA-MB-436和MDA-MB-231细胞凋亡的影响:结果列于表 1。由表 1可知,在两组细胞中,单纯药物组对两种细胞凋亡率无明显影响,与对照组相比,照射能导致两组细胞凋亡,且在相同剂量照射下,MDA-MB-436细胞凋亡率明显高于MDA-MB-231细胞,差异有统计学意义(t=2.96,P<0.05);同组细胞内,可见药物联合照射组较单纯照射组,其凋亡率明显增高,差异有统计学意义(t=3.81,P<0.05),特别是MDA-MB-436细胞凋亡增加更加明显。
| 表 1 照射和3-AB处理后MDA-MB-436和MDA-MB-231细胞的凋亡情况 Table 1 The apoptosis of MDA-MB-436 and MDA-MB-231 cells administered with radiation and 3-AB |
2. 3-AB对两种细胞放射敏感性的影响:经不同处理后,细胞用不同剂量进行照射拟合单击多靶模型,实验结果显示,MDA-MB-436细胞的D0、Dq、N、SER、SF2值均较MDA-MB-231细胞小,细胞存活曲线肩区变窄,提示BRCA突变乳腺癌细胞放射敏感性较BRCA非突变乳腺癌细胞增高。经不同处理后,细胞用不同剂量进行照射,结果显示,与单纯照射组相比,联合用药组的存活曲线肩区变小变窄,D0、Dq、N值均减小,提示PARP-1抑制剂3-AB可以增加BRCA非突变乳腺癌细胞(MDA-MB-231)和BRCA突变乳腺癌细胞(MDA-MB-436)的放射敏感性,MDA-MB-436细胞放射敏感性的增加更为明显(图 1)。
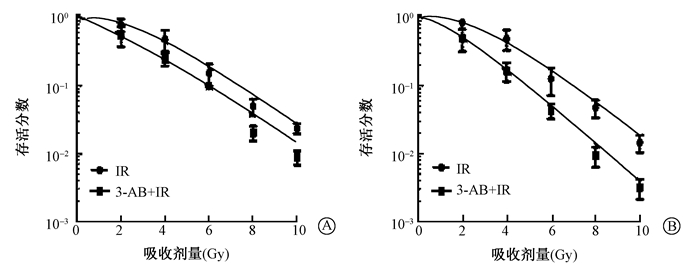 | 注:IR.单纯照射组; 3-AB+IR.药物联合照射组图 1 MDA-MB-231细胞(A)和MDA-MB-436细胞(B)的细胞生存曲线 Figure 1 Survival curves of MDA-MB-231 cells (A) and MDA-MB-436 cells (B) |
3. 两种细胞DNA双链断裂(DNA-DSB)的差异:分别对两组细胞给予或不给予2 Gy射线照射,照射后1 h免疫荧光检测核内γ-H2AX焦点形成情况。结果发现在两组细胞中,单纯药物组对两种细胞焦点数无明显影响。与空白对照组相比,照射能导致细胞DNA双链断裂,且在相同剂量照射下,MDA-MB-436细胞焦点数明显高于MDA-MB-231细胞(t=4.57,P<0.05);同组细胞内,可见药物联合照射组较单纯照射组,其焦点数明显增高(t=3.26,P<0.05),特别是MDA-MB-436细胞DNA-DSB明显增加(图 2,表 2)。
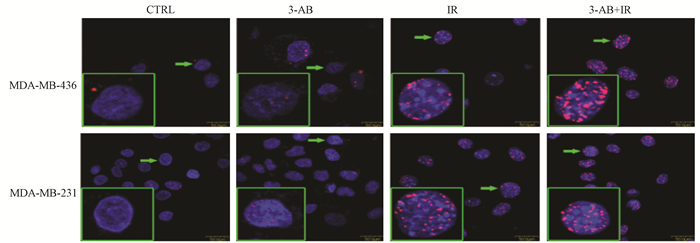 | 注:CTRL.空白对照组;3-AB.单纯药物组;IR.单纯照射组;3-AB+IR.药物联合照射组 图 2 MDA-MB-436和MDA-MB-231细胞在2 Gy X射线照射后1 h时γ-H2AX焦点形成情况 Figure 2 γ-H2AX foci in MDA-MB-436 and MDA-MB-231 cells detected 1 hour after 2Gy X-ray irradiation |
| 表 2 照射和3-AB处理后MDA-MB-436 细胞和MDA-MB-231细胞DNA-DSB情况 Table 2 The number of γ-H2AX foci in MDA-MB-436 and MDA-MB-231 cells treated with radiation and 3-AB |
放疗是乳腺癌综合治疗中不可缺少的部分,放射敏感性的不同导致了治疗效果的差异。如果照射导致的大量DNA双链破坏不能被修复,细胞则通过凋亡自我消亡。而PARP-1和BRCA分别控制着DNA单链和双链的修复,在照射所致DNA损伤的修复过程中起到了关键的作用,直接影响到肿瘤细胞的敏感性[5, 6]。
由于PARP-1在DNA修复中的重要作用,目前使用PARP-1抑制剂治疗肿瘤有两种方式,一是将PARP-1抑制剂作为针对DNA损伤的放疗或者化疗的增敏剂[7, 8];二是根据某些肿瘤特定的基因特性通过化学合成致死来造成DNA的损伤,但总体的治疗效果都不理想[9]。因此,本研究引入了合成致死现象,即当照射引起大量DNA链断裂损伤时,PARP-1被抑制与BRCA缺陷同时存在时会导致合成致死,其具体机制为:当细胞内PARP-1被抑制会引起细胞内部大量DNA-SSBs不能及时修复而堆积,未能被修复的SSB会引发此处的复制叉的崩解因而产生大量的DSB,这些有着很强细胞毒性的DSB在正常细胞内可以通过BRCA基因参与介导的同源重组(homologous recombination,HR)的DNA的修复途径进行及时准确的修复,而在BRCA突变细胞内,由于缺乏HR这一重要修复途径,DSB无法修复或者由容易出错的非同源末端连接(non homologousend joining,NHEJ)进行修复,从而大大增加了细胞死亡的概率[10, 11]。
本研究联合PARP-1和BRCA两个关键基因,利用了天然BRCA突变的乳腺癌细胞来研究两个基因在照射后DNA损伤修复、细胞凋亡以及细胞放射敏感性中的作用。研究发现,照射后BRCA突变细胞MDA-MB-436较BRCA非突变细胞MDA-MB-231的DNA损伤、细胞凋亡及细胞敏感性明显增加,验证了BRCA基因在DNA损伤修复中的重要作用。而PARP-1抑制剂3-AB联合照射,进一步造成两种细胞,特别是BRCA突变细胞MDA-MB-436的DNA损伤、细胞凋亡及细胞敏感性,提示PARP-1抑制剂和电离辐射有协同作用,即当DNA单链和双链修复途径均被阻断后,SSB和DSB均不能得到及时修复,DNA损伤明显增加,表现为细胞的凋亡的增加,最后表现为细胞敏感性的增加。
因而,PARP-1抑制剂不仅可以作为一般肿瘤的放疗增敏剂,还可以作为专门针对某些有抑癌基因突变的肿瘤,例如BRCA突变乳腺癌的单用剂[6, 12],这将大大增加肿瘤治疗的效果。癌细胞的放射敏感性以及使其DNA损伤情况更加严重从而增大肿瘤细胞的凋亡率,这为通过使用PARP-1抑制剂来提高BRCA突变乳腺癌的放疗疗效提高理论指导。但目前就使用PARP-1抑制剂联合电离辐射提高乳腺癌的放疗疗效,仍有些问题需要解决,例如如何更好地选取抑制剂药物的浓度从而尽量避免药物的不良反应等,这些问题的解决,需要进一步深入地研究PARP-1抑制剂在BRCA突变乳腺癌细胞中的具体调控机制,大量的体外研究结果还需要通过动物实验及临床实验来进一步验证。
利益冲突 本文作者与单位没有因此项研究工作接受过第三方的资助或服务(包括但不限于专项研究资金、研究设计、稿件准备、统计分析等)。不存在与本工作职责相冲突的任何个人经济利益或非经济利益以及任何直接或间接的义务和责任可能影响或潜在影响稿件的内容 作者贡献声明 李龄和朱小东参与论文选题和设计,以及资料分析与解释;赵伟和殷雪参与了实验的具体操作和论文的起草;梁霞和曲颂参与了文稿的修改和指导;李烨参与了统计学分析| [1] | Early Breast Cancer Trialists' Collaborative Group, Darby S, McGale P, et al. Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death:meta-analysis of individual patient data for 10,801 women in 17 randomised trials[J]. Lancet,2011, 378(9804):1707-1716. DOI:10.1016/S0140-6736(11) 61629-2. |
| [2] | Matsuda Y, Tobari I. Radiosensitivity and effects of repair inhibitors for X-ray-induced chromosomal damage in mouse zygotes in S and G\-2 phases[J]. Int J Radiat Biol, 1995, 68(6):615-623. DOI:10.1080/09553009514551621. |
| [3] | Pristauz G, Petru E, Stacher E, et al. Androgen receptor expression in breast cancer patients tested for BRCA1 and BRCA2 mutations[J]. Histopathology,2010, 57(6):877-884. DOI:10.1111/j.1365-2559.2010.03724.x. |
| [4] | 房兴锐, 黄恺, 黄丹, 等. 1型多聚ADP核糖聚合酶激活NF-κB途径调节基质金属蛋白酶活性的机制研究[J]. 临床心血管病杂志, 2009,25(6),472-475. DOI:10.7666/d.d084358. Fang XR,Huang K,Huang D, et al. Poly (ADP-ribose) polymerase-1 increases the enymatic activities of MMPs via NF-κB pathway in cultured cardiac fibroblasts[J]. J Clin Cardiol(China), 2009, 25(6):472-475. DOI:10.7666/d.d084358. |
| [5] | Michael S, Michael H, Seda A, et al. A nuclear poly (ADP-ribose)-dependent signalosome confers DNA damage-induced IκB kinase activation[J]. Mol Cell,2009, 36(3):365-378. DOI:10.1016/j.molcel.2009.09.032. |
| [6] | Bryant HE, Schultz N, Thomas HD, et al. Specific killing of BRCA2-deficient tumours with inhibitors of poly(ADP-ribose) polymerase[J]. Nature, 2005, 434(7035):913-917. DOI:10.1038/nature03443. |
| [7] | 杜翔, 王志成, 王华, 等. PARP抑制剂3-AB的辐射致敏作用及其机制[J]. 中华放射医学与防护杂志, 2007, 27(4):409-410. DOI:10.3760/cma.j.issn.0254-5098.2007.04.034. Du X, Wang ZC, Wang H, et al. The effectiveness of radiosensitization of PARP inhibitor 3-AB and the mechanism[J]. Chin J Radiol Med Prot, 2007, 27(4):409-410. DOI:10.3760/cma.j.issn.0254-5098.2007.04.034. |
| [8] | Khan K, Araki K, Wang D, et al. Head and neck cancer radiosensitization by the novel poly (ADP-ribose) polymerase inhibitor GPI-15427[J]. Head Neck,2010,32(3):381-391. DOI:10.1002/hed.21195. |
| [9] | Simons A, Dafni N, Dotan I, et al. Establishment of a chemical synthetic lethality screen in cultured human cells[J]. Genome Res,2001,11(2):266-273. DOI:10.1101/gr.154201. |
| [10] | Iglehart JD, Silver DP. Synthetic lethality-a new direction in cancer-drug development[J]. N Engl J Med, 2009, 361(2):189-191. DOI:10.1056/NEJMe0903044. |
| [11] | Guha M. PARP inhibitors stumble in breast cancer[J]. Nat Biotechnol, 2011, 29(5):373-374. DOI:10.1038/nbt0511-373. |
| [12] | Farmer H, McCabe N, Lord CJ, et al. Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy[J]. Nature, 2005, 434(7035):917-921. DOI:10.1038/nature03445. |
 2016, Vol. 36
2016, Vol. 36


