调强放射治疗(IMRT)在提高靶区适形度的同时,保护危及器官,控制肿瘤的复发,改善患者生活质量,已成为鼻咽癌的主要放疗方式。但是,IMRT在实际治疗过程中存在一定的缺陷,随着剂量的增加,原发灶、转移淋巴结体积和腮腺体积逐渐减小,靶区剂量覆盖发生变化,腮腺的受照射剂量逐渐增加[1,2]。研究认为,鼻咽癌IMRT在第15次放疗至第25次期间是重新计划的最佳时期,具体在何时修正计划仍然存在较大的争议[3,4]。造成的原因与不同分期鼻咽癌病例的选择,不同医师之间勾画靶区存在一定差异[5]。因此,本研究将30例实施IMRT治疗的鼻咽癌患者根据淋巴结直径大小分组,每例患者每周获得1次CT,探讨鼻咽癌调强放疗中,不同淋巴结转移状况的腮腺和肿瘤靶区体积退缩与受照剂量的相关性,以便确定重新计划的最佳时间。
1. 一般临床资料:选取2014年8月至2015年6月在广州医科大学附属肿瘤医院治疗的30例鼻咽癌患者。入组标准为病理确诊鼻咽癌,无远处转移;鼻咽及上颈均行IMRT。其中,男18例,女12例;年龄24~65岁,中位年龄46岁。按照福州分期标准进行分期[6],临床分期Ⅰ、Ⅱ、Ⅲ、和Ⅳa期患者分别为3、7、12和8例。将30例患者根据颈部淋巴结直径大小将患者分为3组,分别是淋巴结阴性组(A组)、淋巴结≤3 cm阳性组(B组)、淋巴结>3 cm阳性组(C组)。本研究经广州医科大学附属肿瘤医院伦理委员会讨论批准,入组患者均签署知情同意书。
2. 体位固定及CT 扫描:全部患者仰卧位躺于平板床上,热塑面罩固定,采用德国西门子公司生产的CT Vision滑轨CT加速器进行扫描,系统40排82 cm大孔径CT行鼻咽部图像扫描。扫描参数,层厚3 mm,层间距3 mm,矩阵512×512,扫描范围从头顶至锁骨下缘下3 cm。图像同步传到瑞典RaySearch公司生产的Raystation系统进行计划设计。
3. 计划设计:结合患者的MRI勾画靶区及敏感器官,包括影像学及临床检查可见的原发肿瘤区(GTVnx)、颈部转移淋巴结(GTVnd)、高危预防区域(CTV1)、低危预防区域(CTV2)。正常组织勾画包括腮腺、脊髓、脑干、视交叉、视神经、眼球、眼晶状体、垂体、下颌骨、颞颌关节和口腔。所有调强计划均在Raystation计划系统中进行,IMRT采用9野共面设计,0~360°等角度分布。处方剂量GTVnx为70 Gy,GTVnd为68 Gy,CTV1为66 Gy,CTV2为54 Gy,5次/周,共32次。危及器官剂量限制条件为脊髓≤45 Gy,脑干≤54 Gy,50%腮腺体积剂量≤30 Gy,眼晶状体≤8 Gy。利用剂量体积直方图(DVH)评估靶区和危及器官的受照剂量。
4. 重新CT扫描及靶区勾画:所有患者都在CT Vision系统下进行调强放疗。初始定位CT命名为CT0,每例患者在同一体位下每周重新扫描一次CT,即患者第5、10、15、20、25和32次治疗前行日常验证扫描图像,获得CT1、CT2、CT3、CT4、CT5、CT6。扫描参数与定位CT扫描一致,每次扫描时间2~3 min。将每次获得的CT图像传入Raystation计划系统,由同一个放疗医师手动勾画靶区。整个治疗过程和CT扫描都经患者同意,签署知情同意书。
5. 统计学处理:数据用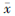 ±s表示。采用SPSS 19.0软件进行分析,组间数据和组内数据比较采用两独立样本t检验。P内分析比较结果显示,组内分次体积与0.05为差异有统计学意义。
±s表示。采用SPSS 19.0软件进行分析,组间数据和组内数据比较采用两独立样本t检验。P内分析比较结果显示,组内分次体积与0.05为差异有统计学意义。
1. 腮腺体积变化:各组患者左、右腮腺在每次CT扫描时的体积变化列于表 1和2。由表 1可知,A、B、C 3组左腮腺平均体积最终分别缩小了(各组内放疗结束时腮腺最终体积CT6与初始体积CT0相比)28.54%、42.00%、41.28%(t=3.27、4.11、4.83,P内分析比较结果显示,组内分次体积与0.05)。由表 2可知,3组右侧腮腺分别缩小了28.0%、42.9%、42.8%(t=2.80、3.87、5.20,P内分析比较结果显示,组内分次体积与0.05)。
| 表 1 各组左腮腺体积变化 Table 1 Volume changes in left parotid gland |
| 表 2 各组右腮腺体积变化 Table 2 Volume changes in right parotid gland |
组间进行比较分析,CT0显示3组腮腺初始体积大小差异没有统计学意义(P>0.05);与A组相比,在CT4以后,B组的腮腺体积开始缩小,差异有统计学意义(t=2.12~2.46,P内分析比较结果显示,组内分次体积与0.05);C组CT2以后体积差异有统计学意义(t=2.19~3.40,P内分析比较结果显示,组内分次体积与0.05);B、C两组之间体积随着放疗次数增加,体积变化趋势差异一直没有统计学意义。
组内分析比较结果显示,组内分次体积与初始体积CT0相比,A组和B组在CT3以后体积缩小程度差异有统计学意义(t=2.16~4.11,P<0.05);C组在CT2以后差异就有统计学意义(t=2.37~5.20,P<0.05),且CT4与CT2比较,差异也具有统计学意义(t=2.16、3.34,P<0.05)。CT4~CT6期间(患者第20次放疗直到放疗结束期间)腮腺体积缩小不明显。
2. 肿瘤靶区的体积变化:各组患者GTVnx、GTVnd每次CT扫描时的体积变化如表 3所示。A、B、C 3组GTVnx体积分别最终缩小了(各组内CT6与CT0相比)45.5%、39.4%、37.4%(t=2.67、2.34、3.50,P<0.05)。B组左、右GTVnd最终减小77.3%、84.8%(t=2.73、2.71,P<0.05),C组左、右GTVnd分别减小75.45%、69.9%(t=2.63、3.12,P<0.05)。
| 表 3 各组GTVnd和GTVnx体积变化 Table 3 Volume changes in GTVnx and GTVnd |
| 表 4 各组腮腺初始计划受照剂量 Table 4 Exposure dose of parotid in the initial plan |
与初始体积CT0相比,各组GTVnx、GTVnd在CT4之后,体积缩小程度差异开始具有统计学意义(t=2.36、2.25、2.32、2.54、2.27、2.12、2.65,P<0.05);CT4~CT6期间(患者第20次放疗直到放疗结束期间)GTVnx、GTVnd缩小不明显。各组GTVnx、GTVnd之间相比较,缩小程度和变化趋势的差异均无统计学意义。
3. A、B、C组腮腺初始计划受照剂量的比较:B组左、右侧腮腺平均剂量(Dmean)、50%体积所受的剂量(D50%)、受照剂量超过30 Gy的体积(V30)均高于A组(t=-3.08、-2.29、-2.18、-2.11、-2.15、-2.23,P<0.05);C组左、右侧腮腺Dmean、D50%、V30同样高于A组(t=-3.10、-2.13、-2.15、-3.20、-2.60、-2.50,P< 0.05)。
鼻咽癌放疗过程中腮腺体积会随着放疗次数的增加而不断减小。黄慧娴[7]的研究结果显示,左右侧腮腺体积在放疗结束时分别减少39.8%±14.4%和37.4%±15.5%。本研究结果与此基本相符,A、B两组放疗15次后体积缩小程度差异具有统计学意义,C组10次放疗后体积变化就有差异,说明C组腮腺体积变化更明显。3组20次放疗以后,腮腺体积变化都不明显。黄劭敏等[8]研究同样表明,肿瘤靶区和腮腺退缩等结构改变,在疗程的前4周更加显著,后半程体积变化无明显差异。Barker等[9]研究14例头颈放疗的患者,发现腮腺体积前1/3治疗时间段较后2/3 治疗时间段缩小更为明显。
本研究通过组间分析,放疗前3组腮腺初始体积没有差异,而随着放疗次数的增加,A、B两组之间在第20次放疗后体积变化差异具有统计学意义,A、C两组在第10次放疗后就具有差异,两结果同时说明淋巴阳性(B、C组)的患者跟阴性(A组)的相比,腮腺体积变化具有差别,而且淋巴结直径越大的患者,腮腺体积变化可能更明显。Wang等[10]发现高剂量区(>30 Gy)的腮腺体积比低剂量区的下降明显,得出腮腺体积下降与腮腺的平均照射剂量强相关。本研究证实,淋巴结阳性患者的腮腺平均受照剂量、受照剂量体积都比阴性患者的要高,所以腮腺体积变化更快。B、C两组之间从放疗开始一直到放疗结束,腮腺体积变化差异均无统计学意义,其中的原因可能有两个,腮腺受照剂量不但受淋巴的影响,同时还受鼻咽部肿瘤的影响,特别是肿瘤向口咽方向侵犯的患者;C组患者入组的标准是一侧淋巴结>3 cm,但是有些患者对侧淋巴结是阴性,B组患者入组的标准是淋巴结阳性,且直径≤3 cm,但是有患者两侧都有阳性淋巴结,所以导致两组腮腺平均受照剂量差异不大,从而体积变化差异无统计学意义。
GTVnx和GTVnd随着放疗次数增加,两者不断减小。Nishi等[11]研究发现放疗中期(放疗15次)GTVnx和GTVnd分别平均缩小37.1%和47.6%。Barker等[9]表明治疗结束时,GTVnx中位体积相比于初始体积平均缩小69.5%,本研究结果与以上研究结果大致相同。GTVnx和GTVnd缩小情况都是在放疗20次以后开始,差异具有统计学意义,后半程(第20次放疗直到放疗结束)体积变化不明显,与黄劭敏等[8]研究结果大致相同。通过组间的比较,GTVnx、GTVnd缩小程度差异没有统计学意义,说明淋巴结直径大小对淋巴结本身、和鼻咽部肿瘤缩小程度影响不大。分析其中的原因可能是,鼻咽癌的局部控制率与靶体积的照射剂量呈正相关[12],照射剂量越高,肿瘤缩小更明显,从而局部控制率更好。本研究入组的所有患者GTVnx、GTVnd给予的处方剂量相同,所以靶体积缩小程度相同;患者每周获得的CT,都未做增强扫描,这样某种程度上影响了放疗医师对肿瘤边界判断。
本研究也存在不足之处,在研究鼻咽癌调强放疗中解剖体积的变化,CT Vision相对以往学者研究用锥形束CT(CBCT)图像更为清晰,但是本研究未做增强扫描,这样会影响肿瘤靶区的确定,也是考虑到每周利用造影剂患者不愿接受,而且频繁利用造影剂也不适合临床大规模推广。本研究主要探讨淋巴结大小对腮腺体积变化的影响,未考虑鼻咽部肿瘤对腮腺的影响,特别是鼻咽肿瘤向口咽方向侵犯的患者,腮腺的平均受照剂量也相对较高。本研究鼻咽癌放疗中淋巴直径大小对解剖体积的影响,还未研究其对靶区和腮腺等危及器官剂量学的影响,这也是下一步正在研究的课题。
综上所述,随着放疗次数的增加肿瘤靶区和腮腺体积不断减小,临床有必要重新计划。出于保护腮腺的考虑,淋巴结较大的患者有必要提前修改计划,建议在第10次放疗重新计划,可能在第20次放疗需要再次计划,淋巴结阴性或者很小的患者建议在第15次修改计划。
利益冲突 本研究不涉及影响研究结果的财务关系
作者贡献声明 周祥、张书旭、王锐濠负责论文撰写和修改;张书旭、林生趣负责提出研究思路、设计研究方案;周祥、雷怀宇、蒋绍惠负责进行试验;邓瑾、周露、张国前负责整理和分析数据
| [1] | Lu N, Feng LC, Cai BN, et al. Clinical study on the changes of the tumor target volume and organs at risk in helical tomotherapy for nasopharyngeal carcinoma[J]. Chin Med J, 2012, 125(1):87-90. |
| [2] | Schwartz DL, Garden AS, Shah SJ, et al. Adaptive radiotherapy for head and neck cancer-dosimetric results from a prospective clinical trial[J]. Radiother Oncol, 2013, 106(1):80-84. DOI:10.1016/j.radonc.2012.10.010. |
| [3] | 王微, 杨海华, 单国平, 等. 鼻咽癌在调强放射治疗15次和25次时重新计划时机的研究[J]. 肿瘤学杂志, 2012, 18(1):10-14. Wang W, Yang HH, Shan GP, et al. Clinical study of optimal timing of replanning at the 15th and 25th fraction during IMRT for patient with nasopharyngeal carcinoma[J]. J Oncol, 2012, 18:10-14. |
| [4] | Zhang X, Li M, Cao J, et al. Dosimetric variations of target volumes and organs at risk in nasopharyngeal carcinoma intensity-modulated radiotherapy[J]. Br J Radiol, 2012, 85(1016):506-513. |
| [5] | Zhou SM, Bentel GC, Lee CG, et al. Differences in gross target volumes on contrast vs noncontrast CT scans utilized for conformal radiation therapy treatment planning for prostate carcinoma[J]. Int J Radiat Oncol Biol Phys, 1998, 42(1):73-78. DOI:10.1016/S0360-3016(98)00190-4. |
| [6] | 中国鼻咽癌临床分期工作委员会. 鼻咽癌92分期修订工作报告[J]. 中华放射肿瘤学杂志, 2009, 18(1):2-6. DOI:10.3760/cma.j.issn.1004-4221.2009.01.002. China Work Committee of Nasopharyngeal Carcinoma Clinical Staging. 92 staging of nasopharyngeal carinoma work report revised[J]. Chin J Radiat Oncol, 2009, 18(1):2-6. DOI:10.3760/cma.j.issn.1004-4221.2009.01.002. |
| [7] | 黄慧娴. 鼻咽癌调强放疗期间自适应放疗计划时机的研究[D]. 南宁:广西医科大学, 2014. Huang HX. The optimal timing of replanning for intensity modulated radiation therapy nasopharyngeal carcinoma adaptive radiation therapy[D]. Nanning:Guangxi Medical University, 2014. |
| [8] | 黄劭敏, 邓小武, 赵充, 等. 鼻咽癌调强放疗中解剖结构改变对剂量分布影响[J]. 中华放射肿瘤学杂志, 2010, 19(5):404-408. DOI:10.3760/cma.j.issn.1004-4221.2010.05.005. Huang SM, Deng XW, Zhao C, et al. Anatomy changes for intensity modulated radiation therapy in the nasopharyngeal carcinoma:effect on dose distribution[J]. Chin J Radiat Oncol, 2010, 19(5):404-408. DOI:10.3760/cma.j.issn.1004-4221.2010.05.005. |
| [9] | Barker JL, Garden AS, Antg KK, et al. Quantification of volumetric and gemetric changes occurring during fractionated radiotherapy for head-and-neck cancer using an integrated CT/linear accelerator Byatem[J]. Int J Radiat Oncol Biol Phys, 2004, 59(4):960-970. |
| [10] | Wang J, Bai S, Chen N, et al. The clinical feasibility and effect of online cone beam computer tomography-guided intensity-modulated radiotherapy for nasopharyngeal cancer[J]. Radiother Oncol, 2009, 90(2):221-227. DOI:10.1016/j.radonc.2008.08.017. |
| [11] | Nishi T, Nishimura Y, Shibata T, et al. Volume and dosimetric changes and initial clinical experience of a two-step adaptive intensity modulated radiation therapy (IMRT) scheme for head and neck cancer[J]. Radiother Oncol, 2013, 106(1):85-89. DOI:10.1016/j.radonc.2012.11.005. |
| [12] | 赵充, 韩非, 卢丽霞, 等.调强适形放射治疗对局部晚期鼻咽癌的临床疗效[J]. 癌症, 2004, 23(Z1):1532-1537. Zhao C, Han F, Lu LX, et al. Intensity modulated radiotherapy for local-regional advanced nasopharyngeal carcinoma[J]. Chin J Cancer, 2004, 23(Z1):1532-1537. |
 2016, Vol. 36
2016, Vol. 36


