近年来甲状腺乳头状癌的发病率逐渐上升[1],手术、术后131I治疗是其主要治疗手段。由于甲状腺解剖位置的特殊性,限制了手术切除范围,导致部分患者术后残留或复发,其中一些患者多次131I治疗后导致肿瘤病灶摄碘能力减低,出现耐药现象及失分化现象。因此,对不吸收碘且失去手术机会的患者,放射治疗是主要的治疗方法。由于甲状腺乳头状癌细胞对放射线抗拒导致疗效欠佳,因此,如何提高放射敏感性成为放疗科医生研究的主要课题。现有多项研究已经证明多西紫杉醇能提高食管癌、宫颈癌等细胞的放射敏感性[2, 3]。多西紫杉醇能否提高甲状腺乳头状癌细胞的放射敏感性国内外至今少见报道。本研究以多西紫杉醇联合照射作用于甲状腺乳头状癌TPC-1细胞,探讨多西紫杉醇对TPC-1细胞的放射增敏作用及相关机制。
1. 细胞及主要试剂:人甲状腺乳头状癌细胞系TPC-1购自广州吉尼欧生物科技有限公司;多西紫杉醇为江苏恒瑞医药股份有限公司生产;CCK-8试剂盒、AnnexinV-FITC/PI检测试剂盒、细胞周期试剂盒、蛋白质试剂提取盒购自南京凯基生物科技发展有限公司;兔抗人Bax多克隆抗体、兔抗人Bcl-2多克隆抗体购自美国Cell Signaling Technology公司。
2. 细胞培养、分组及照射:TPC-1细胞接种于25 cm2培养瓶中,培养基为含10%FBS、0.1 mg/ml青霉素、100 U/ml链霉素的RPMI 1640,置于37℃、5%CO2恒温培养箱中培养,0.25%胰酶消化传代。取对数生长期细胞进行实验。实验分为空白对照组、单纯照射组(8 Gy)、药物组(0.005和0.05 μg/ml)和药物+照射组(0.05 μg/ml)。各组细胞均采用6 MV X射线(美国瓦里安公司600C/D型直线加速器)照射,源靶距SSD=100 cm,吸收剂量率200 cGy/min,照射野15 cm×15 cm,培养皿下方垫1 cm硅胶垫,机头旋转180°。
3. CCK-8检测多西紫杉醇对TPC-1的增殖抑制作用:设空白组、对照组及药物组。待细胞生长至对数生长期,胰酶消化并计数,接种至96孔细胞培养板中,每孔细胞数为4×103/100 μl,待细胞贴壁后加入不同浓度多西紫杉醇(0.005、0.05、0.5、5、20、50、100 μg/ml)培养液,继续培养至24、48、72 h后,加入10 μl CCK-8试剂,在酶标仪下测定450 nm处吸光度(A)值,计算抑制率,抑制率(%)=(对照组A-实验组A)/(对照组A-空白组A)×100%。
4. 克隆形成实验检测多西紫杉醇对TPC-1细胞的放射增敏作用:为减少多西紫杉醇本身对放射后细胞生长的影响,克隆形成实验中筛选出对细胞抑制较小的浓度0.005 μg/ml来观察多西紫杉醇对TPC-1细胞放射敏感性的影响。取对数生长期的TPC-1细胞,胰酶消化,进行细胞分组:①空白对照组;②单纯照射组:不同照射剂量(2、4、6、8 Gy)照射;③药物组:多西紫杉醇0.005 μg/ml;④药物+照射组:0.005 μg/ml多西紫杉醇处理细胞4 h后,再分别进行不同剂量(2、4、6、8 Gy)照射。处理后继续培养24 h,换新鲜培养液常规培养10~12 d。倒置显微镜计数存活集落。克隆形成率(PE,%)=对照组克隆数/实验组细胞数×100%,细胞存活分数(SF)=克隆数/(实验组细胞数×PE),放射增敏比SER=对照组D0/实验组D0。
5. Annexin V-FITC/PI染色检测细胞凋亡:实验分4组:空白对照组、单纯照射组、药物组、药物+照射组。根据CCK-8结果,24 h时IC50浓度的1/120用于药物组及药物+照射组中加药。将细胞接种于6孔板中,调节细胞浓度至2×105/ml,待细胞贴壁后,单纯照射组给予8 Gy剂量照射,药物组更换含有0.05 μg/ml多西紫杉醇的培养液,药物+照射组给予0.05 μg/ml多西紫杉醇处理细胞4 h后给予8 Gy剂量照射。培养24、48、72 h后收集细胞,离心半径10 cm,2 000 r/min离心5 min,PBS洗涤2次,加入500 μl结合缓冲液,5 μl Annexin V-FITC、5 μl Propidium Iodide,混匀,室温下避光反应10 min,流式细胞仪检测细胞凋亡情况。
6. 流式细胞仪检测细胞周期分布:细胞分组及处理同方法5。继续培养24 h后收集上清及细胞,离心半径10 cm,1 000 r/min离心5 min,弃上清,PBS洗涤2次,70%冷乙醇500 μl固定6 h,PBS洗去固定液,加入100 μl RNA酶37℃水浴30 min,加入400 μl PI染色,4℃避光反应30 min后上机检测。
7. Western blot检测蛋白表达:实验分组同方法5。继续培养24 h后提取蛋白,进行十二烷硫酸钠-聚丙烯酰胺凝胶电泳。电转移法将蛋白质转至硝酸纤维素膜上,以Bax蛋白抗体为一抗,辣根过氧化物酶标记的山羊抗兔IgG抗体为二抗检测Bax蛋白的表达。同样方法检测Bcl-2蛋白表达,以GAPDH为内参照。
8. 统计学处理:结果用x±s表示, 采用SPSS 21.0软件进行数据分析。组间比较采用t检验,细胞生存曲线和放射生物学参数用GraphPad Prism 5进行拟合。P<0.05为差异有统计学意义。
1. 多西紫杉醇抑制甲状腺乳头状癌细胞的生长:如表 1所示,TPC-1细胞抑制率随着多西紫杉醇浓度的增加和处理时间的延长而增加,呈一定的剂量和时间依赖性。多西紫杉醇对TPC-1细胞的IC50为6.06 μg/ml(24 h),将多西紫杉醇的处理时间延长至48、72 h,TPC-1细胞的IC50分别降至1.39和0.09 μg/ml,表明延长处理时间可以提高多西紫杉醇对TPC-1细胞的抑制程度。
| 表 1 不同时间和不同浓度多西紫杉醇对TPC-1细胞生长的影响 Table 1 Effect of docetaxel with different concentrations and treatment times on TPC-1 cell proliferation |
2. 多西紫杉醇对TPC-1细胞放射敏感性的影响:采用单击多靶模型对细胞存活分数和照射剂量进行曲线拟合,见图 1。根据拟合曲线和公式计算相应放射敏感性参数及放射增敏比,见表 2。从图 1中可以看出药物+照射组细胞存活曲线下移,且肩区也小于单纯照射组肩区,提示多西紫杉醇可以提高TPC-1细胞的放射敏感性,放射增敏比SER为1.53,提示多西紫杉醇具有放射增敏作用。
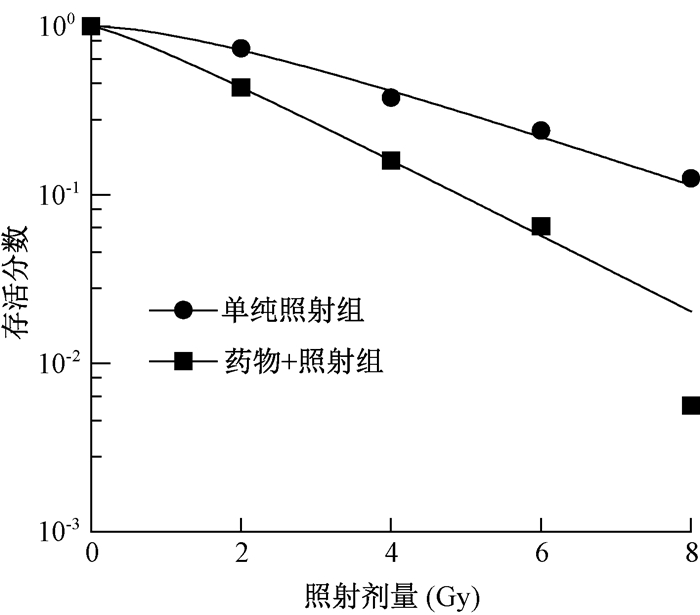
|
图 1 多西紫杉醇对TPC-1细胞放射敏感性的影响 Figure 1 The influence of docetaxel on the radiosensitivity of TPC-1 cells |
| 表 2 不同组别细胞存活曲线的主要参数 Table 2 The main parameters of cell survival curve in different groups |
3. 多西紫杉醇联合照射对TPC-1细胞凋亡的影响:流式细胞仪检测各组细胞经不同处理后不同时间内细胞凋亡的改变,如表 3所示。各组随着不同处理时间的延长,TPC-1细胞凋亡率出现不同程度的增高。药物+照射组较其他组相比凋亡率明显增加,在72 h时凋亡率高达70.20%,与单纯照射组相比,差异有统计学意义(t=-19.15,P<0.05),提示多西紫杉醇可以提高放疗诱导的细胞凋亡。
| 表 3 多西紫杉醇联合X射线照射后TPC-1细胞凋亡情况 Table 3 Apoptosis induction in TPC-1 cell after combination treatment of docetaxel and X-ray irradiation |
4. 多西紫杉醇联合照射对TPC-1细胞周期的影响:如表 4所示,多西紫杉醇作用细胞后可使大量细胞阻滞于G2/M期,较空白对照组差异有统计学意义(t=-114.07,P<0.05)。药物+照射组相对单纯照射组差异有统计学意义(t=-79.17,P<0.05)。可见多西紫杉醇可以使细胞周期再分布。
| 表 4 多西紫杉醇联合X射线照射后TPC-1细胞周期的变化 Table 4 The changes of TPC-1 cell cycles after combination treatment of docetaxel and X-ray irradiation |
5.多西紫杉醇联合照射对TPC-1细胞相关凋亡蛋白的影响:如图 2所示,与空白对照组相比,单纯照射组、药物组、药物+照射组Bax蛋白表达均有所增加,Bcl-2蛋白表达均有所降低。与单纯照射组相比,药物+照射组Bax和Bcl-2蛋白差异具有统计学意义(t=93.56、41.02,P<0.05)。
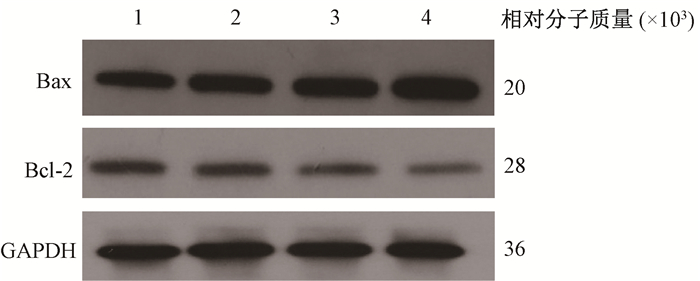
|
注:1.空白对照组;2.单纯照射组;3.药物组;4.药物+照射组 图 2 不同处理组TPC-1细胞Bax和Bcl-2蛋白表达 Figure 2 Bax and Bcl-2 protein expressions in TPC-1 cells of different groups |
甲状腺乳头状癌恶性程度低,5年和10年生存率高达 93%~96%和86%~90%。但对于进展期甲状腺乳头状癌,因侵犯腺外软组织或周围器官致手术不能完全切除者,复发率和死亡率都很高[4];而且部分甲状腺乳头状癌患者多次131I治疗后易诱导肿瘤病灶摄碘能力降低,出现去分化或失分化而不吸收碘,对放射性131I治疗无效,对此类患者选择有效的治疗手段显得尤为重要。Kim等[5]提出外照射能显著提高进展型甲状腺乳头状癌患者(腺外侵犯、肿瘤残余、淋巴结转移)的局部控制率。此外,许多回顾性研究也证明了对存在高危因素的分化型甲状腺癌患者,如pT4、淋巴结受侵、镜下或肉眼手术切缘阳性、复发性广泛甲状腺外或结外侵犯,以及对放射性碘治疗无效的复发患者[6, 7, 8],外照射在很大程度上提高了局部控制率。但由于甲状腺乳头状癌细胞对放射线抗拒,因此,研究有效的放射增敏剂至关重要。
多西紫杉醇在肿瘤细胞有丝分裂时破坏微管系统内的平衡,促进微管聚合,并抑制微管解聚和纺锤体的正常形成,使肿瘤细胞有丝分裂异常导致死亡[9]。多项体外研究证实,多西紫杉醇对宫颈癌、食管癌等细胞系具有放射增敏作用[2, 3]。本研究显示,与单纯照射组相比,药物+照射组的D0、Dq和N值均明显降低,放射增敏比为1.53,细胞存活曲线明显下移,肩区变窄,说明多西紫杉醇可能抑制了细胞照射后的亚致死性损伤修复,从而增加其放射敏感性。本研究中,作用24 h后药物+照射组凋亡率为(31.67±0.22)%,明显高于单纯照射组(13.79±0.04)%,且随着药物作用时间的延长,凋亡率明显增加;作用72 h后药物+照射组凋亡率高达(70.20±0.79)%,而单纯照射组凋亡率为(33.56±3.22)%,证实多西紫杉醇对TPC-1细胞具有放射增敏作用。
细胞周期中处于不同时相的细胞对射线敏感性也不同,G2/M期细胞最为敏感,S期细胞对放射抗拒[10]。研究表明,紫杉醇类抗肿瘤药物可使大量增殖期的肿瘤细胞阻滞于G2/M期。Pradier等[11]对宫颈癌CaSki细胞系进行体外研究发现,紫杉醇作用24 h后观察到大量G2/M期的聚集细胞,高达80%左右。Coleman等[12]对头颈部鳞癌细胞系研究同样也得出相似结论。本研究发现,多西紫杉醇可以使TPC-1细胞的G2/M期比例明显升高(72.04±0.74)%比(4.13±0.72)%,药物+照射组更高,达(93.48±0.55)%,S期均较空白对照组明显降低。表明多西紫杉醇可使TPC-1细胞周期重新分布,将其阻滞于对射线较为敏感的G2/M,此时再给予一定剂量的照射,可以在最大程度上杀伤肿瘤细胞,达到放射增敏作用。
研究表明,肿瘤细胞对射线的敏感性与射线导致的肿瘤细胞凋亡有关[13]。Bcl-2是重要的抑制细胞凋亡基因,而其同源基因Bax则可诱导细胞的凋亡[14]。紫杉醇诱导Bcl-2蛋白磷酸化后使其抑制凋亡的功能下降,电离辐射损伤DNA加速启动凋亡机制,从而达到放疗增敏作用[13]。本研究发现,单纯照射组、药物组及药物+照射组抗凋亡蛋白Bcl-2蛋白表达均较空白对照组降低,促凋亡蛋白Bax均较空白对照组明显增加,Bax/Bcl-2比率增加,药物+照射组较其他组变化最为明显。说明单纯照射和多西紫杉醇均能下调Bcl-2、上调Bax的表达,而两者联合作用最强。
综上所述,多西紫杉醇联合放射使甲状腺乳头状癌TPC-1细胞凋亡增加,细胞周期再分布,调节相关蛋白,增加其放射敏感性,为甲状腺乳头状癌的放射治疗效果提供了新的思路,但仍需动物实验和临床实验的进一步证实。
利益冲突 本人与本人家属、其他研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证 作者贡献声明 吴慧负责课题设计、指导及论文修改;王彦玲负责实验操作、论文撰写;卢晓旭指导实验;孙学明负责数据统计分析;徐靖、黄蓉负责细胞照射| [1] | 任思佳, 沈捷. 食盐加碘对甲状腺癌发病的影响[J]. 医学综述, 2014, 20(17):3135-3137. DOI:10.3969/j.issn.1006-2084.2014.17.024. Ren SJ, Shen J. The influence of salt iodization on thyroid cancer incidence[J]. Med Recapitulate, 2014, 20(17):3135-3137. DOI:10.3969/j.issn.1006-2084.2014.17.024. |
| [2] | Tabuchi S, Ozawa S, Koyanagi K, et al. Radiation-sensitizing effect of low-concentration docetaxel on human esophageal squamous cell carcinoma cell lines[J]. Exp Ther Med, 2011, 2(4):601-606. DOI:10.3892/etm.2011.263. |
| [3] | Xia S, Yu S, Fu Q, et al. Inhibiting PI3K/Akt pathway increases DNA damage of cervical carcinoma Hela cells by drug radiosensitization[J]. Huazhong Univ Sci Technolog Med Sci, 2010, 30(3):360-364. DOI:10.1007/s11596-010-0357-0. |
| [4] | 吴延升, 张仑, 王旭东, 等. 甲状腺乳头状癌预后多因素分析[J]. 中国肿瘤临床, 2007, 34(22):1294-1297. DOI:10.3969/j.issn.1000-8179.2007.22.009. Wu YS, Zhang L, Wang XD, et al. Multivariate regression analysis of papillary thyroid carcinoma prognosis[J]. Chin J Clin Oncol, 2007, 34(22):1294-1297. DOI:10.3969/j.issn.1000-8179.2007.22.009. |
| [5] | Kim TH, Yang DS, Jung KY, et al. Value of external irradiation for locally advanced papillary thyroid cancer[J]. Int J Radiat Oncol Biol Phys, 2003, 55(4):1006-1012. DOI:10.1016/S0360-3016(02)04203-7. |
| [6] | Kwon J, Wu HG, Youn YK,et al. Role of adjuvant postoperative beam radiotherapy for well differentiated thyroid cancer[J]. Radiat Oncol J, 2013,31(3):162-170. DOI:10.3857/roj. 2013. 31.3.162. |
| [7] | Terezakis SA, Lee KS, Ghossein RA, et al. Role of external beam radiotherapy in patients with advanced or recurrent nonanaplastic thyroid cancer:Memorial Sloan-kettering Cancer Center experience[J]. Int J Radiat Oncol Biol Phys, 2009, 73(3):795-801. DOI:10.1016/j.ijrobp.2008. 05.012. |
| [8] | Keum KC, Suh YG, Koom WS, et al. The role of postoperative external-beam radiotherapy in the management of patients with papillary thyroid cancer invading the trachea[J]. Int J Radiat Oncol Biol Phys, 2006, 65(2):474-480. DOI:10.1016/j.ijrobp.2005.12.010. |
| [9] | 许雪波, 徐志坚, 祝晓芬. 紫杉醇在头颈肿瘤的放疗增敏作用研究进展[J]. 医学综述,2011,17(21):3248-3250. DOI:10.3969/j.issn.1006-2084.2011.21.017. Xu XB, Xu ZJ, Zhu XF. Research progress of sensitization effect of paclitaxel in head and neck cancer radiotherapy[J]. Med Recapitulate, 2011, 17(21):3248-3250. DOI:10.3969/j.issn.1006-2084.2011.21.017. |
| [10] | Milanovi D, Firat E, Grosu AL, et al. Increased radiosensitivity and radiothermosensitivity of human pancreatic MIA PaCa-2 and U251 glioblastoma cell lines treated with the novel Hsp90 inhibitor NVP-HSP990[J]. Radiat Oncol, 2013, 8:42. DOI:10.1186/1748-717X-8-42. |
| [11] | Pradier O, Rave-Frank M, Lehmann J, et al. Effects of docetaxel in combination with radiation on human head and neck cancer cells (ZMK-1) and cervical squamous cell carcinoma cells (CaSki)[J]. Int J Cancer, 2001, 91(6):840-845. DOI:10.1002/1097-0215(200002)9999:9999<::AID-IJC1142>3.0.CO;2-U. |
| [12] | Coleman SC, Stewart ZA, Day TA, et al. Analysis of cell-cycle checkpoint pathways in head and neck cancer cell lines:implications for therapeutic strategies[J]. Arch Otolaryngol Head Neck Surg, 2002, 128(2):167-176. DOI:10.1001/archotol.128.2.167. |
| [13] | Tanaka T, Bai T, Yukawa K, et al. Reduced radiosensitivity and increased CD40 expression incyclophosphamide-resistant subclones established from human cervical squamous cell carcinoma cells[J]. Oncol Rep, 2005, 14(4):941-948. DOI:10.3892/or.14.4.941. |
| [14] | 马红兵, 狄政莉, 何娜, 等. 大蒜素提高人胰腺癌BXPC3细胞放射敏感性的机制研[J].中华放射医学与防护杂志, 2014, 34(10):743-747. DOI:10.3760/cma.j.issn.0254-5098.2014.10.006. Ma HB, Di ZL, He N, et al. Effect of allicin on the radiosensitivity of human pancreatic carcinoma BXPC3 cells[J]. Chin J Radiol Med Prot, 2014, 34(10):743-747. DOI:10.3760/cma.j.issn.0254-5098.2014.10.006. |
 2016, Vol. 36
2016, Vol. 36


