2. 300072 天津大学
2. Tianjin University, Tianjin 300072, China
结肠癌发病率在恶性肿瘤中排第3位,新确诊的患者中40%~50%已有转移[1],目前仍无有效的诊疗方法。靶向给药系统是利用具有靶向性的导向分子或载体携带抗肿瘤药物,通过局部或全身血液循环使药物选择性的浓聚于肿瘤部位杀伤肿瘤细胞,克服了化疗与放疗缺乏特异性的难题[2]。纳米科技的发展为肿瘤的诊疗提供了新方法,在提高肿瘤治疗的效果同时,降低了药物不良反应[3]。表皮生长因子受体(EGFR)广泛高表达于乳腺癌、脑胶质瘤、非小细胞肺癌、结肠癌等恶性肿瘤[4, 5],是靶向治疗的理想靶点。放射性核素发射的β射线具有治疗作用,将其与纳米载体连接,可以提高肿瘤的诊疗效果,常用的核素有90Y及131I等[6]。本研究拟构建一个131I标记的以EGFR为靶点的纳米载体,探讨其靶向治疗的有效性和可行性。
1. 材料与试剂: MEM-EBSS培养基和胎牛血清(FBS)购自美国GIBCO公司。兔抗人EGFR抗体(ab2430)购自美国Abcam公司。5 mg/ml的单克隆抗体西妥昔单抗(C225)购自德国默克里昂制药公司。
2. 细胞培养:LS180细胞购自中国医学科学院基础医学细胞中心,MEM-EBSS培养基(加入10%的FBS和1%的青、链霉素抗体),在37℃、5% CO2环境中培养。
3. 纳米载体的构建:BSA-PCL和antiEGFR-BSA-PCL由天津大学提供[7],131I通过氯胺T法直接标记纳米载体。100 μg的antiEGFR-BSA-PCL和BSA-PCL溶解于100 μl的磷酸盐缓冲液(PB)中,加入111~148 MBq的131I 及100 μl的氯胺T(5 mg/ml),孵育60 s;再加入100 μl的偏重硫酸钠(5 mg/ml),终止反应[8],经超滤过滤小分子杂质后,得到标记好的纳米载体。
4. 共聚焦实验:将1 mg/106细胞的antiEGFR-BSA-PCL和BSA-PCL加入1×105/ml细胞中,37℃孵育4 h,用磷酸盐缓冲生理盐水(PBS)冲洗细胞3次,4%多聚甲醛固定,然后使用共聚焦显微镜拍照。
5. 131I内流实验:将LS180细胞以1×105/孔接种于96孔板,加入0.37~3.7 MBq/ml 131I-antiEGFR-BSA-PCL、131I-BSA-PCL或131I孵育4 h,将细胞冲洗、裂解后用γ计数仪测定其放射性计数率。在2、4、6、8、12、24、36和48 h,将细胞冲洗、裂解,使用γ计数仪测量0.37 MBq/ml组细胞的放射性计数率。
6. 裸鼠建模及分组:BALB/c雌性裸鼠40只,3~4周龄,9~11 g,SPF级,购自纳瑞增(天津)生物科技有限公司,合格证号:0012653。将LS180细胞悬液接种于裸鼠右大腿外侧皮下,至肿瘤直径约1 cm,采用随机数字表法将裸鼠分成131I-antiEGFR-BSA-PCL、131I-BSA-PCL、131I及生理盐水4组。采用瘤内注射的方法向瘤体内分别注射74 MBq (740 MBq/ml)的131I-antiEGFR-BSA-PCL、131I-BSA-PCL、131I及相同体积的生理盐水。
7. 药物组织分布研究:参照文献[9],注药后4、24及72 h分别将裸鼠处死并解剖,取心脏、肝脏、脾脏、结肠及肿瘤,取部分组织称重、测放射性计数率(30 s),分别测定74 MBq 131I在4、24及72 h的放射性计数率,计算组织的% ID/g值。
8. 体重及瘤体体积研究:实验第21天开始,每3天测量肿瘤的长、宽、高及裸鼠体重,肿瘤体积=1/6×π×长(mm)×宽 (mm) ×高 (mm)[10],实验至57 d结束。
9. 病理学研究:裸鼠在注射药物后4、24及72 h后处死,取脾脏、肝脏、肿瘤进行HE染色。
10. SPECT显像:参照文献[11]。3组裸鼠(除外生理盐水组)实验前2 d饮用加入1%高氯酸钠的无菌水封闭甲状腺,在治疗后4、24及72 h通过SPECT采集前后位图像(时间120 s)。
11. 统计学处理:结果用x±s表示。实验数据分析使用SPSS 17.0统计软件包,计量资料采用配对t检验或ANOVA分析。P<0.05为差异有统计学意义。
1. 纳米载体标记率:antiEGFR-BSA-PCL及BSA-PCL的有效直径是100 nm[7],131I-antiEGFR-BSA-PCL和131I-BSA-PCL的标记率为70%~85%,比浓度为370~690 MBq/mg。
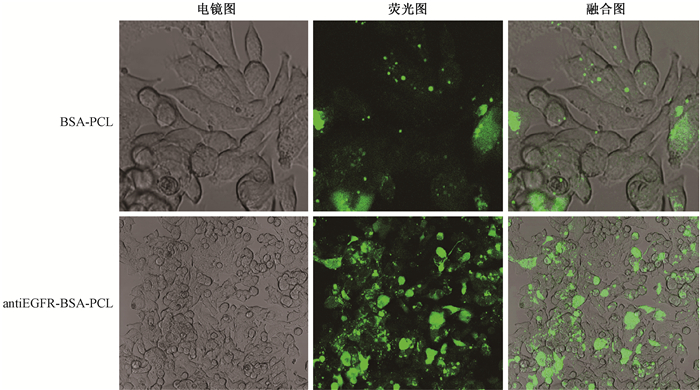
2. 共聚焦实验:antiEGFR-BSA-PCL能介导显著的胞吞效应,绿色荧光较BSA-PCL明显,BSA-PCL也能和肿瘤细胞结合,但绿色荧光较弱(图 1)。
|
图1 LS180细胞摄取BSA-PCL和EGFR-BSA-PCL的共聚焦显微镜图 ×40 Figure 1 The distribution of BSA-PCL and antiEGFR-BSA-PCL in LS180 cells imaged by a confocal microscopy ×40 |
3. 131I内流实验:131I-antiEGFR-BSA-PCL能快速被细胞摄取,并于4 h达到最高值,且细胞摄取率高于131I-BSA-PCL(表 1),24 h后细胞内的放射性计数率能达到最高值的79%~84%。随纳米载体浓度增加,LS180细胞131I的放射性计数率也增高,然而,131I组始终处于较低水平(表 2)。
| 表 1 LS180细胞不同时间131I内流实验 Table 1 131I uptake in LS180 cells after different time of drug treatment |
| 表 2 LS180细胞中不同剂量131I内流实验 Table 2131I uptake in LS180 cells under different doses of drug |
4. 裸鼠体重变化:注药后57 d,131I-antiEGFR-BSA-PCL、131I-BSA-PCL、131I及生理盐水组裸鼠体重下降率分别为39%±3%、41%±4%、49%±5%及55%±13%,131I-antiEGFR-BSA-PCL组与131I-BSA-PCL组体重变化差异无统计学意义(P>0.05),131I-BSA-PCL与131I组体重变化差异有统计学意义(t=8.69,P<0.01)。131I组与生理盐水组体重变化差异无统计学意义(P>0.05),见表 3。
| 表 3 注射后不同时间各组裸鼠体重变化 Table 3 Changes of the mouse body weight after different time of drug injection |
5. 肿瘤体积变化:至实验结束,131I-antiEGFR-BSA-PCL、131I-BSA-PCL、131I和生理盐水组瘤体体积增长率分别是124%±7%,127%±9%、143%±7%和146%±10%, 131I组肿瘤增殖明显快于131I-BSA-PCL组(t=8.69,P<0.01),然而,131I-antiEGFR-BSA-PCL与131I-BSA-PCL组瘤体体积变化差异不明显(P>0.05),见表 4。
| 表 4 给药后不同时间各组裸鼠瘤体体积变化曲线 Table 4 Changes in the mouse tumor volume at different time after drug injection |
6. 药物组织分布:结果列于表 5。给药后72 h,肿瘤组织对131I-antiEGFR-BSA-PCL摄取率仍能达到(21.61±1.01)%ID/g。131I-antiEGFR-BSA-PCL组(t=22.78,P<0.01)和131I-BSA-PCL组(t=14.39,P<0.01)肿瘤组织的药物摄取率均明显高于131I组,但其二者对药物的摄取率无明显差异(P>0.05)。在非肿瘤组织中,131I-antiEGFR-BSA-PCL主要积聚在肝脏和脾脏。
| 表 5 注射后不同时间药物在裸鼠体内不同器官的分布 Table 5 The drug distribution in mouse organs at different time after injection |
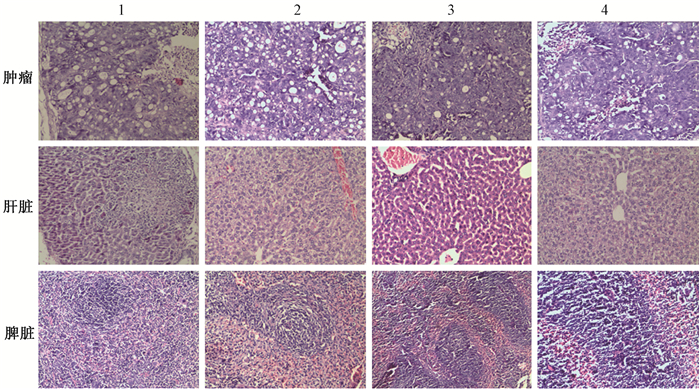
7. 病理学研究:在HE染色中,各组肿瘤组织都有不同程度坏死,细胞质内可以看到空泡变性,肿瘤细胞簇减少,细胞间隙变大,肿瘤细胞分布稀疏,细胞质着色较深(图 2),生理盐水及131I组肿瘤细胞增殖较好,细胞核大小不一,着色程度不尽相同。131I-antiEGFR-BSA-PCL及131I-BSA-PCL组裸鼠肝脏和脾脏没有明显坏死细胞。
|
注:1.131 I-antiEGFR-BSA-PCL组;2.131 I-BSA-PCL组;3.131 I组;4.生理盐水组 图2 给药后3 d各组裸鼠肿瘤、肝脏、脾脏组织镜下观察 HE染色 ×40 Figure 2 Histopathology of the tumor, liver, and spleen tissues after 3 d of the drug treatment. The tissues were stained with HE ×40 |
8. SPECT显像:131I-antiEGFR-BSA-PCL及131I-BSA-PCL主要积聚在肿瘤区(图 3)。给药后72 h,131I-antiEGFR-BSA-PCL组、 131I-BSA-PCL组及131I组瘤体内药物滞留靶本比分别为6.73±0.21、6.32±0.27及1.02±0.09,肿瘤组织对131I-antiEGFR-BSA-PCL和 131I-BSA-PCL摄取率明显高于131I(t=14.78、10.62,P<0.01)。肿瘤部位131I-antiEGFR-BSA-PCL的浓聚较131I-BSA-PCL明显,但差异无统计学意义(P>0.05)。

|
图3 131 I组、131 I-BSA-PCL组 及131 I-antiEGFR-BSA-PCL组裸鼠SPECT/CT显像分布 Figure 3 The SPECT/CT image of mouse in 131 I-antiEGFR-BSA-PCL, 131 I-BSA-PCL and 131 I groups |
结肠癌发病率较高[1],但目前仍没有有效的诊断和治疗方法。EGFR是原癌基因c-erbB1的表达产物,60%~80%结肠癌高表达EGFR[5,11]。
传统的抗肿瘤药物缺乏特异性,生物利用度较低,在杀伤肿瘤细胞的同时,对正常组织损伤也很大[12]。纳米脂质体是脂质双分子层形成的球形囊状小体,它包封脂溶性及水溶性药物,其包封作用能够保护被包封的药物,提高药物的稳定性、细胞的亲和性和组织相容性,从而使这些药物选择性的分布于人体某些组织和器官,改变药物的体内分布,提高药物的治疗指数、减少给药剂量,已经被广泛用于肿瘤靶向治疗[13, 14, 15]。近期关于靶向性和非靶向性纳米载体(脂质体[16]、高分子聚合物[17)的研究证明,纳米载体可以增强肿瘤细胞的药物摄取率。Kao等[18]在A549肺癌模型研究中,131I-C225-AuNP-PEG可以增强细胞胞吞作用,提高了细胞杀伤力及细胞毒性。Chen等[19]和Chang等[20]的研究表明,188Re标记的纳米脂质体治疗肿瘤具有明显优势。
本研究通过共聚焦实验不仅说明了荧光标记的靶向性纳米载体可以吞到细胞质内部,而且从数量上说明肿瘤细胞antiEGFR-BSA-PCL的摄取明显高于BSA-PCL,即antiEGFR的修饰使BSA-PCL胞吞效应更明显。摄碘率实验表明,LS180细胞对antiEGFR-BSA-PCL的摄取率更高,细胞内滞留时间更长,证明antiEGFR修饰更进一步增强了纳米载体的靶向性。 131I-antiEGFR-BSA-PCL肿瘤组织中放射性计数可以较高地保持至少72 h。
Li等[21]裸鼠移植瘤模型研究中,131I标记的rhEGF明显地被肿瘤组织摄取,注药后120 h肿瘤组织的最高摄取率仍达到16.73 %ID/g。本研究结果显示131I-antiEGFR-BSA-PCL组肿瘤体积增长缓慢,体重下降较少,说明其对肿瘤抑制率较高,SPECT显像及摄碘率实验证明,131I-antiIEGFR-BSA-PCL及131I-BSA-PCL组的肿瘤组织的放射性计数明显高于其他两组。纳米药物载体经血液循环进入毛细血管,还可透过内皮细胞间隙进入病灶,被肿瘤细胞以胞饮的方式吸收,注药后72 h 131I-antiEGFR-BSA-PCL和131I-BSA-PCL组肿瘤部位药物滞留率明显高于131I组,而非肿瘤区药物主要分布在肝脏及脾脏。证明纳米脂质体可以延长131I在细胞内的滞留时间,提高131I的局部浓度。
131I-antiEGFR-BSA-PCL的抗肿瘤效果也可以在组织病理学研究方面得到证实。生理盐水及131I组裸鼠的肿瘤组织增殖较好,未发现明显的细胞坏死。131I-antiEGFR-BSA-PCL及131I-BSA-PCL组肿瘤组织可以看到大片坏死。表明131I-antiEGFR-BSA-PCL及131I-BSA-PCL可以杀死癌细胞,但其对肝脏、脾脏没有明显的不良反应,说明此种核素纳米载体靶向性强。本研究中结肠癌移植瘤模型不是原位的,但结果证明131I-antiEGFR-BSA-PCL及131I-BSA-PCL的治疗效果的研究仍是有价值的。综上所述,本研究证明,131I-antiEGFR-BSA-PCL体内靶向放射治疗结肠癌的可行性及可靠性。
通过细胞实验及动物实验,与BSA-PCL相比,131I-antiEGFR-BSA-PCL靶向性和细胞摄取率较高,对结肠癌抑制作用较明显,伴随着新型药物的开发与应用,131I-antiEGFR-BSA-PCL有望成为治疗结肠癌的新方法。
利益冲突 作者声明所写的内容均中立及客观,无利益冲突 作者贡献声明 季艳会负责部分动物实验及论文撰写;李玮、常津负责数据收集、统计分析;李承霞负责LS180细胞实验;李宁负责裸鼠显像等实验;谭建负责实验设计| [1] | Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics, 2002[J]. CA Cancer J Clin, 2005, 55(2):74-108. DOI:10.3322/canjclin.55.2.74. |
| [2] | Yu B, Tai HC, Xue W, et al. Receptor-targeted nanocarriers for therapeutic delivery to cancer[J]. Mol Membr Biol, 2010, 27(7):286-298. DOI:10.3109/09687688.2010.521200. |
| [3] | Allen TM, Cullis PR. Drug delivery systems:entering the mainstream[J]. Science, 2004, 303(5665):1818-1822. DOI:10.1126/science.1095833. |
| [4] | Nurwidya F, Murakami A, Takahashi F, et al. Molecular mechanisms contributing to resistance to tyrosine kinase-targeted therapy for non-small cell lung cancer[J]. Cancer Biol Med, 2012, 9(1):18-22. DOI:10.3969/j.issn.2095-3941.2012.01.003. |
| [5] | Porebska I, Harlozińska A, Bojarowski T. Expression of the tyrosine kinase activity growth factor receptors (EGFR, ERB B2, ERB B3) in colorectal adenocarcinomas and adenomas[J]. Tumour Biol, 2000, 21(2):105-115. DOI:10.1159/000030116. |
| [6] | Koppe MJ, Bleichrodt RP, Soede AC, et al. Biodistribution and therapeutic efficacy of (125/131)I-, (186)Re-, (88/90)Y-, or (177)Lu-labeled monoclonal antibody MN-14 to carcinoembryonic antigen in mice with small peritoneal metastases of colorectal origin[J]. J Nucl Med, 2004, 45(7):1224-1232. |
| [7] | Liu Z, Dong C, Wang X, et al. Self-assembled biodegradable protein-polymer vesicle as a tumor-targeted nanocarrier[J]. ACS Appl Mater Interfaces, 2014, 6(4):2393-2400. DOI:10.1021/am404734c. |
| [8] | Ickenstein LM, Edwards K, Sjoberg S, et al. A novel 125I-labeled daunorubicin derivative for radionuclide-based cancer therapy[J]. Nucl Med Biol, 2006, 33(6):773-783. |
| [9] | Shao X, Zhang H, Rajian JR, et al. 125I-labeled gold nanorods for targeted imaging of inflammation[J]. ACS Nano, 2011, 5(11):8967-8973. DOI:10.1021/nn203138t. |
| [10] | Lee YSBD, Zalutsky MR, Coleman RE, et al. Therapeutic efficacy of antiglioma mesenchymal extracellular matrix 131I-radiolabeled murine monoclonal antibody in a human glioma xenograft model[J]. Cancer Res, 1988, 48(3):559-566. |
| [11] | Messa C, Russo F, Caruso MG, et al. EGF, TGF-alpha, and EGF-R in human colorectal adenocarcinoma[J]. Acta Oncol, 1998, 37(3):285-289. |
| [12] | Ting G, Chang CH, Wang HE, et al. Nanotargeted radionuclides for cancer nuclear imaging and internal radiotherapy[J]. J Biomed Biotechnol, 2010, 2010. DOI:10.1155/2010/953537. |
| [13] | Power S, Slattery MM, Lee MJ. Nanotechnology and its relationship to interventional radiology. Part II:drug delivery, thermotherapy, and vascular intervention[J]. Cardiovasc Intervent Radiol, 2011, 34(4):676-690. DOI:10.1007/s00270-010-9967-y. |
| [14] | Istvan T. Editorial:Thematic issue:nanotechnology for drug delivery applications[J]. Curr Drug Deliv, 2014, 11(6):665. |
| [15] | Rao PV, Gan SH. Recent advances in nanotechnology-based diagnosis and treatments of diabetes[J]. Curr Drug Metab, 2015, 16(5):371-375. DOI:10.2174/1389200215666141125120215. |
| [16] | Kirpotin DB, Drummond DC, Shao Y, et al. Antibody targeting of long-circulating lipidic nanoparticles does not increase tumor localization but does increase internalization in animal models[J]. Cancer Res, 2006, 66(13):6732-6740. DOI:10.1158/0008-5472.CAN-05-4199. |
| [17] | Bartlett DW, Su H, Hildebrandt IJ, et al. Impact of tumor-specific targeting on the biodistribution and efficacy of siRNA nanoparticles measured by multimodality in vivo imaging[J]. Proc Natl Acad Sci USA, 2007, 104(39):15549-15554. DOI:10.1073/pnas.0707461104. |
| [18] | Kao HW, Lin YY, Chen CC, et al. Evaluation of EGFR-targeted radioimmuno-gold-nanoparticles as a theranostic agent in a tumor animal model[J]. Bioorg Med Chem Lett, 2013, 23(11):3180-3185. DOI:10.1016/j.bmcl.2013.04.002. |
| [19] | Chen LC, Chang CH, Yu CY, et al. Pharmacokinetics, micro-SPECT/CT imaging and therapeutic efficacy of (188)Re-DXR-liposome in C26 colon carcinoma ascites mice model[J]. Nucl Med Biol, 2008, 35(8):883-893. DOI:10.1016/j.nucmedbio.2008.09.005. |
| [20] | Chang YJ, Chang CH, Chang TJ, et al. Biodistribution, pharmacokinetics and microSPECT/CT imaging of 188Re-bMEDA-liposome in a C26 murine colon carcinoma solid tumor animal model[J]. Anticancer Res, 2007, 27(4B):2217-2225. |
| [21] | Li YC, Xu WY, Tan TZ, et al. 131I-recombinant human EGF has antitumor effects against MCF-7 human breast cancer xenografts with low levels of EGFR[J]. Nucl Med Biol, 2004, 31(4):435-440. DOI:10.1016/j.nucmedbio.2003.11.010.) |
 2016, Vol. 36
2016, Vol. 36


