在宫颈癌外照射放疗结束后, 还需采用后装治疗使肿瘤达到根治剂量。三维后装是目前后装治疗的主流技术, 计划的优化主要包括图形优化(GO)和逆向优化, 逆向优化又包括混合逆向优化(HIPO)和模拟退火逆向优化(IPSA)等[1]。采用不同的优化方法会产生不同的剂量分布, 目前关于不同优化方法对宫颈癌剂量影响的研究少有文献报道。本研究回顾性分析已进行GO治疗计划, 重新制定IPSA计划, 统计靶区和危及器官的剂量体积直方图(DVH)参数, 分析两种计划剂量分布的差异, 为宫颈癌后装治疗计划优化方法的选择提供依据。
资料与方法1.病例资料:2014年12月至2015年6月四川省肿瘤医院近距离治疗中心治疗的根治性宫颈癌患者共计296例, 按患者病案号从小到大排序后, 用Excel 2007产生随机数, 随机选取21例, 年龄42~71岁(中位年龄51岁)。按照国际妇产联合会(FIGO)2009年推荐的分期指南[2], 病理分期为Ⅱb~Ⅲb期, 病理类型全部是鳞癌。患者在接受45~46 Gy调强外照射放疗后, 进行4~5次CT引导的三维优化腔内后装。
2. CT定位:本研究采用三管后装技术, 患者取仰卧位并采用真空垫固定, 安置瑞典医科达公司生产的Fletcher施源器后, 在荷兰飞利浦公司生产的Brilliance Big Bore大孔径CT模拟定位机上进行扫描。扫描范围为L5至外阴口下缘2 cm, 层厚3 mm。图像数据传输至瑞典医科达Oncentra 4.3放射治疗计划系统。
3.后装计划:在患者CT图像上勾画出临床靶区(CTV)和危及器官(膀胱、直肠和小肠), 勾画标准大致遵循欧洲放射治疗协会(GEC-ESTRO)的推荐[3], CTV主要包括肿瘤靶区以及阴道上段和宫体中下段。直肠以直肠壁的外侧缘为界, 上界为直肠乙状结肠交界处、下界为肛门; 膀胱以外轮廓; 小肠下接直肠与乙状结肠交界处, 上到宫底上界以上两层。施源器的重建参照GEC-ESTRO推荐[4], 放射源步进长度2.5 mm。原计划设计均采用GO, 主要在矢状面进行优化, 同时参照横截面, 管状面的等剂量线分布以及DVH参数, 不断拖动等剂量线直至达到优化目标。在原计划的CT图像上另行设计一组IPSA计划, 初始目标参数中感兴趣区(ROI)均无外扩, 以CTV为参考靶区, 表面最小剂量6 Gy, 权重100, 危及器官的表面最大剂量4.50 Gy, 膀胱和小肠的权重为40, 直肠的权重为50, 参照3个断面的等剂量线分布以及DVH参数, 根据每位患者的实际解剖结构, 不断调整优化目标参数, 直至达到理想剂量分布。两种计划的处方剂量均为6 Gy/次, 优化使90%的CTV体积受处方剂量照射, 危及器官的D1 cm3和D2 cm3尽可能低。
4.剂量学分析:统计CTV剂量分布V100%、V150%, 膀胱和直肠的D1 cm3、D2 cm3[5]。虽然在后装治疗中由于放射源的特性导致靶区剂量分布不均匀, 但作为评估高剂量区域体积的一项指标, 仍然将均匀性指数(HI)和适形指数(CI)作为统计数据的一部分进行分析[6]。HI和CI的计算公式如下:
| ${\rm{HI}} = \frac{{{V_{100\% }} - {V_{150\% }}}}{{{V_{100\% }}}}$ | (1) |
| ${\rm{CI}} = \frac{{{V_{{\rm{CTV}},{\rm{ref}}}}}}{{{V_{{\rm{CTV}}}}}} \cdot \frac{{{V_{{\rm{CTV}},{\rm{ref}}}}}}{{{V_{{\rm{ref}}}}}}$ | (2) |
式中, V100%为100%处方剂量包括的靶区体积占总体积的百分比, %; V150%是指150%处方剂量包括的靶区体积占总体积的百分比, %; VCTV, ref是指处方剂量包括的靶区体积, cm3; VCTV是指靶区体积, cm3; Vref是指处方剂量包括的总体积, cm3。
5.统计学处理:计量资料以x±s表示。采用SPSS 19.0软件对数据进行统计学分析, 两组数据比较采用配对样本t检验。P < 0.05为差异有统计学意义。
结果1.靶区剂量:21例患者的靶区体积范围在23~60 cm3(中位数35 cm3)。GO计划和IPSA计划的靶区剂量均能满足处方要求, V100%、V150%、HI和CI的均值接近, 所有靶区剂量参数差异均无统计学意义(P > 0.05)。
2.危及器官剂量:GO计划和IPSA计划靶区和危及器官剂量对比结果如表 1所示。由表 1可知, 与GO计划相比, IPSA计划中膀胱D1 cm3、D2 cm3的剂量明显降低(t=3.596、3.490, P < 0.05);直肠剂量参数的差异无统计学意义(P > 0.05)。
|
|
表 1 GO计划和IPSA计划靶区和危及器官剂量对比(x±s) Table 1 The dosimetric comparison of regions of interest between GO and IPSA plans (x±s) |
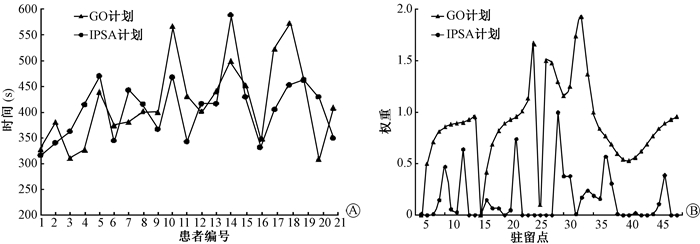
3.治疗时间:两组计划实际治疗时间和驻留点权重趋势如图 1所示。192Ir放射源遵循指数衰变规律, 将两种计划的治疗时间按照计划时间修正后对比发现, GO和IPSA计划的实际治疗时间平均分别为417.2和407.9 s, 但数据差异无规律性且无统计学意义(P > 0.05)。两组计划的驻留点权重有较大差别, 在一个典型的病例中, GO计划中放射源在驻留点的变化范围为0.10~1.93, 有两个驻留点的权重为0;IPSA计划中共有44个驻留点, 但只有效使用了其中的17个。
|
图 1 两组计划际治疗时间(A)和驻留点权重(B)趋势图 注:GO.图形优化; IPSA.模拟退火逆向优化 Figure 1 Treatment time (A) and dwell weight (B) trends of two plans |
讨论
GO和IPSA优化在后装放疗中都有广泛的应用, GO优化需从多个层面考虑剂量线的外拖和内收, 依赖于物理师的经验和技巧, 计划不可重复且耗时长。而IPSA是基于数学的算法, 临床剂量目标用数学公式定义, 通过迭代优化使目标函数值最小。IPSA计划具有较好的重复性, 同一个肿瘤中心宫颈癌患者的靶区和危及器官勾画通常会遵循相同的规则, IPSA优化模板能在一定程度上缩短优化时间, 提高工作效率。但IPSA优化不如GO优化直观, 输入的目标参数会直接影响优化结果, 所以, IPSA方法在临床应用之前, 物理师须对该算法的基本原理进行详细地研究, 熟练地掌握每个参数的意义及对优化结果可能产生的影响[7-8]。到目前为止, GEC-ESTRO和美国近距离治疗协会(ABS)都未对宫颈癌的三维后装优化方法做推荐, 本研究结果也表明两种优化方法可以达到近似一致的结果。
倪千禧等[9]报道了采用IPSA计划靶区覆盖度高于常规(A-B)点计划, 且直肠和膀胱的剂量更低。Jamema等[10]研究表明, 在宫颈癌后装插植治疗中, 无论采用图形优化(GO)还是IPSA都优于常规(A-B)点计划。Hsu等[6]对前列腺插植的患者进行了GO和IPSA计划的对比, IPSA计划在靶区处方剂量覆盖V100%、HI和CI都优于GO计划, 且IPSA计划的膀胱直肠剂量更低。本研究结果显示, 在宫颈癌三管腔内后装治疗中, 两组计划在靶区剂量分布的均匀性、适形度等指标上的差异均无统计学意义, 但IPSA计划在控制膀胱最大剂量点方面有明显的优势, 膀胱的D1 cm3和D2 cm3两个指标比GO计划低。本研究结果与文献[6]结果不同的原因是由于在三管后装中放射源的通道较少, 驻留位置和驻留时间的调节空间有限, 无法把IPSA方法的优势最大程度地发挥出来。
有研究用影像引导放射治疗(IGRT)与腔内后装结合的方法提高宫颈癌患者后装中的靶区覆盖[11-12], 由于外照射的剂量基于后装的剂量分布, 为了控制危及器官的受量, 内照射中危及器官的最大剂量应严格控制在一定的范围内, IPSA优化的结果很有可能超过危及器官的剂量限制, 此时用GO是最佳的选择, 也可以先进行IPSA优化, 在此基础上进行GO优化, 快速达到临床上较为满意的效果。
总之, 无论是GO和IPSA优化, 计划的质量都很大程度上依赖于物理师的经验和技巧, 不同的研究可能得到不同的研究结果。在施源器管道较多, 可优化空间较大的情况下应选择IPSA优化。在宫颈癌三管后装治疗中, IPSA优化可以减小膀胱的最大受量, 但图形优化较为直观, 在IGRT补偿腔内后装治疗的过程中也具有不可替代的优势。
利益冲突 本人与本人家属、其他研究者未因进行该研究而接受任何不正当的职务或财务利益, 在此对研究的独立性和科学性予以保证作者贡献声明 彭倩负责整理临床资料, 采集数据结果并起草论文; 王培负责审核计划并指导论文写作; 王先良、谭燕负责计划的设计和制作; 吴骏翔负责协助完善数据
| [1] | Poulin E, Varfalvy N, Aubin S, et al. Comparison of dose and catheter optimization algorithms in prostate high-dose-rate brachytherapy[J]. Brachytherapy, 2016, 15 (1) : 102-111 DOI:10.1016/j.brachy.2015.09.010 |
| [2] | Okada S. Revised FIGO staging for carcinoma of the uterine cervix[J]. Int J Gynecol Obstet, 2009, 105 (2) : 103-104 DOI:10.1016/j.ijgo.2009.02.009 |
| [3] | Haie-Meder C, Potter R, van Limbergen E, et al. Recommendations from Gynaecological (GYN) GEC-ESTRO Working Group (I):concepts and terms in 3D image based 3D treatment planning in cervix cancer brachytherapy with emphasis on MRI assessment of GTV and CTV[J]. Radiother Oncol, 2005, 74 (3) : 235-245 DOI:10.1016/j.radonc.2004.12.015 |
| [4] | Hellebust TP, Kirisits C, Berger D, et al. Recommendations from Gynaecological (GYN) GEC-ESTRO Working Group:considerations and pitfalls in commissioning and applicator reconstruction in 3D image-based treatment planning of cervix cancer brachytherapy[J]. Radiother Oncol, 2010, 96 (2) : 153-160 DOI:10.1016/j.radonc.2010.06.004 |
| [5] | Potter R, Haie-Meder C, van Limbergen E, et al. Recommendations from Gynaecological (GYN) GEC ESTRO Working Group (Ⅱ):concepts and terms in 3D image-based treatment planning in cervix cancer brachytherapy-3D dose volume parameters and aspects of 3D image-based anatomy, radiation physics, radiobiology[J]. Radiother Oncol, 2006, 78 (1) : 67-77 DOI:10.1016/j.radonc.2005.11.014 |
| [6] | Hsu IC, Lessard E, Weinberg V, et al. Comparison of inverse planning simulated annealing and geometrical optimization for prostate high-dose-rate brachytherapy[J]. Brachytherapy, 2004, 3 (3) : 147-152 DOI:10.1016/j.brachy.2004.05.007 |
| [7] | Lessard E, Kwa SL, Pickett B, et al. Class solution for inversely planned permanent prostate implants to mimic an experienced dosimetrist[J]. Med Phys, 2006, 33 (8) : 2773-2782 DOI:10.1118/1.2210565 |
| [8] | Lessard E, Pouliot J. Inverse planning anatomy-based dose optimization for HDR-brachytherapy of the prostate using fast simulated annealing algorithm and dedicated objective function[J]. Med Phys, 2001, 28 (5) : 773-779 DOI:10.1118/1.1368127 |
| [9] | 倪千禧, 唐迪红, 张九堂. 妇科肿瘤后装逆向调强放疗的初步临床研究[J]. 中华放射医学与防护杂志, 2014, 34 (4) : 286-288 Ni QX, Tang DH, Zhang JT. Preliminary clinical research on the afterloading brachytherapy inverse intensity-modulated radiotherapy of gynecological tumor[J]. Chin J Radiol Med Prot, 2014, 34 (4) : 286-288 DOI:10.3760/cma.j.issn.0254-5098.2014.04.012 |
| [10] | Jamema SV, Sharma S, Mahantshetty U, et al. Comparison of IPSA with dose-point optimization and manual optimization for interstitial template brachytherapy for gynecologic cancers[J]. Brachytherapy, 2011, 10 (4) : 306-312 DOI:10.1016/j.brachy.2010.08.011 |
| [11] | Wang X, Li J, Wang P, et al. Image guided radiation therapy boost in combination with high-dose-rate intracavitary brachytherapy for the treatment of cervical cancer[J]. J Contemp Brachytherapy, 2016, 8 (2) : 122-127 DOI:10.5114/jcb.2016.59282 |
| [12] | Duan J, Kim RY, Elassal S, et al. Conventional high-dose-rate brachytherapy with concomitant complementary IMRT boost:a novel approach for improving cervical tumor dose coverage[J]. Int J Radiat Oncol Biol Phys, 2008, 71 (3) : 765-771 DOI:10.1016/j.ijrobp.2007.10.064 |
 2016, Vol. 36
2016, Vol. 36


