微小RNA (microRNA, miRNA)是一类进化上高度保守的非编码单链小RNA, 长度一般为19~25个核苷酸, 其通过调控基因的表达参与众多生物学过程以及各种疾病的发生, 包括癌症[1]。越来越多的研究表明miRNA与肿瘤放射敏感性密切相关, 选择性的降低或增强相关miRNA的表达可以提高肿瘤细胞的放射敏感性[2-5]。有研究报道, miR-141在放射抵抗食管癌细胞系中的表达水平相比于母代细胞明显降低, 推测其可能与食管癌细胞放射敏感性相关[8]。本研究通过miR-141转染食管癌KYSE-150细胞, 进行X射线照射, 观察miR-141对食管癌细胞放射敏感性的影响, 以期为食管癌的临床放疗提供一定的理论基础。
材料与方法1.细胞系及试剂:食管癌KYSE-150细胞购自美国模式培养物保藏所。RPMI 1640培养基、Lipofectamine2000转染试剂盒、One Step PrimeScript® miRNA cDNA Synthesis Kit、SYBR® Premix Ex TaqTMⅡ和FITC Annexin V Apoptosis Detection Kit试剂盒均购自美国Invitrogen公司; 胎牛血清(FBS)购自美国GIBCO公司; 成熟miR-141模拟物引物: GGUAGAAAUGGUCUGUCACAAU, 及模拟物对照引物:AAUGCCUAACAUGCAGUCGAUG由上海GenePharma公司合成; TRIzol试剂购自美国Ambion公司; CCK-8购自美国Sigma公司; Ki67抗体(英国Abcam公司)、Bax抗体(美国CST公司)、Bcl-2抗体(美国CST公司)、β-肌动蛋白抗体(美国CST公司)和辣根过氧化酶(HRP)标记的二抗(上海Zyme公司)。
2.细胞培养:将食管癌KYSE-150细胞培养接种于RPMI 1640培养基(含有100 U/ml青霉素, 100 mg/L链霉素和10%FBS)中, 置于5%CO2、37℃饱和湿度细胞培养箱中进行培养, 每3~4天传代1次, 取对数生长细胞进行后续实验。
3.细胞转染:取对数生长期的KYSE-150细胞, 以1×104/孔的密度接种于24孔板中, 加入不含抗生素的RPMI 1640细胞培养液, 并于5%CO2、37℃饱和湿度细胞培养箱中培养。待细胞生长至约60%融合时, 利用Lipofectamine 2000将miR-141 mimic组及对照组转染至细胞内, 培养24 h后更换新鲜的培养液, 转染48 h后收集细胞用于后续实验。
4. qRT-PCR检测miR-141的表达:收集待检测的细胞, 使用miRNA抽提试剂盒提取细胞中的miRNA。然后利用One Step PrimeScript® miRNA cDNA Synthesis Kit反转录得到cDNA, 将其加入SYBR® Premix Ex TaqTMⅡ中, 行Real-time PCR扩增。以U6为内参, 使用2-△△Ct法对miR-141的定量结果进行分析。
5.细胞照射:采用美国Varian 2100C直线加速器6 MV X射线为放射源, 源靶距SSD为100 cm, 吸收剂量率400 cGy/min, 照射野为10 cm×10 cm进行照射。
6. CCK-8检测细胞增殖率:将细胞以5×103/孔的密度接种到96孔板中, 培养24 h后, 利用Lipofectamine 2000转染miR-141 mimic及miR-对照至KYSE-150细胞中, 置于4 Gy的放射剂量下进行照射, 于5%CO2、37℃饱和湿度培养箱中进行培养, 48 h后, 每孔加入10 μl CCK-8溶液, 孵育2 h, 检测其在450 nm处的吸光度(A)值, 并计算细胞相对增殖率。
7. Annexin-V/PI双染法测定细胞凋亡率:将转染miR-141 mimics及对照组的KYSE-150细胞置于4 Gy的辐射剂量下进行照射, 照射结束之后, 置于5%CO2、37℃饱和湿度细胞培养箱中进行培养。培养48 h后, 收集细胞, 使用PBS清洗3次, 将细胞消化计数, 调整细胞浓度至1×106/ml, 使用500 μl结合缓冲液重悬细胞。之后, 加入5 μl Annexin V-FITC和5 μl PI混匀, 室温避光孵育15 min, 上流式细胞仪检测细胞的凋亡率。
8.蛋白印迹法检测蛋白表达:提取待测细胞样本的总蛋白, BCA法测定蛋白浓度, 取30 μg蛋白, 于8%~12% SDS-聚丙烯酰胺凝胶中进行电泳分离, 将分离后的蛋白进行转膜, 5%脱脂奶粉室温封闭1 h后, 分别加入一抗(Ki67抗体、Bax抗体和Bcl-2抗体)及内参β-肌动蛋白抗体, 于4℃孵育过夜, 使用TBST洗膜3次后, 加HRP标记的二抗(抗鼠IgG), 37℃孵育1 h, 采用ECL法进行显色, 然后于GIS凝胶图像分析系统拍照, 并分析蛋白表达量的差异。
9.克隆形成实验:将指数期的待检测细胞接种于平皿中, 置于5%CO2、37℃饱和湿度细胞培养箱中培养24 h, 每个设置3个平行。然后进行X射线照射, 照射剂量依次为0、2、4、6、8和10 Gy。照射结束后继续置于5%CO2、37℃饱和湿度细胞培养箱中培养2周。磷酸盐缓冲液(PBS)清洗3次, 10%甲醇进行固定后, 用姬姆萨染色, 并于显微镜下进行集落计数(>50个细胞的集落为有效集落), 克隆形成率(%)=克隆数/接种细胞数×100%。计算克隆形成率并根据单击多靶模型拟合细胞存活曲线。
10.统计学处理:实验数据以x±s表示。采用GraphPad Prism 5统计软件对实验数据进行分析并绘图, 采用t检验比较组间差异。P < 0.05为差异具有统计学意义。
结果1. KYSE-150细胞照射后miR-141的表达:食管癌KYSE-150细胞照射后miR-141的表达水平以剂量依赖的方式逐渐降低, 见图 1。这一结果表明, miR-141可能与食管癌细胞的放射敏感性有关。
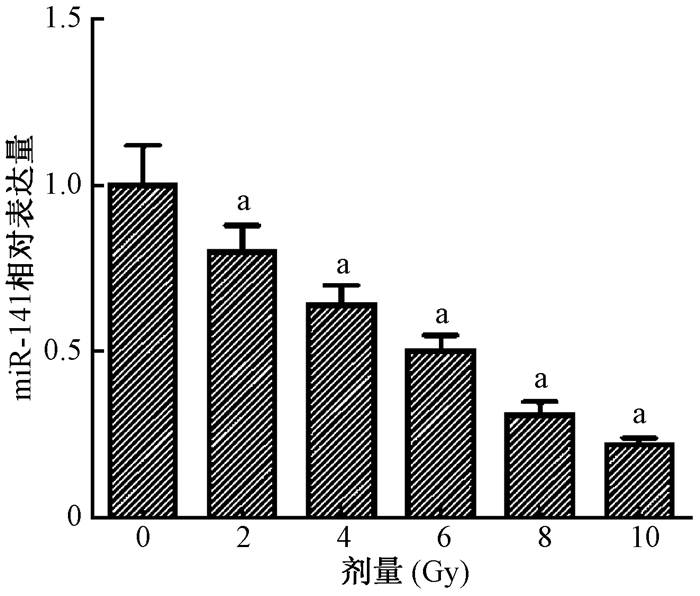
|
图 1 不同剂量处理的KYSE-150细胞内miR-141表达水平 注:a与0 Gy比较, t=2.57~8.96, P < 0.05 Figure 1 The level of miR-141 in KYSE-150 cells treated with varying doses of irradiation |
2.转染miR-141 mimics后KYSE-150细胞中miR-141表达:结果显示, 转染miR-141 mimics细胞中miR-141的表达水平显著高于转染miR-对照细胞中的miR-141的表达水平(t=3.56, P < 0.05), 这一结果证实转染成功。
3. miR-141过表达抑制辐射照射后KYSE-150细胞的增殖:结果见图 2。CCK-8检测结果发现, miR-141 mimics组的增殖率显著低于对照组, 约为对照组的60%(t=5.35, P < 0.01)。此外, 使用Western blot检测了两组细胞中增殖相关蛋白Ki67的表达, 发现与对照组相比, miR-141 mimics组中Ki67蛋白的表达明显减少(t=6.56, P < 0.01)。这些结果表明, miR-141可能通过抑制Ki67的表达, 进而抑制辐射照射后细胞的增殖。
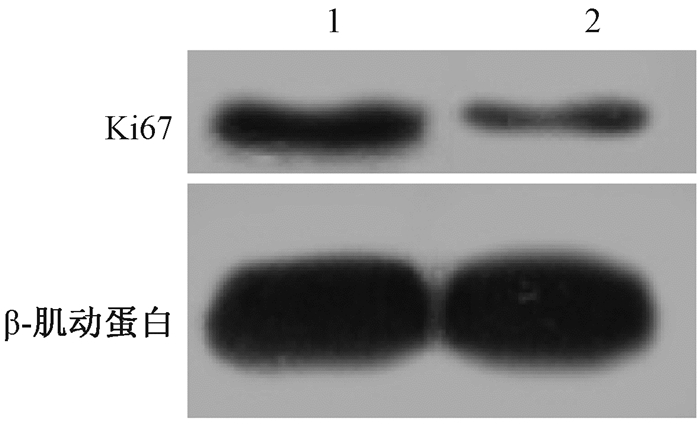
|
图 2 miR-141抑制辐射照射后KYSE-150细胞的增殖 注:1.对照组; 2. miR-141 mimic组 Figure 2 miR-141 overexpression inhibited cell proliferation of KYSE-150 cells treated with irradiation |
4. miR-141促进辐射照射后KYSE-150细胞凋亡:流式细胞仪检测结果发现, 与对照组相比, miR-141过表达显著促进KYSE-150细胞凋亡。此外, 检测了两组细胞中Bax和Bcl-2的表达水平, 发现与对照组(1.0±0.1)相比, miR-141 mimics组(2.1±0.3)中Bax的表达水平显著升高(t=3.24, P < 0.01), 而miR-141 mimics组(0.4±0.1)与对照组(1.0±0.1)相比, Bcl-2的表达水平则显著降低(t=8.24, P < 0.01), 见图 3。结果表明, miR-141过表达可能通过调控凋亡相关蛋白的表达, 促进辐射照射后KYSE-150细胞凋亡。
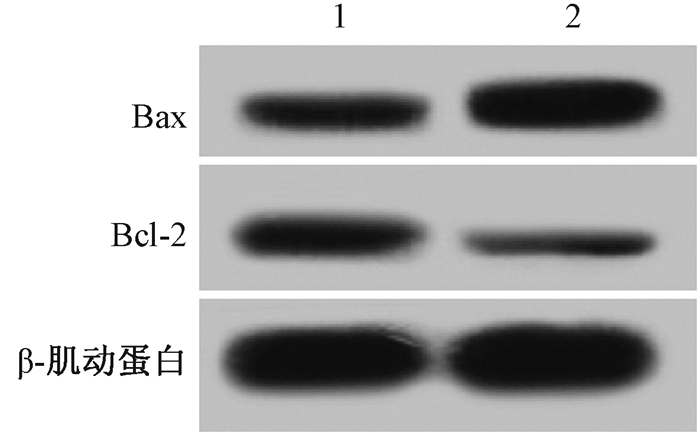
|
图 3 miR-141过表达后对凋亡相关蛋白表达的影响 注:1.对照组; 2. miR-141 mimic组 Figure 3 The effect of miR-141 overexpression on expression of apoptosis-related proteins |
5. miR-141抑制辐射照射后KYSE-150细胞的克隆形成:进一步检测转染miR-141 mimics和对照组的细胞的克隆形成率, 发现与对照组相比, miR-141过表达显著抑制辐射照射后KYSE-150细胞的克隆形成, 见图 4。与对照组相比, miR-141 mimics组具有较高的增敏比(t=3.24, P < 0.05)。综合以上实验表明, miR-141过表达增强KYSE-150细胞的放射敏感性。
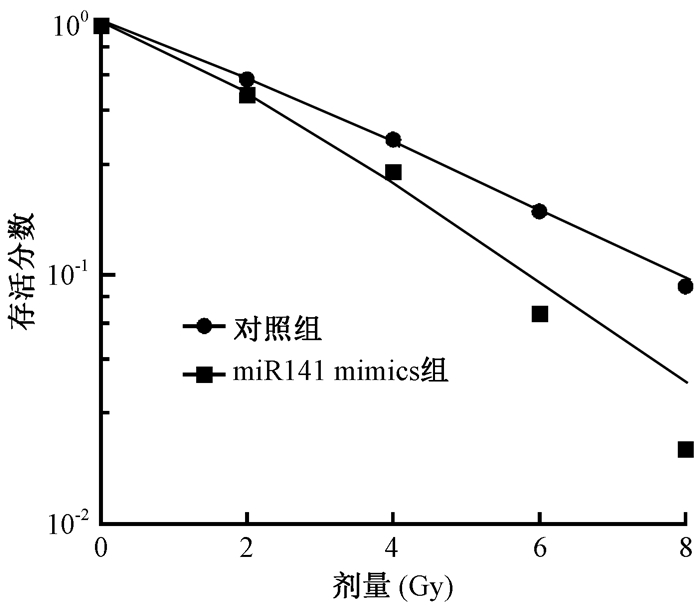
|
图 4 miR-141过表达抑制辐射照射后KYSE-150细胞的存活分数 Figure 4 Survival fraction of KYSE-150 cells treated with miR-141 mimics and varying doses of irradiation |
讨论
miRNA广泛存在真核生物中, 其通过与靶mRNA 3'端非翻译区完全或不完全互补结合, 直接降解mRNA或抑制mRNA翻译来调控靶基因的表达。研究显示, 癌细胞与对应的正常细胞比较, 具有不同的miRNA表达谱, miRNAs的表达异常在肿瘤的发生与发展过程中发挥着原癌基因或抑癌基因的重要作用。例如, miR-34抑制前列腺癌细胞的侵袭和迁移及胃癌的形成, miR-146a抑制胰腺癌细胞的侵袭, miR-200调控膀胱癌细胞的间质化, miR-373和miR-29c调节食管癌细胞的增殖与凋亡[6-7]。
近几年, 越来越多的研究表明, 肿瘤的放射敏感性与细胞中miRNA的异常表达有关, 选择性的抑制或促进相关miRNA的表达可增强肿瘤细胞的放射敏感性。Liu等[3]报道miR-449a通过增加照射剂量诱发DNA损伤, 进而改变细胞周期分布来提高肺癌细胞系放射敏感性。有研究发现, miRNA-17-92簇的高表达增加淋巴瘤细胞的放射耐受性[2]。有研究指出, 在胃癌中, miR-221和miR-222通过靶向PTEN调节胃癌细胞的增殖和放射敏感性[8]。另外, miR-34b高表达可增强非小细胞肺癌的放射敏感性[5]。Qu等[4]研究放射抵抗的鼻咽癌细胞系与母本细胞系的miRNAs表达谱, 发现相对于母本鼻咽癌细胞系, 放射抵抗的鼻咽癌细胞系中有37个miRNAs表达显著上调, 29个miRNAs显著下调, 进一步又研究了下调表达的miR-205的作用及机制, 发现miR-205通过下调PTEN基因的表达, 增加鼻咽癌细胞系的放射耐受性。上述研究均表明, miRNAs通过调控癌细胞的增殖和凋亡, 影响肿瘤放射敏感性。
在食管癌中, Su等[5]通过低剂量射线多次进行照射诱导生成放射抵抗的食管癌细胞系KYSE-150R, 采用miRNA微阵列分析放射抵抗的鼻咽癌细胞系与母本细胞系的miRNA表达谱, 发现相对于母本细胞系, KYSE-150R细胞系有10个miRNA表达显著上调, 25个miRNA显著下调, 并且使用qRT-PCR进一步证实了miR-301a、miR-141和miR-18b显著下调, 进一步研究miR-301a的作用及机制, 发现其通过上调Wnt1促进KYSE-150R细胞的放射耐受性。miR-141作为一个与癌症发生相关的miRNA, 在多种癌症中被研究。研究发现, miR-141抑制肝癌、胃癌和胰腺癌细胞的侵袭和迁移, 改善结肠癌的预后[9-10]。另外, Imanaka等[11]发现miR-141通过靶向YAP1增强了食管癌对顺铂的耐受力。但是miR-141对食管癌细胞放射敏感性的影响目前尚未有研究报道。在本研究中, 发现miR-141随食管癌细胞放射剂量的增加而降低。进一步研究miR-141过表达对KYSE-150细胞的放射敏感性的影响, 发现miR-141过表达显著抑制辐射照射后细胞增殖和克隆形成, 并促进凋亡, 结果表明, miR-141增强KYSE-150细胞的放射敏感性。肿瘤防治的关键是抑制肿瘤细胞增殖和促进肿瘤细胞凋亡。本研究中, 对miR-141的可能作用机制研究发现, miR-141过表达显著抑制放射处理的KYSE-150细胞中增殖相关蛋白Ki67和抗凋亡蛋白Bcl-2表达, 并促进促凋亡蛋白Bax的表达。因此推测, miR-141过表达可能通过调控KYSE-150细胞中增殖相关蛋白Ki67和抗凋亡蛋白Bcl-2表达, 增强细胞对放射的敏感性。
总之, 本实验首次在体外实验中明确miR-141增强食管癌细胞KYSE-150的放射敏感性, 并且对其可能作用机制做了初步研究。对寻找新的治疗靶, 提高临床放疗效果, 发展新的食管癌治疗手段提供了实验依据。
利益冲突 无作者贡献声明 张斌负责动物模型的建立、部分实验操作及论文撰写; 刘冬梅、马艳会、郜娜负责实时荧光定量PCR及蛋白免疫印迹; 贺春雨、赵秀莉负责数据收集、统计分析; 张景伟负责整体实验设计、论文撰写指导及修改
| [1] | Wienholds E, Plasterk RH. MicroRNA function in animal development[J]. FEBS Lett, 2005, 579 (26) : 5911-5922 DOI:10.1016/j.febslet.2005.07.070 |
| [2] | Jiang P, Rao EY, Meng N, et al. MicroRNA-17-92 significantly enhances radioresistance in human mantle cell lymphoma cells[J]. Radiat Oncol, 2010, 5 (1) : 1 DOI:10.1186/1748-717X-5-100 |
| [3] | Liu YJ, Lin YF, Chen YF, et al. MicroRNA-449a enhances radiosensitivity in CL1-0 lung adenocarcinoma cells[J]. PLoS One, 2013, 8 (4) : e62383 DOI:10.1371/journal.pone.0062383 |
| [4] | Qu C, Liang Z, Huang JL, et al. MiR-205 determines the radioresistance of human nasopharyngeal carcinoma by directly targeting PTEN[J]. Cell Cycle, 2012, 11 (4) : 785-796 DOI:10.4161/cc.11.4.19228 |
| [5] | Su H, Jin X, Zhang X, et al. Identification of microRNAs involved in the radioresistance of esophageal cancer cells[J]. Cell Biol Int, 2014, 38 : 318-325 DOI:10.1002/cbin.10202 |
| [6] | Liu C, Kelnar K, Liu B, et al. The microRNA miR-34a inhibits prostate cancer stem cells and metastasis by directly repressing CD44[J]. Nature Med, 2011, 17 (2) : 211-215 DOI:10.1038/nm.2284 |
| [7] | Li Y, VandenBoom TG, Wang Z, et al. miR-146a suppresses invasion of pancreatic cancer cells[J]. Cancer Res, 2010, 70 (4) : 1486-1495 DOI:10.1158/0008-5472 |
| [8] | Chun-zhi Z, Lei H, An-ling Z, et al. MicroRNA-221 and microRNA-222 regulate gastric carcinoma cell proliferation and radioresistance by targeting PTEN[J]. BMC Cancer, 2010, 10 (1) : 1 DOI:10.1186/1471-2407-10-367 |
| [9] | Liu Y, Ding Y, Huang J, et al. MiR-141 suppresses the migration and invasion of HCC cells by targeting Tiam1[J]. PLoS One, 2014, 9 (2) : e88393 DOI:10.1371/journal.pone.0088393 |
| [10] | Xu L, Li Q, Xu D, et al. hsa-miR-141 downregulates TM4SF1 to inhibit pancreatic cancer cell invasion and migration[J]. Int J Oncol, 2014, 44 (2) : 459-466 DOI:10.3892/ijo.2013.2189 |
| [11] | Imanaka Y, Tsuchiya S, Sato F, et al. MicroRNA-141 confers resistance to cisplatin-induced apoptosis by targeting YAP1 in human esophageal squamous cell carcinoma[J]. J Hum Genet, 2011, 56 (4) : 270-276 DOI:10.1038/jhg.2011.1 |
 2016, Vol. 36
2016, Vol. 36
