微小RNA (microRNAs, miRNAs)是一类长度约为20~22个核苷酸的非编码RNA。通过与靶基因的3'非编码区(3'UTR)互补配对来调节靶基因的表达[1]。近年来, 研究发现, miRNAs的异常表达在肿瘤发生、发展中起着重要的作用, 影响着肿瘤细胞的增殖、凋亡、分化、转移等过程, 起着促癌[2-4]或抑癌[5-7]的作用。此外, miRNAs还与肿瘤的辐射响应密切相关, 且越来越多的研究证实多个miRNAs可以调节肿瘤细胞的辐射响应[8]。有研究表明, miR-101在多种肿瘤中表达下调[9-11]。Yan等[12]以肺癌细胞系为研究对象, 发现miR-101能与DNA-PK catalytic subunit (DNA-PKcs)和ATM相互作用, 通过降低蛋白的表达量影响肿瘤细胞的辐射敏感性。有研究证实, miR-101在宫颈癌组织中的表达明显下调[9], 但miR-101是否参与宫颈癌的放疗敏感性调节以及具体调节机制, 尚无相关研究。本研究通过体外转染miRNA模拟物(miR-101 mimic)的方法探究miR-101对HeLa细胞辐射敏感性的影响及具体调节机制。
材料与方法1.主要试剂和仪器:riboFECTTM CP转染试剂、miRNA模拟物(miR-101 mimic)、miRNA模拟物阴性对照(miR-NC mimic)、miR-101和U6的颈环法特异性反转录引物、PCR引物均购自广州锐博生物科技有限公司, 因商业因素, 未提供模拟物和引物序列; miRNA提取试剂盒购自哈尔滨北国海基生物科技有限公司; 反转录试剂盒购自德国罗氏公司; SYBR Green PCR试剂盒购自英国ABI公司; DNA-PKcs、ATM及γ-H2AX抗体均购自英国Abcam公司; β-肌动蛋白抗体购自苏州麦斯福生物科技有限公司; 二抗购自北京康为世纪公司; 人宫颈癌HeLa细胞由本实验室提供; DMEM细胞培养基、小牛血清购自美国GIBCO公司。多功能酶标仪(美国Bio-Tek公司, Synergy 2);实时荧光定量仪(美国Applied Biosystems公司, ViiA7);核酸浓度检测仪(美国Thermo Scientific公司, 2000c); X射线照射仪(美国Radsource公司, RS2000Pro); 荧光正置显微镜(德国Leica公司, DM2000);多色荧光化学发光成像分析系统(美国Alpha公司, FluorChem M)。
2.细胞培养:HeLa细胞在含有10%的小牛血清和1%双抗(100 U/ml青霉素、100 μg/ml链霉素)的DMEM培养基中培养, 置于37℃、5%CO2、饱和湿度的培养箱中孵育。细胞贴壁生长良好, 每2~3天传代一次, 取对数生长期细胞进行实验。
3.细胞转染:取对数生长期细胞, 制备成单细胞悬液, 铺板在6孔板中, 分为3组:空白对照组、阴性对照组、实验组。待细胞密度达到50%~70%时对细胞进行处理。空白对照组不作任何处理, 阴性对照组加入miR-NC mimic和转染试剂, 实验组加入miR-101 mimic和转染试剂。转染后无需换液, 置入培养箱继续培养, 之后直接进行后续实验。
4.实时定量PCR实验:细胞转染48 h后, 使用miRNA提取试剂盒进行miRNA抽提, 实验过程完全按照试剂盒使用说明进行, 抽提之后, 使用核酸浓度检测仪检测RNA浓度和纯度, 最后将其浓度稀释至50 ng/μl; 使用特异性反转录引物进行cDNA合成, 反应条件按照cDNA合成试剂盒使用说明进行设置; 用SYBR Green法进行实时定量PCR, 反应条件:95℃预变性10 min、95℃变性15 s、60℃退火32 s, 循环50次后检测溶解曲线, 检测完成后, 计算机系统自动分析各样本Ct值, 导出数据后, 采用2-ΔΔCt计算基因的相对表达量。每个样本取3个重复孔, miRNA中以U6作为内参基因。
5.细胞克隆实验:HeLa细胞转染miR-101 mimic或miR-NC mimic 24 h后, 胰酶消化均匀后以500/孔的密度种入直径为60 mm培养皿中, 加培养基至2 ml。分为3组:空白对照组、阴性对照组、实验组, 每组设3个平行样, 于5%CO2、37℃常规条件下培养24 h, 使其贴壁, 每个培养皿更换4 ml新鲜培养基, 再置于5%CO2、37℃饱和湿度培养箱继续培养14 d, 期间每3天换一次液。之后用甲醇和姬姆萨染液对细胞进行固定和染色, 待细胞自然晾干后在显微镜下进行克隆计数, 多于50个细胞的集落作为1个克隆。细胞克隆形成率(PE)=克隆数/接种细胞数×100%。实验重复3次, 取均值。
6.克隆形成实验检测细胞放射敏感性:HeLa细胞转染miR-101 mimic或miR-NC mimic 24 h后, 胰酶消化均匀后接种于直径为60 mm培养皿中, 随着剂量的增高相应增加接种的细胞数, 在照射剂量为0、2、4、6、8 Gy时的细胞数分别为500、500、2 000、6 000、10 000/孔。培养24 h之后接受X射线照射。照射条件为:采用160 kVp X射线照射, 照射剂量分别为2、4、6、8 Gy, 照射剂量率为1.15 Gy/min, 源靶距40 cm。照射6 h后换新鲜培养基, 细胞培养、染色及克隆形成率计算与克隆实验相同。细胞存活分数(SF)=受照细胞克隆形成率/对照细胞的克隆形成率。实验重复3次, 取均值。以对照组的PE作为100%计算SF, 用Prism 5.0软件按多靶单击模型SF=S=1-(1-e-D/D\-0)N, 拟合细胞存活曲线, 阈剂量Dq=D0lnN。根据D0和Dq值, 分别计算出放射增敏比SERD0和SERDq。
7. γ-H2AX免疫荧光染色实验:转染miR-101 mimic或miR-NC mimic 24 h后的HeLa细胞, 重新铺板于35 mm加有细胞爬片的培养皿中, 培养24 h后接受0、4 Gy的X射线照射, 照射后均再培养2 h, 用预冷的4%多聚甲醛在4℃冰箱中固定20 min, 0.2% Triton X-100 4℃破膜20 min, 2%BSA室温封闭1 h, 加入50 μl 2%BSA稀释的抗γ-H2AX小鼠单克隆抗体后, 放置于4℃冰箱过夜, 加入50 μl 1%BSA稀释的羊-抗-鼠-FITC二抗, 室温孵育1 h。载玻片上加30 μl含DAPI染色液的抗荧光淬灭封片液, 室温避光30 min, 4℃避光保存。荧光正置显微镜下观测每个细胞核内DNA双链断裂所产生的荧光焦点数量, 每组至少计数50个细胞中的荧光斑点数, 计算每个细胞中的平均荧光焦点数。
8.Western blot检测DNA-PKcs和ATM蛋白表达:HeLa细胞转染miR-101 mimic或miR-NC mimic 48 h后提取总蛋白, 用BCA蛋白测定试剂盒测定蛋白浓度, 上样60 μg总蛋白, 在4%~12%的SDS聚丙烯酰胺凝胶中电泳, 用湿转的方式把蛋白转到PVDF膜上, 5%脱脂奶粉室温封闭1 h, 一抗4℃摇床孵育过夜, 1×TBST洗膜3次, 每次10 min, 二抗室温孵育1 h, 1×TBST洗膜4次, 每次10 min, 1×TBS洗膜1次, 超敏ECL化学发光试剂盒显色后曝光, 其中β-肌动蛋白为内参蛋白。
9.统计学处理:数据用x±s表示, 应用SPSS 16.0软件进行分析。组间比较采用方差分析, 多重比较采用LSD检验。P < 0.05为差异有统计学意义。
结果1.不同处理的HeLa细胞miR-101的表达情况:qRT-PCR法检测表明, 不同条件处理HeLa细胞48 h后, 把空白对照组中miR-101的表达量设为1.00±0.00, 则阴性对照组和实验组中miR-101的相对表达量分别为0.44±0.20和12.94±0.86。与空白对照组相比, 实验组miR-101的表达量显著升高(t=14.16, P < 0.05), 而阴性对照组miR-101的表达量无明显变化(P > 0.05)。基于此结果, 后续实验中以可以显著提高HeLa细胞中miR-101表达量的48 h作为miR-101 mimic的处理时间。
2. miR-101对HeLa细胞的毒性:克隆形成实验结果显示, 空白对照组、阴性对照组和实验组HeLa细胞存活分数分别为100%、67.8%、38.6%, 表明miR-101对HeLa细胞具有明显的毒性作用(t=10.75, P < 0.05)。另外, 转染试剂对HeLa细胞也具有一定的毒性作用。
3. miR-101对HeLa细胞的放射增敏作用:图 1为不同处理的HeLa细胞存活率曲线。空白对照组与阴性对照组之间细胞存活率无明显差异(P > 0.05), 阴性对照组与实验组之间细胞存活率存在明显差异(F=7.72, P < 0.05), 表明miR-101过表达可以增加HeLa细胞的辐射敏感性。空白对照组、阴性对照组和实验组D0值分别为1.81、1.80、1.50, Dq值分别为1.36、1.23、1.05, miR-101对HeLa细胞的SERD0、SERDq分别为1.20、1.29。
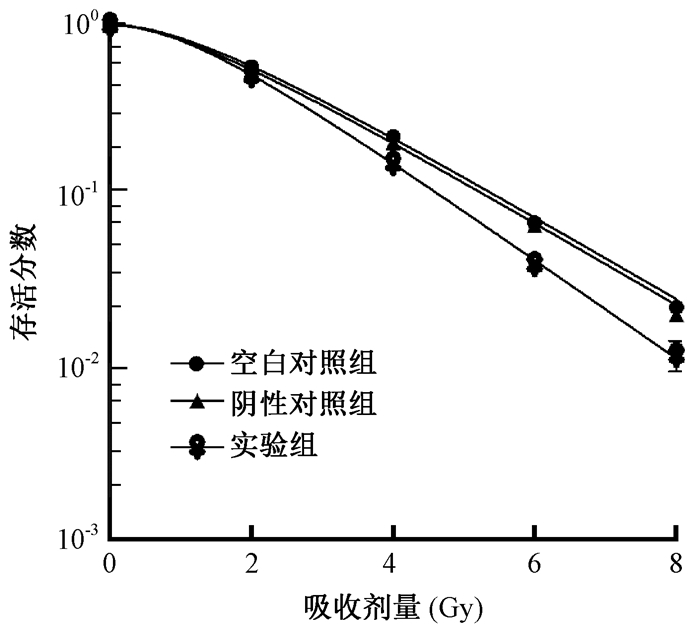
|
图 1 不同剂量下各处理组的HeLa细胞存活曲线 Figure 1 Survival curves of the HeLa cells with different treatments at different doses |
4. miR-101对HeLa细胞DNA损伤的影响:图 2为不同处理的HeLa细胞DNA双链断裂情况。经miR-101 mimic或miR-NC mimic处理后, 未照射条件下, 空白对照组、阴性对照组和实验组细胞细胞核内DNA双链断裂所产生的荧光焦点数量分别为3.10±0.27、2.02±0.31、2.94±0.32, 各组间差异无统计学意义(P > 0.05);4 Gy X射线照射后, 空白对照组、阴性对照组和实验组细胞细胞核内DNA双链断裂所产生的荧光焦点数量分别为11.80±0.35、12.38±0.39、29.82±0.73。与空白对照组相比, 实验组细胞细胞核内DNA双链断裂所产生的荧光焦点数量多(t=22.36, P < 0.05), 阴性对照组细胞荧光焦点数无明显差异(P > 0.05)。
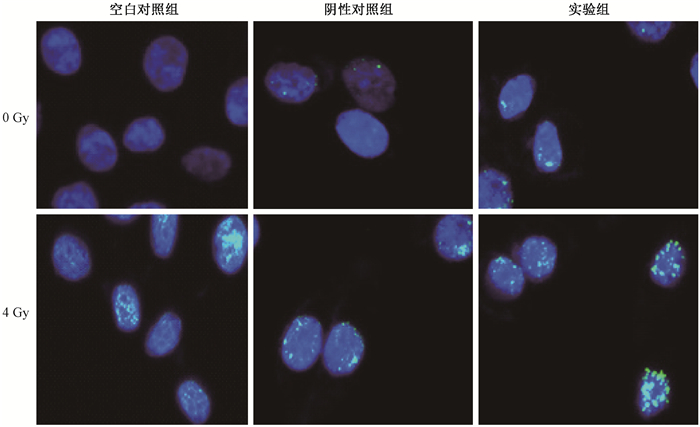
|
图 2 不同处理的HeLa细胞DNA双链断裂情况×400 Figure 2 The expressions of γ-H2AX foci in the HeLa cells with different treatments ×400 |
5. miR-101对HeLa细胞中ATM和DNA-PKcs蛋白表达的影响:图 3为不同处理的HeLa细胞ATM和DNA-PKcs蛋白表达情况。结果显示miR-101表达上调的HeLa细胞中, ATM和DNA-PKcs蛋白表达明显下调, 空白对照组与阴性对照组相比, ATM和DNA-PKcs蛋白表达水平无明显差异。
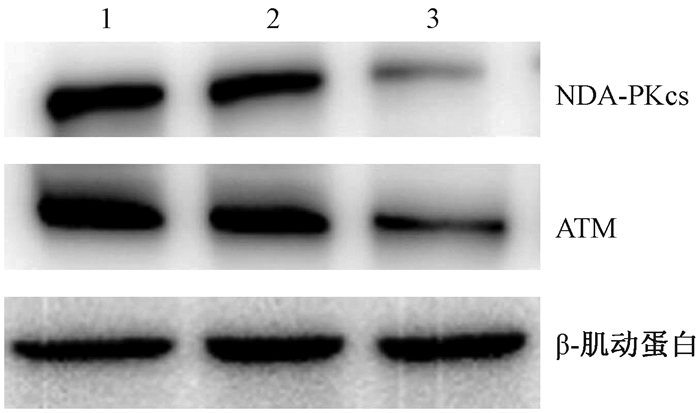
|
图 3 不同处理的HeLa细胞ATM和DNA-PKcs蛋白表达情况 注:1.空白对照组; 2.阴性对照组; 3.实验组 Figure 3 The protein expressions of ATM and DNA-PKcs in HeLa cells with different treatments |
讨论
miR-101是近年来研究较多的一种miRNA。Lavin等[17]报道成熟miR-101长度为22个核苷酸, 序列是UACAGUACUGUGAUAACUGAAG。已有研究表明, miR-101在多种肿瘤组织中表达下调, 影响着肿瘤细胞的增殖、凋亡、转移等过程, 并可能影响肿瘤细胞的辐射响应[9-11]。Sun等[15]以鼻咽癌为研究对象, 发现miR-101在鼻咽癌细胞系中表达明显下调, 通过体外转染miR-101 mimic的方法使miR-101的表达水平上调之后发现, miR-101能抑制stathmin1蛋白的表达, 从而提高鼻咽癌细胞的辐射敏感性。Yan等[12]以肺癌细胞系为研究对象, 人为上调miR-101的表达水平, 发现miR-101能与DNA-PKcs和ATM相互作用, 通过降低蛋白的表达量提高肿瘤细胞的辐射敏感性。
已有研究表明, 在HeLa细胞中, miR-101低表达[14]。本项研究以HeLa细胞为研究对象, 采用脂质体转染miR-101 mimic的方法在HeLa细胞中过表达miR-101, 探究miR-101对宫颈癌辐射敏感性的影响。实验结果表明, HeLa细胞miR-101的表达上调后, D0、Dq值均降低, 表明细胞对射线敏感性增加, 放射增敏比达到1.29, 表明miR-101对HeLa细胞具有辐射增敏作用, 对于miR-101低表达的肿瘤细胞, miR-101可以增加肿瘤细胞的辐射敏感性。
电离辐射引起的损伤中, DNA DSBs是最致命的, 未修复的DNA双链断裂数量增加表明细胞的存活率减少, 即辐射敏感性提高, 故DSBs是与辐射敏感性密切相关的一个重要指标[15], 磷酸化的H2AX (γ-H2AX)与DSBs在数量上是1:1的关系, 检测γ-H2AX是测量DSBs的一个重要方法[16]。本研究应用免疫荧光法检测了不同处理的HeLa细胞γ-H2AX的荧光焦点数, 研究发现, 过表达miR-101的HeLa细胞γ-H2AX荧光焦点数明显增加, 表明miR-101是通过阻止DNA损伤修复来提高HeLa细胞的辐射敏感性。
哺乳动物细胞有两条主要的DNA DSBs修复通路:同源重组修复(homologous recombination repair, HRR)和非同源末端连接(non-homologous end-joining, NHEJ)。其中, ATM是HRR通路中的一个重要多功能蛋白[17], 主要促进HRR[18]; DNA-PKcs蛋白是NHEJ通路中的一个因子[19-20]。DNA-PKcs和ATM是DNA损伤修复通路中的两个重要蛋白, ATM或者DNA-PKcs蛋白表达下调的人类细胞对放射线更敏感[21]。本研究发现, 过表达miR-101的HeLa细胞ATM和DNA-PKcs蛋白表达明显下调。这表明, miR-101可以通过阻断DNA损伤修复通路来提高HeLa细胞的辐射敏感性。本研究的实验结果为miR-101应用于宫颈癌的放射治疗提供了实验和理论依据。
本研究也表明, 实验所用的riboFECTTM CP转染试剂本身对HeLa细胞具有一定的毒性作用, 对于临床应用来说, 还需要寻找更低毒高效的miR-101 mimic转染方法; 另外, 本次研究是在细胞水平上进行的, 没有涉及到体内实验, 还需要进一步的研究。
利益冲突 无作者贡献声明 史盼影负责进行试验、论文撰写; 林温文负责整理数据、论文修改; 张保国负责提出研究思路、设计研究方案、分析数据和论文修改
| [1] | Mendell JT. MicroRNAs:critical regulators of development, cellular physiology and malignancy[J]. Cell Cycle, 2005, 4 (9) : 1179-1184 DOI:10.4161/cc.4.9.2032 |
| [2] | Chan JA, Krichevsky AM, Kosik KS. MicroRNA-21 is an antiapoptotic factor in human glioblastoma cells[J]. Cancer Res, 2005, 65 (14) : 6029-6033 DOI:10.1158/0008-5472.CAN-05-0137 |
| [3] | Tian Y, Luo A, Cai Y, et al. MicroRNA-10b promotes migration and invasion through KLF4 in human esophageal cancer cell lines[J]. J Biol Chem, 2010, 285 (11) : 7986-7994 DOI:10.1074/jbc.M109.062877 |
| [4] | Zhang CZ, Han L, Zhang AL, et al. microRNA-221 and microRNA-222 regulate gastric carcinoma cell proliferation and radioresistance by targeting PTEN[J]. BMC Cancer, 2010, 10 : 367 DOI:10.1186/1471-2407-10-367 |
| [5] | Calin GA, Cimmino A, Fabbri M, et al. MiR-15a and miR-16-1 cluster functions in human leukemia[J]. Proc Natl Acad Sci USA, 2008, 105 (13) : 5166-5171 DOI:10.1073/pnas.0800121105 |
| [6] | Park SY, Lee JH, Ha M, et al. MiR-29 miRNAs activate p53 by targeting p85α and CDC42[J]. Nat Struct Mol Biol, 2009, 16 (1) : 23-29 DOI:10.1038/nsmb.1533 |
| [7] | Yang Z, Chen S, Luan X, et al. MicroRNA-214 is aberrantly expressed in cervical cancers and inhibits the growth of HeLa cells[J]. IUBMB Life, 2009, 61 (11) : 1075-1082 DOI:10.1002/iub.252 |
| [8] | Metheetrairut C, Slack FJ. MicroRNAs in the ionizing radiation response and in radiotherapy[J]. Curr Opin Genet Dev, 2013, 23 (1) : 12-19 DOI:10.1016/j.gde.2013.01.002 |
| [9] | 林晨, 陈锐, 拉莱·苏祖克, 等. 微小RNA-101在子宫颈鳞癌组织中的表达及其意义[J]. 中华妇产科杂志, 2011, 46 (9) : 699-700 Lin C, Chen R, Suzuke L, et al. The expression and significance of micro RNA-101 in cervical squamous cell carcinoma[J]. Chin J Obstetr Gynecol, 2011, 46 (9) : 699-700 DOI:10.3760/cma.J.issn.0529-567x.2011.09.014 |
| [10] | He XP, Shao Y, Li XL, et al. Downregulation of miR-101 in gastric cancer correlates with cyclooxygenase-2 overexpression and tumor growth[J]. FEBS J, 2012, 279 (22) : 4201-4212 DOI:10.1111/febs.12013 |
| [11] | Sun Q, Liu T, Zhang T, et al. MiR-101 sensitizes human nasopharyngeal carcinoma cells to radiation by targeting stathmin 1[J]. Mol Med Rep, 2015, 11 (5) : 3330-3336 DOI:10.3892/mmr.2015.3221 |
| [12] | Yan D, Ng WL, Zhang X, et al. Targeting DNA-PKcs and ATM with miR-101 sensitizes tumors to radiation[J]. PLoS One, 2010, 5 (7) : e11397 DOI:10.1371/journal.pone.0011397 |
| [13] | Mourelatos Z, Dostie J, Paushkin S, et al. miRNPs:a novel class of ribonucleoproteins containing numerous microRNAs[J]. Genes Dev, 2002, 16 (6) : 720-728 DOI:10.1101/gad.974702 |
| [14] | Su H, Yang JR, Xu T, et al. MicroRNA-101, down-regulated in hepatocellular carcinoma, promotes apoptosis and suppresses tumorigenicity[J]. Cancer Res, 2009, 69 (3) : 1135-1142 DOI:10.1158/0008-5472.CAN-08-2886 |
| [15] | Panier S, Durocher D. Regulatory ubiquitylation in response to DNA double-strand breaks[J]. DNA Repair (Amst), 2009, 8 (4) : 436-443 DOI:10.1016/j.dnarep.2009.01.013 |
| [16] | Fernandez-Capetillo O, Lee A, Nussenzweig M, et al. H2AX:the histone guardian of the genome[J]. DNA Repair (Amst), 2004, 3 (8-9) : 959-967 DOI:10.1016/j.dnarep.2004.03.024 |
| [17] | Lavin MF. Ataxia-telangiectasia:from a rare disorder to a paradigm for cell signalling and cancer[J]. Nat Rev Mol Cell Biol, 2008, 9 (10) : 759-769 DOI:10.1038/nrm2514 |
| [18] | Golding SE, Rosenberg E, Khalil A, et al. Double strand break repair by homologous recombination is regulated by cell cycle-independent signaling via ATM in human glioma cells[J]. J Biol Chem, 2004, 279 (15) : 15402-15410 DOI:10.1074/jbc.M314191200 |
| [19] | Chan DW, Chen BP, Prithivirajsingh S, et al. Autophosphorylation of the DNA-dependent protein kinase catalytic subunit is required for rejoining of DNA double-strand breaks[J]. Genes Dev, 2002, 16 (18) : 2333-2338 DOI:10.1101/gad.1015202 |
| [20] | Collis SJ, DeWeese TL, Jeggo PA, et al. The life and death of DNA-PK[J]. Oncogene, 2005, 24 (6) : 949-961 DOI:10.1038/sj.onc.1208332 |
| [21] | van Gent DC, Hoeijmakers JH, Kanaar R. Chromosomal stability and the DNA double-stranded break connection[J]. Nat Rev Genet, 2001, 2 (3) : 196-206 DOI:10.1038/35056049 |
 2016, Vol. 36
2016, Vol. 36


