放射治疗在肝癌尤其是局部晚期不可手术切除肝癌的治疗中发挥着越来越重要的作用。但由于放射性肝损伤和放疗抗拒性的存在, 极大地限制了放疗在肝癌中的应用[1-2]。放射增敏剂可以增强肿瘤细胞的放射性损伤, 同时可以减少正常细胞的受损[3]。纳米金颗粒(gold nanoparticles, GNPs)表面易于修饰各种抗体、肽、适体或药物, 近年来GNPs作为放射增敏剂以及在药物载体方面的应用受到广泛的关注[4-5]。
癌细胞表面或细胞外基质蛋白质生物标记物相对应的配体可以作为特定的药物治疗的靶点[6]。去唾液酸糖蛋白受体(asialoglycoprotein, ASGPR)表达于肝脏的特异性受体, 单个肝脏细胞表面表达大约5×105个ASGPRs[7]。半乳糖、乙酰半乳糖胺、唾液酸胎球蛋白是常用来作为ASGPR介导捕获和内吞作用的受体[8]。GNPs对放射强度的提高依赖其数量以及射线的能量, 本研究以ASGPRs为靶点, 采用β-D-galactose (GAL)修饰GNPs, 以期提高GNPs在靶细胞内的聚集浓度, 进而增加其作为放射增敏剂的细胞毒性效应。为防止GNPs被网状内皮系统(RES)迅速吞噬降解, 引入生物相容性的聚乙二醇(PEG)形成新型的靶向复合物GAL-PEG-GNPs。在高表达ASGPR的HepG2细胞中, 研究GAL-PEG-GNPs的靶向性、放射增敏性及潜在放射增敏机制。
材料与方法1.主要试剂与仪器:DMEM培养基、胎牛血清购自美国Invitrogen公司, 含2%EDTA胰酶、邻二硫吡啶-聚乙二醇-琥珀酰亚胺戊酸酯、巯基-聚乙二醇、半乳糖酸以及γ-H2AX、Cytochrome C、Caspase-3、Caspase-9、Bcl-2、Bax抗体和二抗购自美国Sigma公司, 过氧化氢酶/超氧化物歧化酶/总促甲状腺激素(CAT/SOD/总TSH)检测试剂盒、Annexin/V-7AAD、CCK-8试剂盒购自南京苏雅生物科技有限公司, 动态光散射仪购自英国Malvern公司产品, UV-2300紫外光分光光度计购自天津港东科技发展有限公司, 流式细胞仪购自美国BD公司, 激光共聚焦显微镜购自德国Zeiss公司, 透射电子显微镜购自日本JEOL公司, 医用电子直线加速器购自德国Siemens Primus公司, 酶标仪购自美国BioRad公司。
2.细胞培养:采用高表达ASGPR的人肝癌HepG2细胞。使用含10%胎牛血清以及1%青霉素-链霉素的DMEM培养液, 培养条件为37℃、5%CO2。细胞进入对数生长期且密度达到70%时使用, 含EDTA 0.25%胰酶消化传代细胞。
3. GAL-PEG-GNPs的制备:采用柠檬酸钠还原法制备直径20 nm的GNPs球型颗粒, 取0.1 ml浓度为0.1 mg/L (pH 7.5)的GNPs, 加入过量的巯基-PEG-氨基分子(SH-PEG-NH2)4℃孵育过夜, 以部分取代GNPs表面的柠檬酸根, 形成一部分表面修饰有氨基基团的GNPs颗粒复合体; 复合体继续修饰过量的巯基-PEG分子(SH-PEG), 完全取代掉GNPs表面剩余的柠檬酸根, 形成SH-PEG-NH2分子和SH-PEG分子交替修饰的GNPs复合体。产物通过1×PBS (pH 7.5)超滤纯化。100 μl的EDC[1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)]和sulfo-NHS (磺基-N-羟基丁二酰亚胺)按照5:1混合, 并与20 μg的半乳糖混合, 在37℃条件下孵育6 h。将20 μl浓度为0.1 mg/L PEG化的GNPs加入到上述产物中, pH调整至7.2, 在37℃孵育2 h形成最终产物。产物经收集过滤后保存在4℃环境下。
4. GAL-PEG-GNPs表征鉴定:上述方法制备的纳米粒子在水溶性条件下能够形成均匀纳米粒子, 采用动态光散射仪(DLS)和透射电镜(TEM)检测粒径大小, ICP-MS检测纳米粒子的浓度。应用紫外分光光度计(UV-vis)测定产物的紫外光谱, 考察修饰后GNPs颗粒的变化。
5. HepG2细胞增殖抑制实验:CCK-8检测细胞增殖水平依据其说明书进行, 具体如下:细胞种植于96孔板, 细胞数量约3 000/孔。GNPs和GAL-PEG-GNPs用细胞培养液(pH 7.4)稀释到不同浓度后加到96孔板中。24 h孵育过夜, 每孔加入20 μl CCK-8孵育4 h。酶标仪测定490 nm处吸光度(A)值, 计算不同浓度下的细胞抑制率。抑制率(%)=1-实验组A值/对照组A值×100%。计算GAL-PEG-GNPs对HepG2细胞24 h的IC50值。后续实验纳米颗粒溶液的浓度均采用1/5 IC50。
6.纳米颗粒摄取实验:HepG2细胞接种于培养皿中, 密度为1×106/ml。待细胞生长至70%时, 更换含有终浓度为1/5 IC50值的GNPs和GAL-PEG-GNPs培养液, 继续培养不同时间(1、2、4、8、12、24、48、72、96 h)后收集细胞, 并将总量体积定容为5 ml, 将细胞总量计数为n。加入等体积5 ml 20%的HNO3溶液, 室温下静置24 h; 将裂解后含GNPs的裂解液用ICP-MS测定金元素的质量浓度、GNPs颗粒的总数量n和计算GNPs颗粒的摩尔浓度, 并依此计算每个细胞中含有的GNPs颗粒数(n/N)。实验重复3次。
7. TEM实验:细胞接种于15 mm×90 mm培养皿中, 密度为2×106/ml, 细胞生长至70%时, 更换含有1/5 IC50 GNPs和GAL-PEG-GNPs的培养液, 继续培养24 h。将细胞用胰酶消化, 2.5%戊二醛固定3 h, 去除戊二醛后, 再次用1%的四氧化锇固定1 h, 用无水乙醇与丙酮进行梯度脱水处理后, 环氧树脂包埋。检测时使用切片机将细胞超薄切片, 用乙酸铀酰与柠檬酸铅染色后TEM观察并照相。
8.细胞克隆形成实验:实验分HepG2细胞照射组、GNPs与HepG2细胞联合照射组、GAL-PEG-GNPs与HepG2细胞联合照射组。细胞接种于6孔板中, 每孔细胞分别为100、100、300、1 000、5 000、10 000, 分别接受0、1、2、4、6和8 Gy剂量的照射; 照射后放入培养箱继续培养10~14 d, 当出现肉眼可见的克隆时终止培养。弃PBS缓冲液冲洗1次, 无水乙醇固定, 结晶紫染液避光染色, 常温下晾干。显微镜下计数>50个细胞的克隆数。细胞克隆形成率(%)=(克隆形成数/接种细胞数)×100%, 并计算细胞存活分数, 按多靶单击模型拟合细胞存活曲线, 计算Dq、D0值、放射增敏比(SER)。
9.细胞周期分析:细胞以1×105/ml的浓度加入到6孔板中, 每孔2 ml, 待细胞贴壁后更换含药培养基, 对照组加含0.1%生理盐水的培养基, 培养24 h后以0.25 Gy剂量的X射线照射, 24 h后收集细胞, 去上清, 用PBS洗涤, 75%冰乙醇固定, 4℃放置过夜; 200×g离心5 min, 完全去除乙醇, PBS洗涤1次, 加0.6 ml 50 μg/ml碘化丙啶(PI), 含浓度为200 μg/ml的RNase避光染色15 min, 在流式细胞仪上分析细胞周期分布; 用FlowJo软件分析细胞周期。
10. DNA断裂实验:细胞接种于盖玻片上置于6孔板中培养, 含GNPs和GAL-PEG-GNPs溶液培养基处理细胞后, 采用0.5 Gy剂量的6 MV X射线照射3组细胞, 照射完毕即更换常规培养液继续培养24 h; 次日用1 ml 2%的多聚甲醛固定细胞, PBS洗涤; 0.2%的Triton X-100溶液对细胞膜透化处理, 含1%BSA的PBS洗涤, 然后长有细胞的盖玻片与抗γ-H2AX抗体共培养1 h; 1% BSA的PBS洗涤3次, 与FITC标记的兔抗二抗室温下避光共培养1 h; 最后用含1% BSA的PBS缓冲液室温下洗涤细胞3次, 每次10 min, 用DAPI对细胞核染色, 激光共聚焦显微镜上检查焦点数。
11.蛋白印迹实验:Western blot蛋白印迹分析细胞凋亡相关蛋白Bax、Bcl-2、Caspase-3、Caspase-9、Cytochrome C的表达。细胞接种于15 mm×60 mm培养皿中, 先后予药物处理、接受0.25 Gy射线照射, 24 h后提取蛋白质, 转移蛋白至PVDF膜。PVDF膜在5%脱脂奶粉封闭液中4℃过夜。分别置于用封闭液1:200稀释一抗及β-肌动蛋白抗体溶液中, 置于4℃孵育过夜。一抗孵育后, 室温下用TBST洗膜3次, 每次10 min。将PVDF膜置于用TBST缓冲液1:5 000稀释的辣根过氧化物酶标记的羊抗小鼠二抗溶液中, 室温下摇床缓慢摇动脱色1 h。TBST缓冲液洗PVDF膜10 min, 重复3次。ECL法显色、感光、显影和定影。
12.酶标仪检测CAT、SOD、总GSH水平:采用ROS检测试剂盒, 先用酶标仪检测3种物质不同浓度的吸光度(A)值, 波长为420 nm, 并绘制标准曲线。将各组HepG2细胞用胰酶消化后, 于冷PBS中洗涤2遍, 各加入200 μl冰预冷裂解缓冲液, 混匀后冰浴30 min, 每隔5分钟涡旋震荡10 s, 充分裂解。4℃下13 000×g, 离心10 min。将上清分装, 保存于-70℃备检。测定不同处理组3种物质A值, 并换算出浓度值。
13.统计学处理:数据以x±s表示, 实验重复3次, 每次设≥3个平行样。用Graphpad prism软件分析多靶单击模型拟合细胞存活曲线, 组间比较行t检验。P < 0.05为差异有统计学意义。
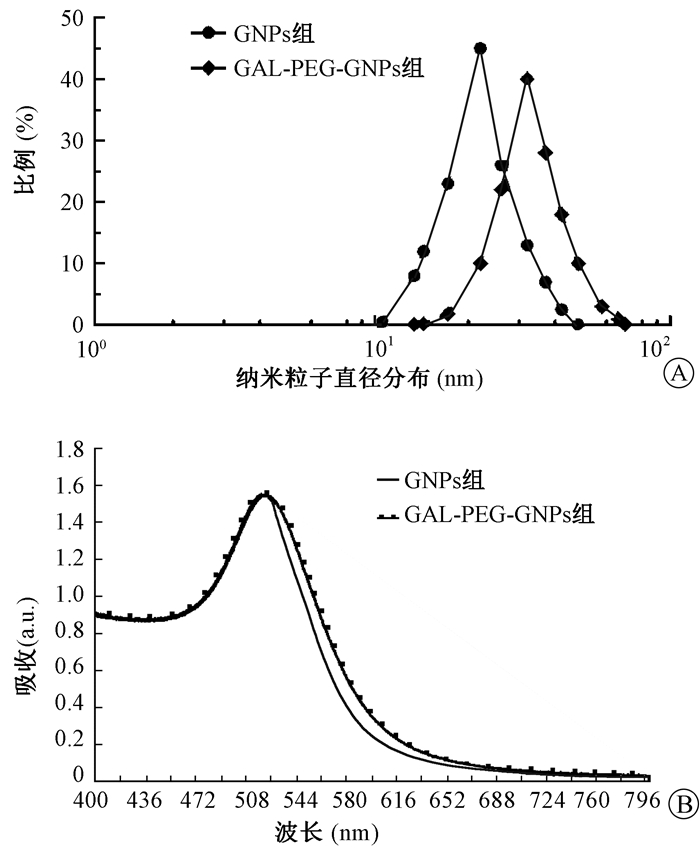
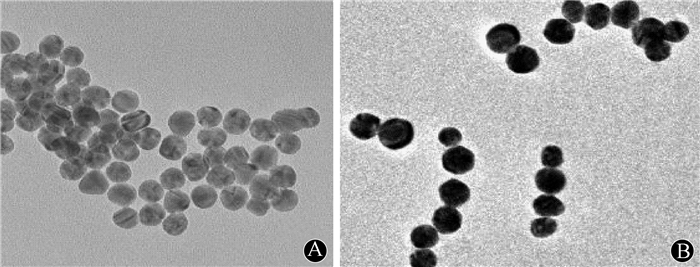
结果1. GAL-PEG-GNPs表征结果:结果示于图 1, 2。ICP-MS测得GAL-PEG-GNPs的平均浓度为(72.32±1.36)μg/ml。DLS检测GNPs颗粒和GAL-PEG-GNPs的水动力评价直径分别为(22.6±2.12)和(32±1.41) nm。GNPs和GAL-PEG-GNPs溶液的紫外可见吸收峰分别位于520和530 nm, 所测GAL-PEG-GNPs得到的紫外可见光吸收峰半高宽较宽, 纳米颗粒样品的粒径分布较窄, 均一性良好。合成的GNPs和GAL-PEG-GNPs粒径均为20 nm左右, GAL-PEG-GNPs外周一层光晕, 考虑与其修饰的PEG及GAL有关。
|
图 1 GNPs颗粒的表征分析A. GNPs和GAL-PEG-GNPs大小分布; B. GNPs和GAL-PEG-GNPs紫外吸收峰 Figure 1 Characterization of nanoparticles A. Size distributions of GNPs and GAL-PEG-GNPs; B. Absorption peaks of GNPs and GAL-PEG-GNPs |
|
图 2 纳米粒子的TEM照片×500 000 A.GNPs; B.GAL-PEG-GNPs Figure 2 Images of GNPs ×500 000 A. GAL-PEG-GNPs; B. detected by TEM |
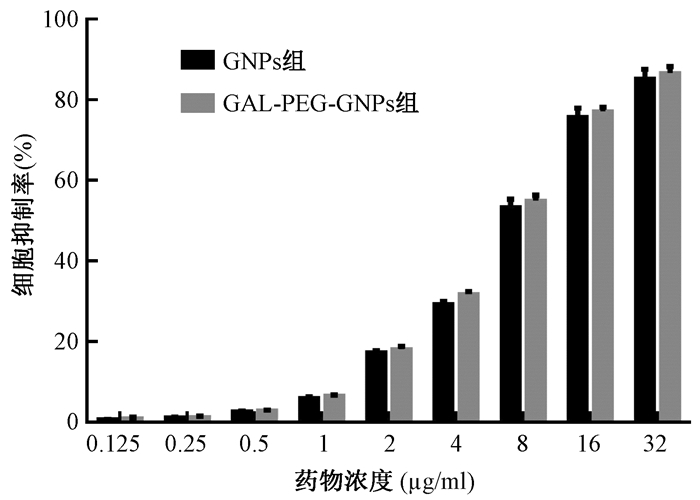
2. CCK-8细胞毒性检测:结果示于图 3。GAL-PEG-GNPs的细胞毒性与单纯GNPs类似, 相同浓度下两组药物对HepG2细胞的增殖抑制率均未见明显差异(P > 0.05), 计算IC50得出GAL-PEG-GNPs和GNPs对HepG2细胞的IC50值分别为为5.001和4.997 μg/ml。
|
图 3 GNPs和GAL-PEG-GNPs在不同浓度下对HepG2细胞的抑制 Figure 3 Cytotoxicity effect of GNPs and GAL-PEG-GNPs at different concentrations on HepG2 cells |
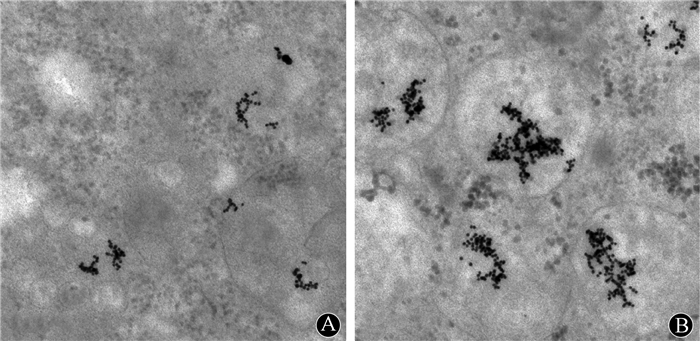
3. GAL-PEG-GNPs摄取实验:对照组检测不到Au元素存在, GNPs组中Au的量在24 h前随时间的延长而增加, 之后HepG2细胞吸收GNPs达到高峰值, 随后48~96 h Au逐渐减少。GAL-PEG-GNPs组摄取在8 h即达到峰值, 峰值水平远高于GNPs组, 约为GNPs组的3倍, 在到达峰值后开始出现缓慢下降, 72 h下降较为明显, 至96 h仍高于GNPs组。TEM检测结果见图 4, HepG2细胞对GAL-PEG-GNPs的摄取水平远高于单纯GNPs, 可以发现HepG2细胞内纳米材料主要分布在线粒体内。
|
图 4 TEM检测HepG2细胞对GNPs和GAL-PEG-GNPs摄取水平×50 000 A.GNPs组; B.GAL-PEG-GNPs组 Figure 4 TEM images of GNPs (A) and GAL-PEG-GNPs (B) uptaken in HepG2 cells ×50 000 |
4.细胞克隆形成实验:细胞克隆形成实验显示, 3组细胞接受放射治疗后细胞的生存能力呈下降趋势(图 5)。相同剂量下, GAL-PEG-GNPs组细胞克隆数目明显少于对照组和GNPs组。3组细胞间生存分数差异均具有统计学意义(F=1 314、458.2、205.7, P < 0.01)。根据生存曲线获得D0值, 计算GNPs和GAL-PEG-GNPs对HepG2细胞的SER分别为1.46和1.95。

|
图 5 克隆形成实验检测GNPs和GAL-PEG-GNPs对HepG2细胞的存活分数的影响 注:3组细胞间比较, F=1 314、458.2、205.7, P < 0.01 Figure 5 Clonogenic survivals of HepG2 cells treated with GNPs, GAL-PEG-GNPs or without chemical treatment |
5.细胞周期分析:流式细胞仪检测细胞周期分布列于表 1。HepG2细胞经过GNPs和GAL-PEG-GNPs处理后, 处于G2/M期的细胞比重由对照组的(8.09±2.2)%提高至GNPs组的(20.26±2.09)%和GAL-PEG-GNPs组的(27.03±0.7)% (t=14.20, P < 0.05)。
|
|
表 1 流式细胞仪检测HepG2细胞周期分布(%, x±s) Table 1 Cell cycle distribution of HepG2 cells detected by flow cytometry (%, x±s) |
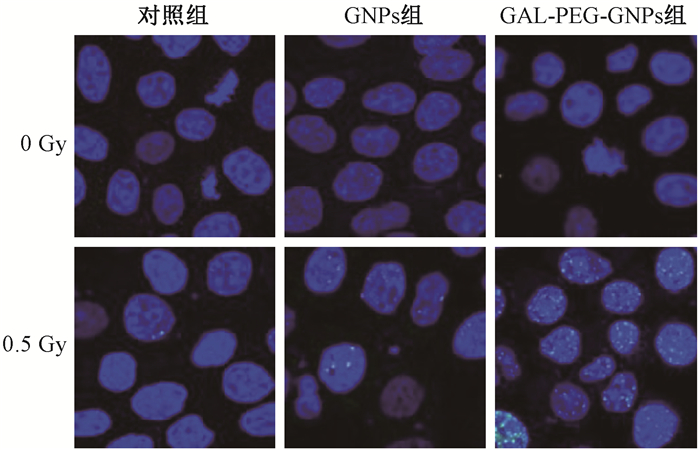
6. DNA断裂实验:未接受X射线细胞没有观察到γ-H2AX焦点的形成, 而接受0.5 Gy剂量照射的3组均出现γ-H2AX焦点的形成细胞(图 6), 其中对照组仅见少量γ-H2AX焦点, 而GNPs组和GAL-PEG-GNPs组的γ-H2AX焦点数量呈增加趋势, 以单个细胞焦点数统计, 对照组、GNPs组和GAL-PEG-GNPs组分别为2.5±0.58、11.25±0.96和21.5±1.29。与对照组相比, 差异具有统计学意义(t=9.73、15.65, P < 0.05)。GNPs组和GAL-PEG-GNPs组相比, 差异具有统计意义(t=12.75, P < 0.05)。
|
图 6 各组HepG2细胞的γ-H2AX焦点实验×400 Figure 6 Images of γ-H2AX foci in HepG2 cells under different treatments ×400 |
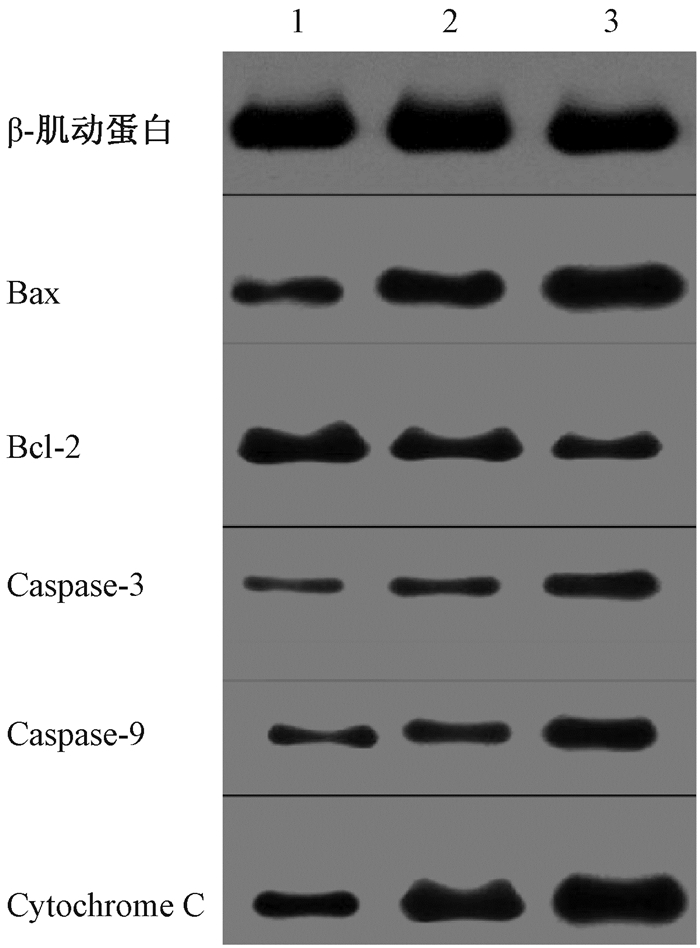
7.蛋白印迹实验:GNPs组的Cytochrome C的表达水平较对照组明显提高, 而GAL-PEG-GNPs组又显著高于GNPs组。在实验组中凋亡抑制蛋白Bcl-2的表达呈现降低趋势, 而凋亡促进蛋白Bax、Caspase-3、Caspase-9的表达呈现增加趋势(图 7)。
|
图 7 0.5 Gy X射线照射后HepG2细胞凋亡相关蛋白的表达 注:1.对照组; 2.GNPs组; 3.GAL-PEG-GNPs组 Figure 7 Expressions of apoptotic proteins and anti-apoptotic proteins in HepG2 cells irradiated by 0.5 Gy X-rays |
8. HepG2细胞CAT、SOD、总GSH表达变化:酶标仪检测3组HepG2细胞CAT、SOD、总GSH水平(表 2), 实验组CAT、SOD、总GSH均明显减少, GAL-PEG-GNPs组的CAT、SOD、GSH分别下降至对照组的51.56%、61.16%、54.90%(t=12.34、29.39、12.85, P < 0.05), 与GNPs相比, 差异也有统计学意义(t=5.14、15.89、7.38, P < 0.05)。
|
|
表 3 酶标仪检查HepG2细胞CAT/SOD/总GSH变化(x±s) Table 3 CAT/SOD/GSH in HepG2 cells detected by a microplate reader (x±s) |
讨论
纳米材料可以作为肿瘤靶向治疗系统中的重要载体[8]。通过纳米材料携带药物可以显著降低或者消除药物在常规治疗剂量下所产生的不良反应, 与特定基团的连接还可提高药物对肿瘤的靶向性, 减少药物在非靶向器官或组织的聚集, 从而减少药物对非靶向器官或组织的不良影响, 提高药物的治疗效果[9]。GNPs具有非常稳定的物理化学性质, 且非常方便在表面实现多种化学修饰, 是作为携带药物与基因的理想载体, 更重要的是GNPs可以提高X射线对生物体的吸收剂量。许多学者利用GNPs颗粒增强放射增敏的体内外实验研究均已证明, GNPs可以提高细胞的放射敏感性, 在多种肿瘤细胞中均具有增敏现象[4-5, 9-11]。GNPs可以减少对周围组织的不良反应, 对千伏级和兆伏级能量的射线均有增敏作用, 但目前机制尚不十分明确。前期体外实验发现, GNPs可以通过提高对DNA损伤的水平增加HepG2细胞对MeV级别X射线的敏感性[4]。为了提高GNPs在HepG2细胞内的分布浓度, 进一步增强GNPs的放射增敏效应, 减少放射过程中的不良反应, 本研究以ASGPR为靶点将GAL修饰到GNPs, 使其具有针对ASGPR的靶向性。
GNPs粒径大小与放射增敏效率有关。Bergen等[12]测试了粒径范围为50~150 nm的放射增敏比, 认为50 nm在22 keV条件下具有最佳的放射增敏比, 同时, 被细胞摄取量也最大。但也有研究认为, 18 nm的粒径更容易被细胞摄取[13]; 过小( < 10 nm)则容易被肾脏代谢掉。本研究中, 合成的GNPs和GAL-PEG-GNPs的平均粒径分别为(22.6±2.12)和(32±1.41) nm, 因此, 粒径大小适用于放射增敏且能避免被肾脏代谢。由于表面修饰PEG和GAL, 导致GAL-PEG-GNPs粒径增大。PEG的引入在体内实验中可以避免被内质网系统吞噬并且延长循环时间, 同时PEG修饰后GNPs具有更好的分散性, 并且能提高GNPs的亲水性。CCK-8实验显示, GNPs和GAL-PEG-GNPs具有类似的细胞毒性, 其IC50值分别为5.001和4.997 μg/ml, 与其他人合成的GNPs相比具有更低的细胞毒性。为了进一步降低GNPs的细胞毒性, 实验采用1/5 IC50浓度值(1.0 μg/ml)作为实验组药物浓度。
摄取实验发现, HepG2细胞对GAL-PEG-GNPs摄取水平远高于GNPs, 约为GNPs的3倍, 提示GAL作为HepG2细胞表达ASGPR的配体大大增加了GNPs进入细胞内的数量, 且延长了在细胞内的滞留时间。TEM实验也证实了HepG2细胞对GAL-PEG-GNPs的摄取水平远高于GNPs, 意味着GAL-PEG-GNPs比GNPs具有更好的放射增敏效应, 细胞克隆形成实验也证实GAL-PEG-GNPs的SER值达到了1.95, 远高于GNPs的1.46。
TEM实验还发现, HepG2细胞内纳米材料主要分布在线粒体内, 提示GNPs可能通过与线粒体的作用发挥增敏效应。有研究认为, ROS的激活或线粒体途径是GNPs放射增敏的机制之一[14]。本研究发现, 线粒体功能受损后导致氧化水平提高, 进而出现DNA损伤增加、HepG2增殖受到抑制, 该结果进一步被后续实验证实。GAL-PEG-GNPs细胞组克隆数目较少, 是由于细胞摄取更多Au的缘故。GAL-PEG-GNPs组细胞处于G2/M期的细胞比重则为(27.03±0.7)%, 远高于GNPs组和未经处理的细胞组, 可见GNPs驱使细胞由S期向G2/M期转变。G2/M期细胞对放射线最为敏感, 细胞聚集处于在此周期时可以明显提高其放射增敏性, 推测GNPs可以激活CDK激酶。
GAL-PEG-GNPs处理组细胞在接受X射线照射后出现Cytochrome C、Bax、Caspase-3和Caspase-9表达上调, 凋亡抑制蛋白Bcl-2的下调研究中还发现, GAL-PEG-GNPs组HepG2细胞内抗氧化酶CAT、SOD、总GSH表达水平较对照组明显减少, 抗氧化酶的减少表明细胞内自由基增加, 而细胞内活性氧ROS释放, 引起细胞线粒体膜电位的崩溃, 使线粒体通道发生氧化, 从而上调了Bax凋亡基因的表达, 而下调Bcl-2的表达。此时, Cytochrome C从线粒体中释放到细胞质中, 在Cytochrome C的调节作用下, 激活Caspase-9。Cytochrome C的释放和Caspase-9的激活进一步激活Caspase-3[15-16], 而Caspase-3通过引起细胞染色质固缩、DNA片段化等改变, 导致细胞最终发生凋亡[17]。但有关GNPs颗粒如何进入细胞线粒体内、如何影响到细胞内凋亡家族蛋白表达水平, 目前仍不明确, 其机制有待进一步研究。
本研究中, 合成了新型纳米材料GAL-PEG-GNPs, 在体外实验中证实了其较普通GNPs更好的靶向性及放射增敏作用, 初步解释了其对肝癌细胞HepG2的放射增敏机制。为了使GNPs靶向性更具有广泛性, 在进一步的实验中使用特异性内化寡核苷酸适配体(如抗表皮生长因子的寡核苷酸适配子)修饰PEG-GNPs, 使其更高效地与肿瘤细胞过表达同源受体与结合。通过和化疗药物的联合应用, GNPs在体内实验中可能会达到协同治疗的效果。GNPs可以穿越血脑屏障等生物障碍, 从而使其更有效地定位在目标位点, 因此, 本研究为体内实验奠定了相关实验基础。
利益冲突 本研究还得到南京市卫生局医学科技发展项目重点课题(ZKX13019)资助。本文作者与单位不存在与本工作职责相冲突的任何个人经济利益或非经济利益, 以及任何直接或间接的义务和责任可能影响或潜在影响稿件的内容作者贡献声明 朱传东负责实验设计、细胞培养、细胞摄取实验、克隆形成实验、文章撰写; 王礼学负责材料表征、蛋白印迹实验、DNA断裂实验; 王国相负责细胞毒性实验及酶标仪操作; 丁建勋负责材料合成; 徐瀚峰负责放射增敏实验; 童金龙负责放射操作; 郑勤负责实验设计
| [1] | Ursino S, Greco C, Cartei F, et al. Radiotherapy and hepatocellular carcinoma:update and review of the literature[J]. Eur Rev Med Pharmacol Sci, 2012, 16 (11) : 1599-1604 |
| [2] | Gil-Alzugaray B, Chopitea A, Iñarrairaegui M, et al. Prognostic factors and prevention of radioembolization-induced liver disease[J]. Hepatology, 2013, 57 (3) : 1078-1087 DOI:10.1002/hep.26191 |
| [3] | Lee IJ, Seong J. Radiosensitizers in hepatocellular carcinoma[J]. Semin Radiat Oncol, 2011, 21 (4) : 303-311 DOI:10.1016/j.semradonc.2011.05.008 |
| [4] | Zheng Q, Yang H, Wei J, et al. The role and mechanisms of nanoparticles to enhance radiosensitivity in hepatocellular cell[J]. Biomed Pharmacother, 2013, 67 (7) : 569-575 DOI:10.1016/j.biopha.2013.04.003 |
| [5] | Jain S, Coulter JA, Hounsell AR, et al. Cell-specific radiosensitization by gold nanoparticles at megavoltage radiation energies[J]. Int J Radiat Oncol Biol Phys, 2011, 79 (2) : 531-539 DOI:10.1016/j.ijrobp.2010.08.044 |
| [6] | Ma H, Liu J, Ali MM, et al. Nucleic acid aptamers in cancer research, diagnosis and therapy[J]. Chem Soc Rev, 2015, 44 (5) : 1240-1256 DOI:10.1039/c4cs00357h |
| [7] | Yik JH, Saxena A, Weigel JA, et al. Palmitoylation-defective asialoglycoprotein receptors are normal in their cellular distribution and ability to bind ligand, but are defective in ligand uptake and degradation[J]. Biochem Biophys Res Commun, 2002, 297 (4) : 980-986 DOI:10.1016/S0006-291X(02)02298-2 |
| [8] | Peer D, Karp JM, Hong S, et al. Nanocarriers as an emerging platform for cancer therapy[J]. Nat Nanotechnol, 2007, 2 (12) : 751-760 DOI:10.1038/nnano.2007.387 |
| [9] | Jain S, Hirst DG, O'Sullivan JM. Gold nanoparticles as novel agents for cancer therapy[J]. Br J Radiol, 2012, 85 (1010) : 101-113 DOI:10.1259/bjr/59448833 |
| [10] | Rahman WN, Bishara N, Ackerly T, et al. Enhancement of radiation effects by gold nanoparticles for superficial radiation therapy[J]. Nanomedicine, 2009, 5 (2) : 136-142 |
| [11] | Chen YT, Lo TN, Chu YS, et al. Full-field hard x-ray microscopy below 30 nm:a challenging nanofabrication achievement[J]. Nanotechnology, 2008, 19 (39) : 395302 DOI:10.1088/0957-4484/19/39/395302 |
| [12] | Bergen JM, von RHA, Goodman TT, et al. Gold nanoparticles as a versatile platform for optimizing physicochemical parameters for targeted drug delivery[J]. Macromol Biosci, 2006, 6 (7) : 506-516 DOI:10.1002/mabi.200600075 |
| [13] | Mesbahi A, Jamali F, Garehaghaji N. Effect of photon beam energy, gold nanoparticle size and concentration on the dose enhancement in radiation therapy[J]. Bioimpacts, 2013, 3 (1) : 29-35 DOI:10.5681/bi.2013.002 |
| [14] | Geng F, Song K, Xing JZ, et al. Thio-glucose bound gold nanoparticles enhance radio-cytotoxic targeting of ovarian cancer[J]. Nanotechnology, 2011, 22 (28) : 285101 DOI:10.1088/0957-4484/22/28/285101 |
| [15] | Leung MK, Chow JC, Chithrani BD, et al. Irradiation of gold nanoparticles by x-rays:Monte Carlo simulation of dose enhancements and the spatial properties of the secondary electrons production[J]. Med Phys, 2011, 38 (2) : 624-631 DOI:10.1118/1.3539623 |
| [16] | Mesbahi A, Jamali F, Garehaghaji N. Effect of photon beam energy, gold nanoparticle size and concentration on the dose enhancement in radiation therapy[J]. Bioimpacts, 2013, 3 (1) : 29-35 DOI:10.5681/bi.2013.002 |
| [17] | Khlebtsov N, Dykman L. Biodistribution and toxicity of engineered gold nanoparticles:a review of in vitro and in vivo studies[J]. Chem Soc Rev, 2011, 40 (3) : 1647-1671 DOI:10.1039/c0cs00018c |
 2016, Vol. 36
2016, Vol. 36


