磁共振弥散加权成像(diffusion-weighted mag-netic resonance imaging,MR-DWI)技术在肿瘤放疗领域的应用已有很多报道,包括靶区的勾画及图像融合,区域淋巴结的确定,肿瘤局部浸润程度及临床分期等。但在预测治疗反应及预后评估方面仍处于起步阶段,尤其是在食管癌精确放疗中的应用报道还较少。本研究探讨MRI在食管癌放化疗中对治疗反应及预后评估的价值,为临床提供参考和帮助。
资料与方法1.入组条件:病理证实的食管鳞癌患者,卡氏评分≥70,疗前临床相关检查除外远处转移及放化疗禁忌,患者及家属同意行磁共振检查(均已签署知情同意书)且无检查禁忌证者。
2.临床资料:2010年3月至2013年9月河北医科大学第四医院收治的食管癌患者100例。男性67例,女性33例;中位年龄65岁(45~84岁)。放疗前食管钡餐造影显示肿瘤长度1.0~12.0 cm,中位长度5.0 cm。全组颈段癌4例、胸上段癌28例、胸中段癌50例、胸下段癌13例,重复癌5例。依据2009中国“非手术治疗食管癌临床分期草案”[1]及韩春等[2]、王澜等[3]的研究,全组T1期4例,T2期18例,T3期27例,T4期51例,N0期12例,N1期77例,N2期11例,TNMⅠ期4例,Ⅱ期42例,Ⅲ期54例。
3.靶区勾画标准及放疗方法:肿瘤靶区(GTV)为食管原发灶,CT图像确定食管病变的标准为食管壁厚度超过5 mm或不含气食管直径超过10 mm、食管壁局限性或全周性增厚,临床靶区(CTV)为GTV前后左右均匀外扩0.5 cm,上下外扩2.0 cm,PTV为CTV前后左右均匀外扩0.5 cm,上下外扩1.0 cm。区域淋巴结GTV-n的勾画标准为短径≥1.0 cm,特殊部位如食管旁、气管食管沟、心隔角淋巴结诊断标准为短径≥0.5 cm[4-5],PTV-n为GTV-n均匀外扩1.0 cm。所有患者治疗前及治疗后均行MRI检查,GTV及GTV-n的确定标准为弥散序列有高信号表达,并将CT与MRI图像进行融合后共同确定GTV及GTV-n。
4.治疗计划设计及靶区受照剂量:全组处方剂量50~63 Gy,中位60 Gy,处方剂量60 Gy以下者19例,余患者照射剂量均≥60 Gy,单次剂量1.8~2.0 Gy,1次/d,5次/周。要求PTV 95%体积接受100%以上的处方剂量照射,全肺V5≤55%~60%,V20≤25%~30%,V30≤18%,心脏平均剂量≤3 000 cGy,脊髓最大剂量<4 500 cGy,治疗计划经验证后开始实施治疗。全组患者均行适形或调强放疗。
5.化疗:全组患者均接受1~2周期的同期化疗,方案为FP(顺铂12.5 mg/m2×5 d或25 mg/m2×3 d,5-FU 450~500 mg/m2×5 d)或TP(紫杉醇135 mg/m2,第1天;顺铂25 mg/m2,第2、3、4天),28 d为1周期,第1、5周给予。
6.磁共振扫描及弥散表观系数(ADC值)计算:弥散敏感梯度取b=0、600 s/mm2。患者在放疗前及放疗末行DWI检查,将b=0及b=600 s/mm2的DWI图像融合得到对应的ADC图,参考常规MRI图像确定肿瘤位置,在ADC图上测量食管病变及正常食管的ADC值。选择肿瘤显示最大最清楚的层面作为感兴趣区(region of interest,ROI)。放疗后ADC值参考放疗前区域的选择进行测量。每个ROI测量3次,取其平均值作为最后的ADC值。ΔADC是指放疗前后ADC的差值百分比,计算公式ΔADC=(ADC放疗后-ADC放疗前)/ADC放疗前×100%。
7.疗效评价及预后评估:近期疗效评价采用食管癌放射治疗后近期疗效评价标准[6-7],观察全组患者近期疗效及长期生存,将其与ADC值相结合进行分析。
8.统计学处理:采用SPSS 13.0统计软件进行统计,Kaplan-Meier法推算生存率,Log-rank法进行显著性检验。用Cox回归模型进行单因素及多因素预后分析。P<0.05为差异有统计学意义。
结果1.随访:从放疗开始之日起至2016年2月1日,全部病例观察时间满2年以上,满3年者86例,满5年者36例,5例患者失访,随访率95.0%,随访方式包括电话、信件、到院复查等。
2.治疗前后的ADC值测量结果:在ADC图上测量食管病变放疗前后ADC值,结果分别为(1.61±0.35)×10-3 mm2/s和(2.48±0.42)×10-3 mm2/s,放疗后ADC值明显高于放疗前ADC值,差异有统计学意义(t=-22.645,P<0.05)。
3.钡餐造影评价近期疗效与预后:全组1、3、5年生存率为65.0%、34.9%、24.0%,根据放疗结束及结束后1~3个月食管钡餐造影片进行疗效评价,完全缓解(CR)65例,部分缓解(PR)35例,肿瘤治疗后总有效率100%。CR组患者放疗前ADC值和放疗后ADC值均高于PR组,两组比较差异有统计学意义(Z=3.010、3.689,P<0.05),见表 1。CR组1、3、5年生存率为69.2%、45.8%、38.0%,PR组1、3年生存率为57.1%、13.8%,生存均未超过5年。经Log-rank检验,两组总的生存情况比较差异有统计学意义(χ2=7.398,P<0.05)。
|
|
表 1 两组放疗前后ADC值的变化(x±s) Table 1 Comparison of ADC values between CR group and PR group(x±s) |
4.放疗前、放疗后ADC值与近期疗效及预后: 全组患者治疗前肿瘤区域ADC值为(1.61±0.35)×10-3 mm2/s,参考其中位值,以1.60×10-3 mm2/s为分组界值,将患者分为放疗前低ADC值组(≤1.60×10-3 mm2/s)和放疗前高ADC值组(>1.60×10-3 mm2/s),两组分别为55和45例,其疗后的CR率分别为56.4%(31/55)和75.6%(34/45),经卡方检验,两组的CR率差异有统计学意义 (χ2=4.007,P<0.05)。进一步生存分析发现放疗前低ADC值组和放疗前高ADC值组1、3、5年生存率分别为为58.2%、21.9%、10.9%和73.3%、50.6%、39.2%,差异有统计学意义(χ2=9.879,P<0.05),见表 2。
|
|
表 2 患者放疗前后ADC值对1、3、5年生存率的影响(%) Table 2 The relation about ADC value of pre,post-CRT and 1,3,5-year survival rate(%) |
全组患者放疗后均复查MR-DWI检查,参考放疗前区域在ADC图上测量ADC值,结果为(2.48±0.42)×10-3 mm2/s,将患者分为放疗后低ADC值组(≤2.50×10-3 mm2/s)和放疗后高ADC值组(>2.50×10-3 mm2/s),两组分别为46例和54例,其疗后的CR率分别为41.3%(19/46)和85.2%(46/54),差异有统计学意义(χ2=21.024,P<0.05)。利用受试者工作特征(ROC)曲线找到能够使病变达到CR的截点,得到曲线下面积为0.724,范围0.645~0.862,其预测度为中等,截点值恰为2.50×10-3 mm2/s,灵敏度77.1%,特异度70.8%(图 1)。对治疗后低ADC值组与高ADC值组的生存情况进行Logrank检验,结果两组的1、3、5年生存率分别为52.2%、23.6%、14.2%和75.9%、44.1%、32.4%,差异有统计学意义(χ2=5.455,P<0.05),见表 2。
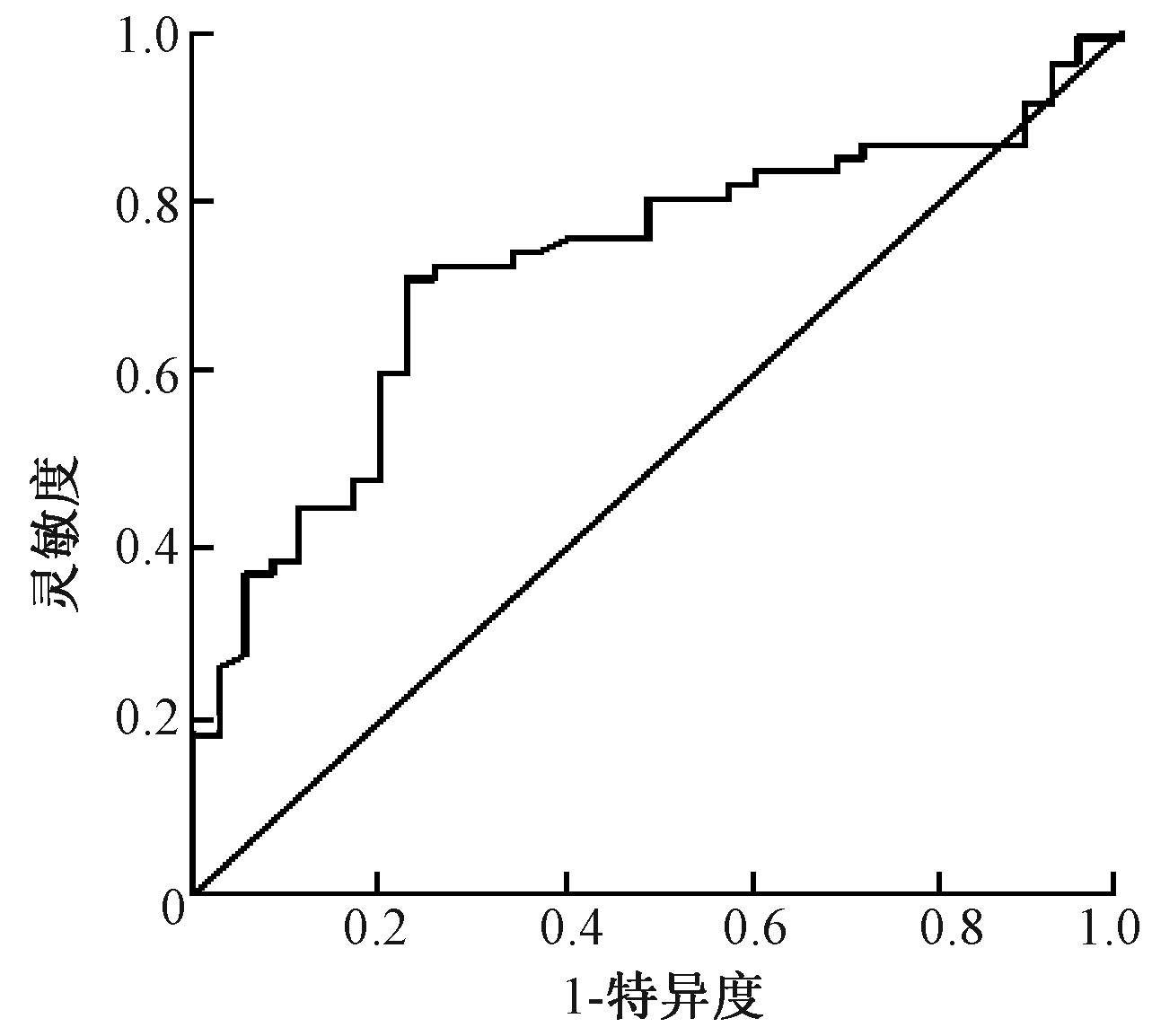
|
图 1 完全缓解组与部分缓解组放疗后ADC值ROC曲线 注:ADC值.弥散表观系数;ROC曲线.受试者工作特征曲线 Figure 1 ROC curve of ADC values after CRT for CR group and PR group |
5.ΔADC与近期疗效及预后: 全组患者ΔADC\[(ADC放疗后-ADC放疗前)/ADC放疗前×100%\]为(58.6±31.3)%,参考其中位值,以57.4%为分组界值,将患者分为低ΔADC组(≤57.4%)和高ΔADC组(>57.4%),两组分别为51例和49例,其治疗后的CR率分别为60.8%(31/51)和69.4%(34/49),差异无统计学意义(P>0.05)。经Log-rank检验进一步生存分析发现,低ΔADC组和高ΔADC组疗后1、3、5年生存率分别为69.4%、29.5%、17.7%和60.8%、40.0%、32.0%,差异无统计学意义(P>0.05)。
将放疗前低ADC值组再分为低ΔADC组(≤74.0%)和高ΔADC组(>74.0%),两组分别为27和28例。将放疗前高ADC值组也分为低ΔADC组(≤36.6%)和高ΔADC组(>36.6%),两组分别为22和23例。分别定义为1、2、3、4组,经Log-rank检验进一步生存分析发现,4组患者的1、3、5年生存率分别为51.9%、19.0%、0%,64.3%、24.5%、9.8%,54.5%、36.4%、36.4%,91.3%、64.2%、42.1%,差异有统计学意义(χ2=13.096,P<0.05,图 2)。
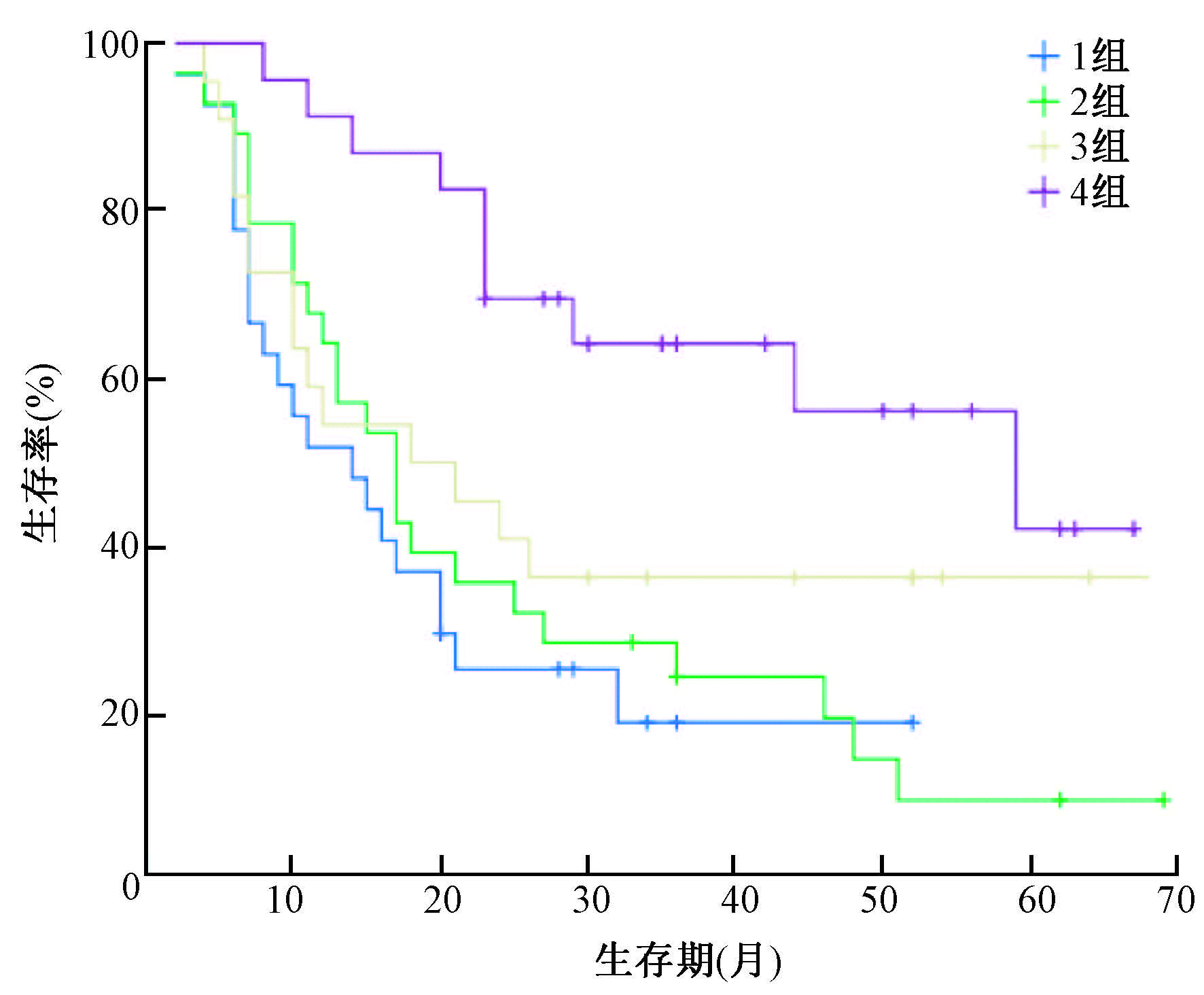
|
图 2 放疗前低ADC值组与放疗前高ADC值组不同ΔADC分组生存曲线 注:1组.放疗前高ADC值、高ΔADC组;2组.放疗前高ADC值、低ΔADC组;3组.放疗前低ADC值、高ΔADC组;4组.放疗前低ADC值和ΔADC组 Figure 2 Survival curves of different ΔADC groups for the low- and high-ADC value groups before CRT |
6.临床、DWI因素的单因素、多因素预后分析:将患者的性别、年龄分组、肿瘤部位、钡餐造影病变长度分组、非手术T分期、N分期、GTV体积、近期疗效、放疗前ADC值分组、放疗后ADC值分组、ΔADC分组共11项因素分别代入Cox回归模型进行单因素预后分析,检验出有意义的因素包括年龄、病变长度、非手术T分期、N分期、GTV体积、近期疗效、放疗前ADC分组、放疗后ADC分组8项因素。将上述有意义的8项因素代入Cox回归模型进行多因素预后分析,结果经筛选最终保留在模型中的协变量包括年龄分组、非手术N分期和放疗前ADC分组3项因素,与生存有相关性(P=0.007、0.003和0.044),见表 3。
|
|
表 3 全组患者Cox回归模型多因素分析 Table 3 Multivariate analysis of prognostic factors for patients |
讨论
磁共振弥散加权成像是一种新的功能成像技术,它反映了组织内水分子的弥散运动状态,从成像原理的角度考虑,通过测量ADC值大小即可能探测组织细胞水平微观变化,可以间接反映组织细胞的增殖和灌注代谢信息,同时由于ADC值可以在ADC图上直接测得,能够较为直观、量化地提供肿瘤相关信息,因此,这一指标有可能对肿瘤的预后及疗效评价提供重要参考价值。
据文献报道,接受新辅助治疗的食管胃结合部癌治疗有效组患者治疗前ADC值低于无效组,放疗后ADC值高于无效组[8]。与本研究结果不完全一致,考虑原因可能与两组患者的病理类型不同有关,本研究入组的患者均为鳞癌。Aoyagi等[9]对80例食管鳞癌进行研究,患者接受FP方案化疗+40 Gy的放疗,结果治疗前的ADC分组是影响肿瘤治疗反应的独立影响因素,高ADC组预后要明显优于低ADC组。意大利的一项对23例食管胃结合部癌的研究显示[10],治疗前ADC值较低者预后较差。这些结果与本研究结果一致,本研究中放疗前高ADC值组的近期疗效和预后均优于放疗前低ADC值组。为进一步明确疗前ADC值大小与预后的关系,本研究进行了Cox回归模型单因素分析,结果同样提示放疗前ADC分组为预后相关因素。在临床因素与DWI参数的Cox回归模型多因素分析结果中,研究筛选出的独立预后影响因素包括年龄分组、非手术N分期和放疗前ADC分组3项因素,提示与其他因素比较,放疗前ADC值与预后的关系可能更为紧密,认为放疗前ADC值可能为预测食管鳞癌治疗反应和预后的有意义指标。
另有文献报道,治疗过程中ADC值的变化情况也和治疗效果密切相关。van Rossum等[11]对20例食管癌进行研究,患者接受TC方案化疗+41.4 Gy的放疗,经过3~9周后行手术治疗,统计分析的结果显示病理达到CR的ΔADC高于未达pCR者,治疗反应佳者ΔADC高于治疗反应差者,此项研究肯定了ΔADC在评价肿瘤治疗反应方面的价值,认为新辅助放化疗后2~3周内的ADC值变化能够预测病理反应。本研究中全组患者放疗末ADC值均较放疗前升高,从CR率和1、3、5年生存率看似乎高ΔADC组更优,但并未达到统计学差异。进一步将放疗前低ADC值组和放疗前高ADC值组按ΔADC分为4组,结果显示放疗前高ADC值组ADC值上升较好的患者生存情况最优,而放疗前低ADC值组ADC值上升不佳的患者预后最差,其他两组生存情况有交叉,这一结果提示ΔADC在一定程度上影响了预后。在放疗前低ADC值组,经过放化疗干预后ADC值上升较好者预后优于ADC值变化不明显者,相反,放疗前ADC值较高者在治疗后ADC值变化不明显,其预后也不好。
与此同时,放疗后ADC值大小与治疗反应和预后在本组研究中也体现出了极强的关联性。放疗后高ADC值组生存情况明显优于疗后低ADC组患者,两组的1、3、5年生存率提示放疗后食管病变ADC值越高其疗效达CR的可能性越大,生存越好。
本研究结果提示,食管癌患者疗前ADC值高低即可预测治疗反应,治疗期间的ADC值变化也可指导预后,而治疗后的ADC值高低和疗效关系密切,可以很好指导预后,因此,我们认为通过治疗前后对食管癌患者ADC值的测量,可以对治疗反应和预后做出正确评估,值得临床深入研究。
利益冲突 全体作者无学术纷争,所写内容均中立客观,不存在任何利益冲突作者贡献声明 张安度负责数据统计分析及论文撰写;韩晶、王燕飞负责数据收集;王澜、张钧、田华、孔洁、张舰负责病例收集;时高峰和韩春负责整体实验设计、论文撰写指导及修改
| [1] | 中国非手术治疗食管癌临床分期专家小组. 非手术治疗食管癌的临床分期标准(草案)[J]. 中华放射肿瘤学杂志 , 2010, 19 (3) : 179-180 Panel of Experts for Non-surgical Staging of Esophageal Cancer in China. The draft of non-surgical staging for esophageal cancer (Draft)[J]. Chin J Radiat Oncol , 2010, 19 (3) : 179-180 |
| [2] | 韩春, 王澜, 祝淑钗, 等. 非手术治疗食管癌临床分期标准对225例放疗患者的预后评价[J]. 中华放射肿瘤学杂志 , 2011, 20 (2) : 109-112 Han C, Wang L, Zhu SC, et al. Evaluation of progonosis of clinical staging for esophageal caicinoma treated with non-surgical methods-addition with analysis of 225 patients[J]. Chin J Radiat Oncol , 2011, 20 (2) : 109-112 DOI:10.3760/cma.j.issn.1004-4221.2011.02.008 |
| [3] | 王澜, 孔洁, 韩春, 等. 非手术治疗食管癌临床分期标准的临床应用与探讨[J]. 中华放射肿瘤学杂志 , 2012, 21 (4) : 330-333 Wang L, Kong J, Han C, et al. The evaluation of prognosis and investigation of clinical staging for esophageal carcinoma treated with non-surgical methods[J]. Chin J Radiat Oncol , 2012, 21 (4) : 330-333 DOI:10.3760/cma.j.issn.1004-4221.2012.04.012 |
| [4] | 顾雅佳, 王玖华, 相加庆, 等. CT观察胸段食管癌气管食管沟淋巴结转移的临床意义探讨[J]. 中华放射学杂志 , 2002, 36 (2) : 139-141 Gu YJ, Wan JH, Xiang JQ, et al. A study on clinical value of CT features of tracheoesophageal groove lymph node metastasis of thoracic esophageal carcinoma[J]. Chin J Radiol , 2002, 36 (2) : 139-141 DOI:10.3760/cma.j.issn.1005-1201.2002.02.014 |
| [5] | Mizowaki T, Nishimura Y, Shimada Y, et al. Optimal size criteria of malignant lymph nodes in the treatment planning of radiotherapy for esophageal cancer:evaluation by computed tomography and magnetic resonance imaging[J]. Int J Radiat Oncol Biol Phys , 1996, 36 (5) : 1091-1098 DOI:10.1148/radiology.179.1.2006268 |
| [6] | 万钧, 肖爱勤, 高淑珍, 等. 食管癌放疗后近期疗效评价标准附1 000例分析[J]. 中国放射肿瘤学 , 1989, 3 (4) : 3-5 Wan J, Xiao AQ, Gao SZ, et al. Evaluation criteria of short-term effect of Radiotherapy for esophageal cancer[J]. Chin J Radiat , 1989, 3 (4) : 3-5 |
| [7] | 肖泽芬. 食管癌//殷蔚伯, 谷铣之[M]. 3版.北京: 中国协和医科大学出版社, 2002 : 598 -620. Xiao ZF. Esophageal cancer//Yin WB, Gu XZ[M]. 3th. Beijing: Pecking Union Medical College Press, 2002 : 598 -620. |
| [8] | De Cobelli F, Giganti F, Orsenigo E, et al. Apparent diffusion coefficient modifications in assessing gastro-oesophageal cancer response to neoadjuvant treatment:comparison with tumour regression grade at histology[J]. Eur Radiol , 2013, 23 (8) : 2165-2174 DOI:10.1007/s00330-013-2807-0 |
| [9] | Aoyagi T, Shuto K, Okazumi S, et al. Apparent diffusion coefficient values measured by diffusion-weighted imaging predict chemoradiotherapeutic effect for advanced esophageal cancer[J]. Dig Surg , 2011, 28 (4) : 252-257 DOI:10.1159/000328770 |
| [10] | Giganti F, Salerno A, Ambrosi A, et al. Prognostic utility of diffusion-weighted MRI in oesophageal cancer:is apparent diffusion coefficient a potential marker of tumour aggressiveness?[J]. Radiol Med , 2016, 121 (3) : 173-180 DOI:10.1007/s11547-015-0585-2 |
| [11] | van Rossum PS, van Lier AL, van Vulpen M, et al. Diffusion-weighted magnetic resonance imaging for the prediction of pathologic response to neoadjuvant chemoradiotherapy in esophageal cancer[J]. Radiother Oncol , 2015, 115 (2) : 163-170 DOI:10.1016/j.radonc.2015.04.027 |
 2016, Vol. 36
2016, Vol. 36


