食管癌是消化系统常见恶性肿瘤,以放疗为主的综合治疗是较晚或其他医学原因丧失手术机会食管癌患者的重要治疗手段。近年来各种治疗技术都有长足发展,食管癌的疗效仍然较差,大多数文献报道有60%[KG-*4]~70%的患者治疗失败,治疗失败主要表现为肿瘤局部复发和远处转移,5年生存率仅维持在20%[KG-*4]~40%[1-3]。食管癌放化疗失败的原因之一可能是血管内皮生长因子(vascular endothelial growth factor,VEGF)表达增加,肿瘤细胞为减少放疗的血管毒性作用、增强生存能力的自我保护手段,导致了肿瘤的放射抗拒。VEGF的表达是影响食管癌预后的独立因素[4-5]。陆文斌等[6]研究发现,食管癌放疗中VEGF的变化与患者预后密切相关,放疗中、放疗后血清VEGF较放疗前降低者预后较好,反之预后较差。对食管癌放疗中血清VEGF水平不降低的患者进行治疗干预促使其VEGF水平下降有可能提高患者长期生存率。有研究显示[7],食管癌放疗过程中加用沙利度胺可降低患者VEGF表达水平,服用沙利度胺耐受性较好。本研究将食管癌放疗中血清VEGF不降低的患者进行随机分组,比较研究同期放化疗联合沙利度胺和单纯同期放化疗在食管癌治疗中疗效、预后以及不良反应,为食管癌患者临床个体化治疗提供依据。
资料与方法1.临床资料:2011年2月至2014年12月间南京医科大学附属常州市第二人民医院放疗科收治的经病理证实的食管鳞癌患者102例。入组标准:KPS≥80;年龄≤75岁;拒绝手术或其他原因不能手术患者;病灶≤10 cm,无食管穿孔X射线征象;无心肝肾功能严重障碍,血常规基本正常;无严重恶液质及严重心脑血管疾病。放疗过程中血清VEGF水平与放疗前比较,稳定或升高的患者按随机抛硬币法分为两组,沙利度胺组和对照组(沙利度胺组放化疗过程中给予沙利度胺治疗,对照组行常规放化疗);另将血清VEGF下降患者设为阴性对照,即VEGF降低组(VEGF降低组行常规放化疗)。患者按2010年非手术治疗食管癌分期标准分期。3组患者临床基线资料见表 1。
|
|
表 1 3组病例临床资料比较(例) Table 1 Comparison of clinical information among the three groups(case) |
2.治疗方案
(1)放疗:102例患者采用德国西门子公司6 MV X射线三维适形放疗或调强放疗,CT-SIM设计放疗计划。其中大体肿瘤区(GTV)包括原发灶区和淋巴转移灶;临床靶区(CTV)包括原发灶前后、左右外放0.5 cm、上下外放3~5 cm和可能受累淋巴结区;计划靶区(PTV)在CTV的基础上前后、左右、上下外放0.5 cm;计划大体肿瘤区(PGTV)包括原发灶GTV前后、左右外放0.5~1 cm、上下外方3 cm以及淋巴结GTV外放0.5~1 cm。PGTV处方剂量为60~66 Gy,2 Gy/次,1次/d,每周5 d。PTV处方剂量为50 Gy,2 Gy/次,1次/d,每周5 d,常规分割。脊髓最大剂量<45 Gy;肺平均剂量<13 Gy,肺V20<28%,心脏V50<45%。
(2)化疗:采用脂质体紫杉醇和铂类的二联化疗方案,21 d为1个周期,同期化疗2个周期,巩固化疗2个周期。
(3)沙利度胺治疗:沙利度胺组给予沙利度胺治疗,初始剂量200 mg/d,1周后无中度以上不良反应增加剂量至300 mg/d,服用至放疗结束,均为晚上睡前服用;对照组和VEGF降低组行常规放化疗。
3.血清VEGF检测:分别于放疗前1周内、放疗第2、3周及放疗结束后1周内抽取患者外周静脉血2 ml,混匀,4℃、离心半径10 cm,3 000 r/min离心10 min。分离出的血清置于-70℃冰箱。采用双抗体夹心生物素-亲和素-酶联免疫吸附实验(ABC-ELISA)进行检测,按说明书操作。VEGF试剂盒为上海维克特生物技术有限公司产品。检测标准差(SD)为8.1 ng/L,2倍标准差(2SD)为16.2 ng/L,放疗中血清VEGF水平较放疗前升高、下降超过2SD视为血清VEGF水平增高、降低,血清VEGF水平变化不超过2SD视为VEGF水平稳定。
4.疗效及不良反应评价:根据美国放射肿瘤协作组放射性损伤评价标准评估放疗不良反应,根据世界卫生组织化疗不良反应分级标准评价药物不良反应。放疗结束后1周内复查食管钡餐透视和胸部CT评估近期疗效,采用食管钡餐造影评估食管原发灶疗效,采用实体瘤的疗效评价标准(RECIST1.1)评估淋巴结转移灶疗效。
5. 随访:治疗结束后2年内每3月随访1次,2年后每6月随访1次;随访内容包括病史、体格检查、实验室检查、心电图、腹部B超、食管钡餐透视、胸部CT等;以总生存期(OS)、无疾病进展生存期(PFS)、局控率(LC)为评价指标。随访截至2015年12月31日,随访时间12~60个月,1例失访,随访率99%。
6.统计学处理:采用SPSS 19.0软件进行统计分析,计量资料的比较采用方差分析,计数资料的比较采用Fisher精确概率法,两组等级资料比较用非参数统计,生存分析采用Kaplan-Meier法和Log rank检验,多因素分析采用Cox比例风险模型。检验水准α=0.05。
结 果1.疗效:全组患者中,1例患者放疗中发现肝转移终止放疗,2例因放射性肺炎终止放疗,1例放疗中因胆结石转外科治疗,1例因高热拒绝进一步治疗,1例拒绝完成4周期化疗,1例失访。随访期间死亡64例。可分析病例95例,其中沙利度胺组24例,对照组24例,VEGF降低组47例。完全缓解(CR)率64.2%(61/95),部分缓解(PR)率31.6%(30/95),总有效率为95.8%(91/95)。对照组、沙利度胺组、VEGF降低组完全缓解率和部分缓解率分别为50.0%、75.0%、66.0%和45.8%、20.8%、29.8%,3组近期疗效比较,差异无统计学意义(P>0.05)。
2.不良反应:患者 1、2、3级放射性食管损伤的发生率分别为29.4%、62.7%、7.8%。1、2、3级放射性肺炎的发生率分别为45.1%、48.0%、6.9%。1、2、3、4级血液学毒性反应的发生率分别为47.1%、37.3%、9.8%和5.9%。沙利度胺不良反应主要表现为嗜睡,轻、中、重度嗜睡发生率分别为15.4%、11.5%、11.5%,未发现深静脉血栓、低血压、心律缓慢等心血管系统不良反应。
3.长期生存分析:对95例可分析患者进行分析,1、3年生存率分别为68.4%、22.3%;1、3年无进展生存率分别为56.8%、19.5%;1、3年局部控制率分别为83.6%、51.6%;2年内复发15例,中位复发时间6.8个月,中位OS和中位PFS分别为18.2和15.8个月。
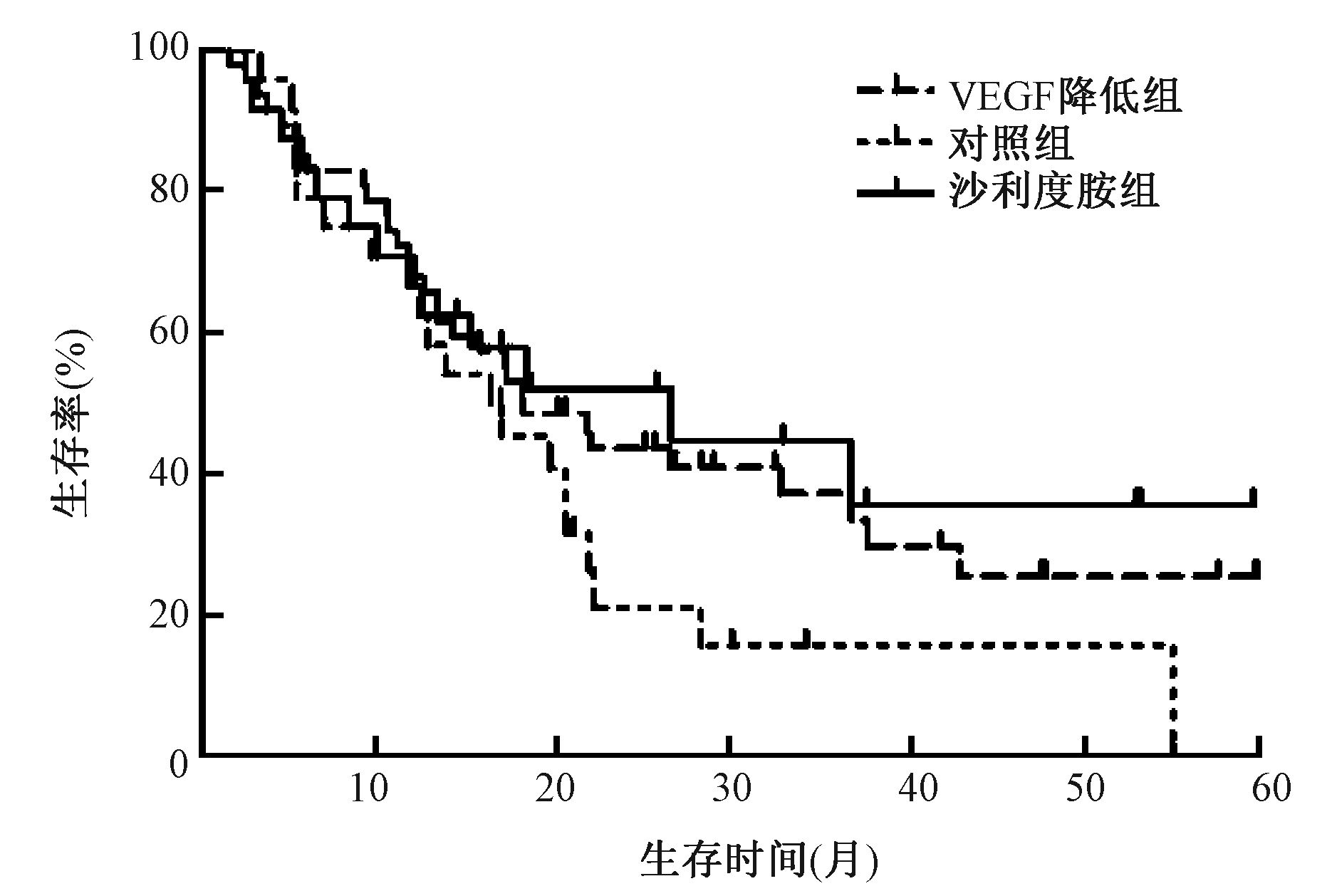
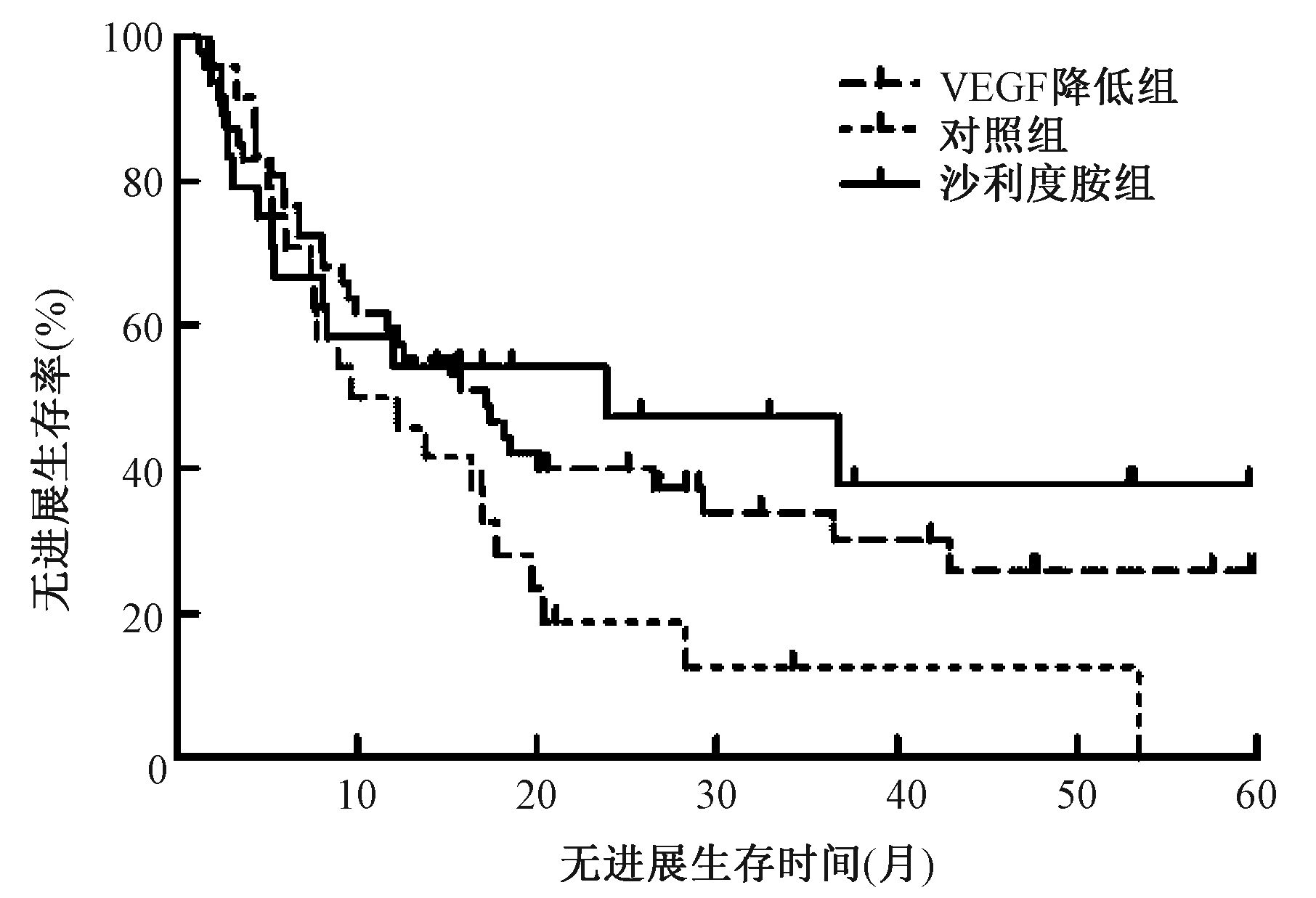
对照组1、3年生存率分别为66.7%、5.0%、1、3年无进展生存率分别为50.0%、4.8%、1、3年局部控制率分别为70.0%、22.2%;沙利度胺组1、3年生存率分别为70.8%、29.4%,1、3年无进展生存率分别为58.3%、29.4%,1、3年局部控制率分别为89.5%、71.4%;VEGF降低组1、3年生存率分别为68.1%、26.3%,1、3年无进展生存率分别为59.6%、23.1%,1、3年局部控制率分别为88.2%、60.0%;3组比较,差异均无统计学意义(P均>0.05),各组患者生存曲线和无进展生存曲线分别见图 1和图 2。
|
图 1 各组患者的生存曲线 Figure 1 OS curves of patients in three groups |
|
图 2 各组患者无进展生存曲线 Figure 2 PFS trend of patients in three groups |
4.局部晚期(Ⅱ、Ⅲ期)患者长期生存分析:对局部分期较晚的Ⅱ、Ⅲ期患者(分别为76和13例)进行分析,对照组、沙利度胺组、VEGF降低组1年生存率和无进展生存率分别为63.6%、69.6%、65.9%和45.5%、56.5%、56.8%,3组比较,差异均无统计学意义(P>0.05);1年和3年局部控制率分别为66.7%、88.9%、87.1%和12.5%、71.4%、50.0%,3组比较,差异均无统计学意义(P>0.05);对照组、沙利度胺组、VEGF降低组3年生存率和无进展生存率分别为0.0%、31.3%、20.0%和0.0%、31.3%、16.7%,3组比较,差异均有统计学意义(P<0.05),见表 2。
|
|
表 2 各组局部晚期期患者生存率、无进展生存率和局部控制率(%)a Table 2 OS,PFS and LC rates of stage Ⅱ and ⅡI patients in the control,thalidomide and reduced VEGF groups (%)a |
5.沙利度胺对血清VEGF水平变化的影响:与放疗中VEGF水平比较,对照组放疗后血清VEGF水平降低、稳定和升高的患者分别为4、15和5例,沙利度胺组降低、稳定和升高的分别为13、11和0例;两组VEGF变化比较,差异有统计学意义(P<0.05)。
6.服用沙利度胺后VEGF变化与预后的关系:在沙利度胺组中,放疗后血清VEGF降低患者为13例,稳定的为11例。VEGF降低患者的1年生存率、1年无进展生存率、3年生存率、3年无进展生存率和3年局部控制率,均高于VEGF稳定的患者,差异均有统计学意义(P<0.05),见表 3。
|
|
表 3 沙利度胺组血清VEGF变化与患者的生存率、无进展生存率、局部控制率(%)a Table 3 OS,PFS and LC rates (%) of test group patients with varied changes in serum VEGF(%)a |
7.预后因素分析:单因素分析显示,性别、年龄、KPS评分、肿瘤部位、肿瘤分型、放疗4周病灶残存、化疗、放疗剂量对食管癌患者生存时间无影响(χ2=0.002~2.234,P均>0.05),T分期、N分期、TNM分期、放疗前原发灶长度、放疗后病灶残存与患者生存时间有关(χ2=4.250~9.209,P均>0.05),见表 4。Cox多因素分析显示,在调整了性别、年龄后,与Ⅰ期患者相比,Ⅱ期患者死亡风险(RR=3.837,95%CI:0.916~16.071),Ⅲ期患者死亡风险明显上升,差异有统计学意义(RR=4.868,P<0.05);食管癌放疗后有病灶残留的患者死亡风险明显增加,差异有统计学意义(RR=1.731,P<0.05),见表 5。
|
|
表 4 影响食管癌患者生存时间的单因素分析 Table 4 Univariate analysis of factors that influence the survival of esophageal cancer patients |
|
|
表 5 影响食管癌患者生存时间的多因素分析 Table 5 Multivariate analysis of factors that influence the survival of esophageal cancer patients |
讨 论
食管癌患者就诊时,有超过60%的患者因病期较晚或其他医学原因不能接受手术治疗[6],以放疗为主的综合治疗是食管癌非手术治疗的重要治疗手段。食管癌放化疗失败的原因之一可能是放疗诱导VEGF表达增加。VEGF主要是血管内皮细胞分泌的一种促进细胞分裂的因子,能特异性地促进血管内皮细胞分裂,增加毛细血管通透性,诱导内皮细胞迁移及血管的生成,与毛细血管密度呈正相关[8-9]。VEGF既可表达于血管内皮细胞、食管黏膜细胞、单核巨噬细胞等正常细胞中,也可表达于肿瘤细胞胞质、肿瘤血管内皮细胞中,并可从血清、渗出液中检测到[10]。VEGF在正常组织中含量较低,仅可维持正常血管密度和基本的渗透功能,以利于营养物质的运输[11]。食管癌组织中的表达明显高于正常组织,这是因为食管癌与其他恶性肿瘤一样其生长是血管依赖性的,肿瘤生长所需的营养依赖于血管的运输。血管形成是复杂的多阶段过程,在所有促进血管生成的因子中VEGF的作用最为重要,几乎参与血管形成全过程[9, 12]。目前已证明VEGF是食管癌的一个独立预后因素,在食管癌的复发、转移中起着决定性的作用。有研究表明,放化疗中VEGF变化与放疗敏感性和预后有关[6]。放疗中、放疗后的VEGF水平较放疗前降低的食管癌患者预后较好,反之预后较差。对放疗中VEGF不下降的食管癌患者在现有放化疗基础上进行治疗干预有可能提高患者长期生存率。
基础研究显示,沙利度胺等抗血管生成药物可增加食管癌细胞的放射敏感性[13-16]。Yu等[7]报道,食管癌患者放疗过程中加用沙利度胺有可能降低患者VEGF表达水平,服用沙利度胺耐受性较好。本研究参照王坚等[17]研究结果,观察沙利度胺对本组患者血清VEGF变化和预后的影响。结果显示,沙利度胺主要不良反应表现为不同程度的嗜睡。3组患者1年和3年的生存率、无进展生存率、局控率比较均无明显差异。分层分析显示,局部晚期患者的3年生存率、无进展生存率比较,沙利度胺组均好于对照组,差异有统计学意义,提示对放疗中VEGF稳定或升高的局部晚期食管癌患者常规放化疗同时加用沙利度胺有可能改善患者长期生存;1年生存率、1年无进展生存率、1年和3年局部控制率比较,差异无统计学意义,可能与入组患者数量较少有关,需增加样本量进一步研究。对照组和沙利度胺组分别有4和13例患者放疗后血清VEGF水平较放疗中降低;对照组有5例患者放疗后血清VEGF升高,而沙利度胺组血清VEGF均未升高,差异有统计学意义;提示加用沙利度胺可使放疗后血清VEGF水平下降。沙利度胺组VEGF降低的患者1年和3年生存率、1年和3年无进展生存率、3年局部控制率均高于VEGF稳定的患者,差异有统计学意义,提示沙利度胺使患者生存获益,其机制可能是通过抑制肿瘤VEGF分泌、抑制肿瘤血管生长,从而使患者生存期延长。
综上所述,放疗中VEGF不降低的食管癌患者,在常规放化疗基础上加用沙利度胺,其治疗不良反应可接受;沙利度胺可使放疗后血清VEGF水平下降,对于局部晚期食管癌患者加用沙利度胺可能改善预后。本研究组将扩大样本量进行研究,继续观察沙利度胺的疗效、不良反应以及对远期生存的影响,为提高非手术食管癌治疗疗效提供新的策略。
利益冲突 本研究接受常州市科技支撑社会发展项目(CE20165024);常州市科技局应用基础研究项目(CJ20159050);江苏省卫生厅指导性科研项目(Z201220);常州市科技支撑社会发展项目(CE20125021);常州市卫生局重大项目(ZD201105);常州市卫生局指导性科技项目(WZ201020)项目赞助。作者与作者家属未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 孙志强、王坚负责数据的整理和分析,论文起草和最终版本修订; 于静萍提供研究思路和提供研究方案;汪建林、倪新初、孟庆红、胡莉钧、李栋庆、李毅提供符合入组病例和随访; 孙苏平指导研究的实验设计、提供资料
| [1] | Clavier JB, Antoni D, Atlani D, et al. Baseline nutritional status is prognostic factor after definitive radiochemotherapy for esophageal cancer[J]. Dis Esophagus , 2014, 27 (6) : 560-567 DOI:10.1111/dote.2014.27.issue-6 |
| [2] | Cooper JS, Guo MD, Herskovic A, et al. Chemoradiotherapy of locally advanced esophageal cancer:long-term follow-up of a prospective randomized trial (RTOG 85-01). Radiation Therapy Oncology Group[J]. JAMA , 1999, 281 (17) : 1623-1627 |
| [3] | Zhao KL, Liu G, Jiang GL, et al. Association of haemoglobin level with morbidity and mortality of patients with locally advanced oesophageal carcinoma undergoing radiotherapy-a secondary analysis of three consecutive clinical phase ⅡI trials[J]. Clin Oncol (R Coll Radiol) , 2006, 18 (8) : 621-627 DOI:10.1016/j.clon.2006.04.015 |
| [4] | Cellini F, Valentini V. Targeted therapies in combination with radiotherapy in oesophageal and gastroesophageal carcinoma[J]. Curr Med Chem , 2014, 21 (8) : 990-1004 DOI:10.2174/09298673113209990236 |
| [5] | Wang W, Sun QK, He YF, et al. Overexpression of periostin is significantly correlated to the tumor angiogenesis and poor prognosis in patients with esophageal squamous cell carcinoma[J]. Int J Clin Exp Pathol , 2014, 7 (2) : 593-601 |
| [6] | 陆文斌, 于静萍, 倪新初, 等. 食管癌患者放化疗中病理反应与血清VEGF变化的关系及其对疗效和预后的影响[J]. 中华放射医学与防护杂志 , 2013, 33 (3) : 299-302 Lu WB, Yu JP, Ni XC, et al. Radiation between tumor pathologic response to concurrent chemo-radiotherapy and changes of serum VEGF level and its influence on the efficacy and prognosis in patients with esophagealcarcinoma[J]. Chin J Radiol Med Prot , 2013, 33 (3) : 299-302 DOI:10.3760/cma.j.issn.0254-5098.2013.03.020 |
| [7] | Yu JP, Sun SP, Sun ZQ, et al. Clinical trial of thalidomide combined with radiotherapy in patients with esophageal cancer[J]. World J Gastroenterol , 2014, 20 (17) : 5098-5103 DOI:10.3748/wjg.v20.i17.5098 |
| [8] | Qu W, Fu JD, Yang F, et al. Clinical implications of PTEN and VEGF expression status, as well as microvessel density in esophageal squamous cell carcinoma[J]. Oncol Lett , 2015, 10 (3) : 1409-1415 DOI:10.3892/ol.2015.3431 |
| [9] | Wang HL, Zhang ZL. Analysis of the relationship between ultrasound of breast cancer DOT-SDI and the expression of MVD, VEGF and HIF-1α[J]. Cell Biochem Biophys , 2014, 70 (1) : 205-208 DOI:10.1007/s12013-014-9883-x |
| [10] | Lu JJ, Ma J, Miao R, et al. Expression of vascular endothelial growth factor D in human esophageal squamous cell carcinoma tissue and its significance[J]. Chin J Gastrointest Surg , 2013, 16 (12) : 1191-1194 |
| [11] | Bedoya F, Meneu JC, Macias MI, et al. Mutation in CNR1 gene and VEGF expression in esophageal cancer[J]. Tumori , 2009, 95 (1) : 68-75 |
| [12] | Anannamcharoen S, Nimmanon T. Study of the vascular endothelial growth factor (VEGF) expression and microvascular density (MVD) in primary colorectal cancer specimens[J]. J Med Assoc Thai , 2012, 95 (8) : 1041-1047 |
| [13] | Yoon MS, Nam TK, Chung WK, et al. Metabolic response of pelvic and para-aortic lymph nodes during radiotherapy for carcinoma of the uterine cervix:using positron emission tomography/computed tomography[J]. Int J Gynecol Cancer , 2011, 21 (4) : 699-705 |
| [14] | You Y, Liu J, Wang Z, et al. The enhancement of radiosensitivity in human esophageal squamous cell carcinoma cells by zoledronic acid and its potential mechanism[J]. Cytotechnology , 2014, 66 (1) : 17-25 DOI:10.1007/s10616-012-9532-4 |
| [15] | Yu J, Liu F, Sun M, et al. Enhancement of radiosensitivity and the potential mechanism on human esophageal carcinoma cells by tetrandrine[J]. Cancer Biother Radiopharm , 2011, 26 (4) : 437-442 DOI:10.1089/cbr.2011.0964 |
| [16] | Yoon MS, Nam TK, Lee JS, et al. VEGF as a predictor for response to definitive chemoradiotherapy and COX-2 as a prognosticator for survival in esophageal squamous cell carcinoma[J]. J Korean Med Sci , 2011, 26 (4) : 513-520 DOI:10.3346/jkms.2011.3326.3344.3513 |
| [17] | 王坚, 汪建林, 于静萍, 等. 食管癌放化疗中血清血管内皮生长因子连续检测及其临床意义[J]. 中华放射医学与防护杂志 , 2016, 36 (4) : 278-282 Wang J, Wang JL, Yu JP, et al. Clinical significance of continuous detection of VEGF in patients undergoing chemoradiotherapy for esophageal carcinoma[J]. Chin J Radiol Med Prot , 2016, 36 (4) : 278-282 DOI:10.3760/cma.j.issn.0254-5098.2016.04.009 |
 2016, Vol. 36
2016, Vol. 36


