目前放疗仍然是肺癌重要的治疗手段,而放射抗拒是导致放疗后局部肿瘤复发和远处转移最重要的原因。Toll样受体家族(TLRs) 是沟通天然免疫和获得性免疫的天然模式识别受体(pattern recognition receptor,PRR),在识别和抵御各种病原微生物感染中发挥着重要作用;而越来越多研究表明,TLR9在多数肿瘤组织中表达增高,并且TLR9信号通路的激活参与了肿瘤的发生发展和侵袭的过程,并且影响着肿瘤治疗的结果。在本组前期研究中已经证实肺癌组织TLR9高表达,并且TLR9表达增高与肺癌患者术后放疗生存相关,在此基础上本研究通过靶向干扰RNA技术旨在探讨抑制TLR9表达对R-A549细胞辐射敏感性的影响。
材料与方法1. 实验试剂及材料:改良型RPMI 1640培养基(美国赛默飞公司),胎牛血清(杭州四季青生物工程材料有限公司);靶向TLR9 siRNA及阴性对照siRNA[(美国 SANTA CRUZ公司) TLR9siRNA(h):sc-40270,siRNA-A:sc-37007],转染试剂Lipofec-tamineTM 2000、无抗培养基Opti-MEM(美国Invitrogen公司);兔源TLR9单抗和鼠源GAPDH单抗(美国Abcam公司);FITC细胞周期PI试剂(美国 BD phamingen公司)。
2. 放射抗拒肺癌A549细胞制备:人肺癌细胞株A549由复旦大学附属肿瘤医院馈赠,以10%小牛血清+改良型RPMI 1640培养,置于37℃、含5%的CO2培养箱中,0.25%胰酶消化传代,取2~3代对数生长期细胞进行R-A549细胞制备和实验。采用本组前期研究方法制备R-A549细胞[1],瑞典Elekta直线加速器,6 MV X射线照射,源靶距100 cm,吸收剂量率2 Gy/min,6.37 Gy/次,共照射10次,每次照射后更换1次培养基,之后根据细胞贴壁生长状态,2~3 d再次更换培养基,细胞传5代以内且贴壁达80%左右再次照射,直到完成10次照射,完成R-A549细胞制备。
3. R-A549细胞培养及siRNA转染:R-A549细胞于RPMI 1640培养基、10%胎牛血清置于37℃、5%的CO2培养箱培养传代,取其1~2代对数生长期细胞进行siRNA转染。将稳定生长的对数期R-A549细胞以3.5×105/孔接种于6孔板,以RPMI 1640培养基、10%胎牛血清继续培养,待其贴壁生长达50%~70%时进行转染;按照说明分别以60、80和100 μmol/L的转染终浓度进行实验,取相应量TLR9 siRNA和对照siRNA分别与LipofectamineTM 2000混合形成转染复合物,将转染复合物加入无抗培养基Opti-MEM至2 ml/孔,再加入6孔板轻轻混匀进行细胞转染,期间置于37℃、5%的CO2培养箱6 h,后换液RPMI 1640培养基、10%胎牛血清继续培养;48 h后进行蛋白抽提,验证TLR9siRNA转染抑制效率,确定转染终浓度为80 μmol/L;细胞照射安排在转染24 h后进行,照射剂量10 Gy,6 MV X射线单次照射。
4. 实验细胞分组及其TLR9表达:将A549细胞(A549)、R-A549细胞(R-A549)、阴性siRNA转染细胞、TLR9 siRNA转染4组细胞作为实验对象。Western blot验证其TLR9表达。于细胞转染48 h后,冰上裂解细胞,超声破碎进行蛋白抽提,二喹啉甲酸(BCA)法测定蛋白浓度,之后进行蛋白变性处理。SDS-PAGE分离胶为5%~10%的梯度胶,为等体积加样,每加样孔上样量为10 μl,80 V恒压电泳至marker开始分离时改为120 V恒压电泳到底;以100 V恒压湿法转膜60 min,10%牛奶(脱脂奶粉+TBST+0.1%吐温-20)室温摇床封闭4 h,1×TBST清洗3次,每次10 min,一抗(兔源TLR9单抗、鼠源GAPDH抗体:abcam)4℃孵育过夜;第2天弃去一抗,1×TBST洗膜3次,每次10 min,辣根过氧化物酶(HRP)标记的二抗室温孵育1 h,1×TBST洗膜3次,每次10 min,ECL化学显色(A液∶B液=1∶1),暗室曝光显影图像处理。
5.各实验组照射前后细胞活力的测定:siRNA转染24 h后分别取4个实验组的对数生长期细胞,以每孔3 000个细胞接种于96孔板,各组设3个复孔,以PBS作为空白对照,培养24 h后,加入10 μl/孔 CCK-8试剂,振匀后避光培养2 h,上酶标仪测其吸光度(A450 nm)值;照射组实验细胞进行6 MV X射线照射10 Gy,继续培养24 h后加入CCK-8试剂,避光2 h后上酶标仪检测各组细胞活力。细胞存活率(%)=siRNA转染细胞平均A450 nm/R-A549细胞平均 A450 nm×100%。
6. 转染细胞克隆集落形成实验:将指数生长期R-A549细胞和转染组细胞,接种于6孔板(每孔3.5×105个细胞),培养24 h后分别给以0、2、4、6和8 Gy 6 MV X射线照射细胞,照射后立即用胰酶消化细胞,吹打成细胞悬液,分别接种于培养皿(每皿接种1 000个细胞)中,培养14 d,中间更换培养液1次。之后磷酸盐缓冲液(PBS)清洗2遍,甲醇固定2 h,姬姆萨染色,计数细胞集落(含50个细胞以上);计算集落形成率(PE,%)=集落数/接种细胞数×100%,细胞存活分数(SF)=处理组PE/空白对照组PE。
7. siRNA转染细胞照射前后细胞周期检测:R-A549细胞、阴性siRNA转染细胞和TLR9 siRNA转染细胞完成以上处理并培养24 h后,进行6 MV X射线源靶距100 cm照射,照射剂量10 Gy后换液继续培养24 h,胰酶消化和收集各组细胞,预冷PBS洗3次,预冷的70%乙醇固定于-20℃ 2 h以上;室温1 000 g离心5 min,去上清,PBS洗1次,吸去上清,加入细胞周期试剂PI(50 μg/ml)重悬细胞,避光4℃静置20 min,上流式细胞仪检测。对siRNA转染细胞和R-A549细胞不予 X射线照射,同期流式细胞周期检测。
8. 统计学处理:计量资料以x±s表示。数据分析采用SPSS 17.0软件进行统计学处理,组间比较采用方差分析;应用GraphPad Prism5.0软件进行统计图形制作。 P<0.05为差异有统计学意义。
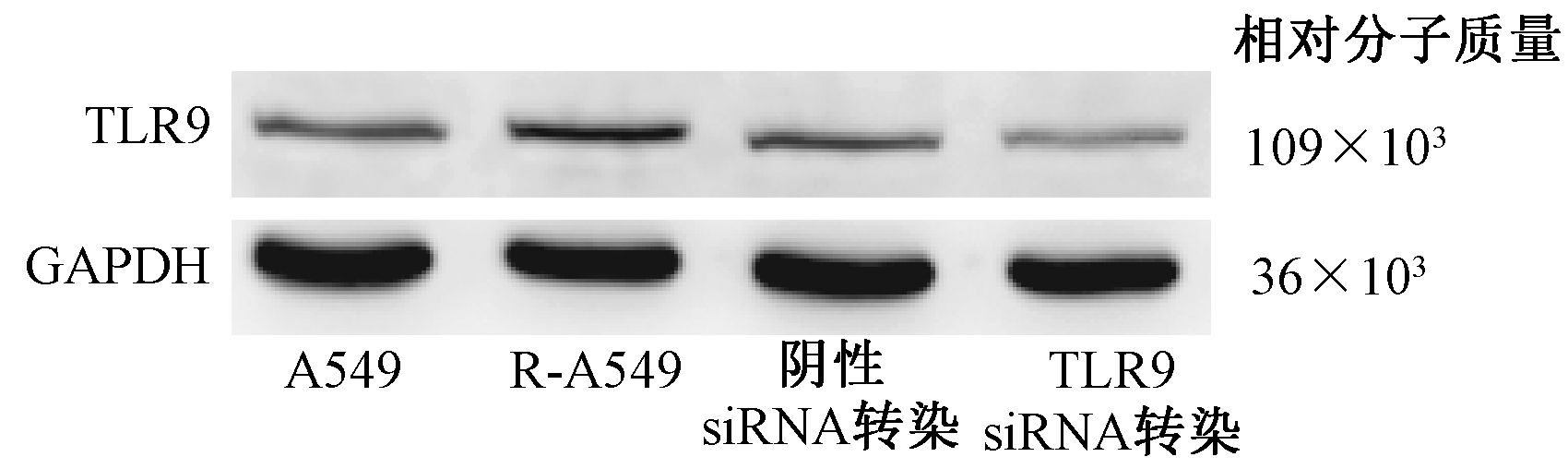
结果1. Western blot检测各组细胞TLR9表达结果:对肺癌A549细胞和R-A549细胞以及转染siRNA后各实验组细胞TLR9蛋白Western blot检测,结果见图 1,R-A549细胞比A549细胞TLR9的表达水平增高,差异有统计学意义(t=5.429,P<0.05),TLR9siRNA转染细胞TLR9表达水平较R-A549细胞降低,其TLR9表达水平为R-A549细胞的38%,二者比较差异有统计学意义(t=8.549,P<0.05)。
|
图 1 4组实验细胞TLR9蛋白Western blot检测结果 Figure 1 TLR9 expressions in A549,R-A549,TLR9-siRNA transfected R-549 and its negative control R-A549 cells |
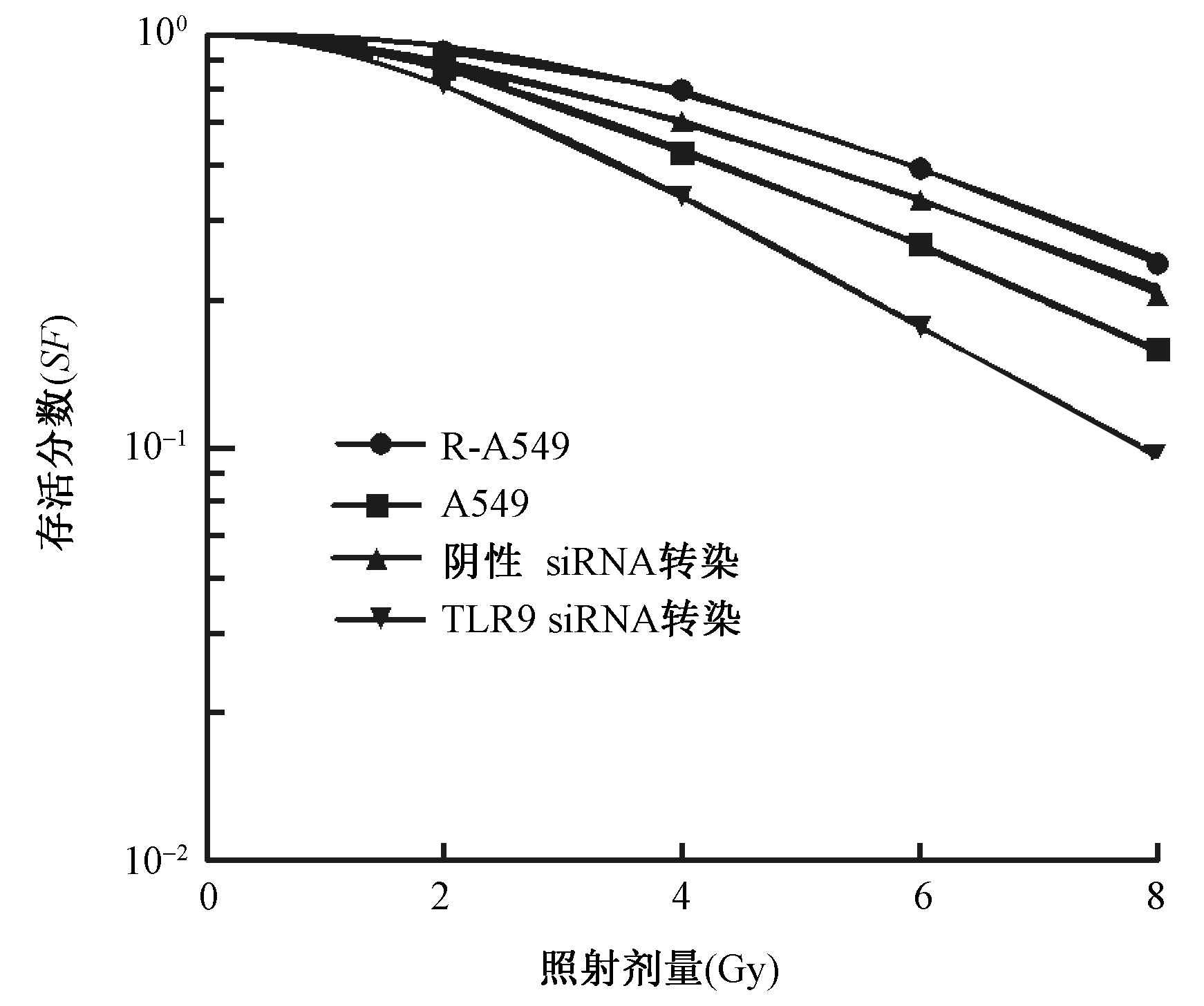
2. siRNA转染R-A549细胞克隆集落形成: A549细胞、R-A549细胞、阴性siRNA转染细胞、TLR9 siRNA转染细胞给予0、2、4、6 和8 Gy照射后进行细胞存活分数对比,结果显示,2、4、6和8 Gy照射后A549细胞、阴性siRNA转染细胞、TLR9 siRNA转染细胞存活分数均低于R-A549组细胞;经过单击多靶模型曲线拟合(图 2),计算得到4组细胞D0、Dq、N值,结果见表 1,其中A549细胞和TLR9 siRNA转染细胞较R-A549细胞有较低的D0、Dq和N值,阴性siRNA转染细胞较R-A549细胞D0值增高,根据放射增敏比公式计算得到A549细胞、阴性siRNA转染细胞和TLR9 siRNA转染细胞相对于R-A549细胞的放射增敏比(SERD0),分别为1.09、0.90和1.37。
|
图 2 各实验组细胞集落形成结果 Figure 2 Cloning survival of A549,R-A549,TLR9-siRNA transfected R-549 and its negative control R-549 cells |
|
|
表 1 4组实验细胞放射增敏比比较 Table 1 SERD0 of A549,R-A549,TLR9-siRNA transfected R-549 and its negative control R-549 cells |
3. 实验组细胞活力测定: 对4组实验细胞进行细胞增殖能力测定,结果见表 2,与R-A549细胞相比,给予0 Gy照射时,阴性siRNA转染细胞和TLR9 siRNA转染细胞活力增加,照射10 Gy后A549细胞、阴性siRNA转染细胞和TLR9 siRNA转染细胞活力较0 Gy照射降低,照射前后A549细胞、阴性siRNA转染细胞和TLR9 siRNA转染细胞增殖能力变化差异均有统计学意义 (t=3.041、4.077和8.410,P<0.05)。
|
|
表 2 X射线照射对各组细胞活力的影响(A值,x±s) Table 2 Effect of 10 Gy X-ray radiation on the viability of A549,R-A549,TLR9-siRNA transfected R-549 and its negative control R-549 cells (A,x±s) |
4.siRNA转染细胞周期分布检测结果: 对R-A549细胞、阴性siRNA转染细胞和TLR9 siRNA转染细胞进行10 Gy照射前后的流式细胞周期检测,结果见表 3。R-A549细胞、TLR9 siRNA转染细胞照射后,G2/M和S期细胞均比照射前增加;而G1/G0期细胞则比照射前减少;阴性siRNA转染细胞照射前后表现为G2/M期细胞分布降低,G1/G0期细胞分布增加。进一步对比照射后siRNA转染细胞和R-A549细胞周期分布,发现TLR9 siRNA转染细胞G2/M和S期分布较R-A549细胞均增加(t=4.323、6.499,P<0.05),G1/G0期细胞分布较R-A549细胞减少,差异有统计学意义(t=7.616,P<0.05);阴性siRNA转染细胞则表现为G2/M期、S期细胞分布低于R-A549细胞,G1/G0期细胞分布增加。
|
|
表 3 siRNA转染R-A549细胞照射前后各组细胞周期分布(x±s) Table 3 The cell cycle distribution of TLR9-siRNA transfected R-A549 cells before and after irradiation(x±s) |
讨 论
已知TLR9受体在树突状细胞(pDC) 和B细胞中高表达,细菌和病毒DNA中的非甲基化CpG DNA作为其配体,通过激活TLR9信号通路pDC可产生大量的I型IFNs,发挥直接和/或间接的细胞毒作用,并刺激B细胞大量增殖,同时促进IgM分泌[2-3],在识别和抵御各种病原微生物感染中发挥着重要作用;而现在越来越多的研究[4-6]表明,TLR9也在多种实体肿瘤中表达增高,参与了肿瘤的产生、侵袭和转移过程,不仅与肿瘤的临床分期相关,也影响着肿瘤治疗的结果。
放射治疗是肺癌最常用的治疗方法,常规分割照射“4R”理论—肿瘤细胞再氧合、细胞周期再分布、照射后期细胞再增殖和再群体化贯穿于放射治疗的全过程,这一过程中部分肿瘤细胞成为放射耐受细胞,进一步克隆增殖后产生放射抗拒[7]。而进一步研究证实,电离辐射诱导激活了一系列的信号分子和通路,诸如细胞周期调控、DNA损伤与修复、细胞凋亡、癌基因与抑癌基因、细胞代谢等过程,有结果显示受到照射的肿瘤细胞60多种基因的表达上调[8],导致细胞粘附、肿瘤血管生成增加,利于肿瘤的侵袭和转移,产生肿瘤的放射抗拒。已知TLR9被相应配体激活后,分别激活核转录因子AP-l、NF-kB和Stat1,一方面诱导各类细胞增殖因子合成而促进肿瘤的生长,另一方面促进炎症介质TNFα、IL-1、IL-6、IL-8等合成增加,引起促炎症免疫反应或抑炎症免疫反应,参与肿瘤微环境的形成[9]; Ren等[10]Xu等[11]研究证实,肺癌细胞TLR9信号通路激活能上调炎性因子、MMP-2(基质金属蛋白酶)和趋化因子受体水平,同时又促进免疫抑制因子IL-10的分泌,最终导致肿瘤细胞显著增殖,从而增加了肿瘤细胞侵袭和转移的能力。本组的前期研究中通过免疫组织化学证实肺癌组织中TLR9表达增高,而正常肺泡细胞中TLR9并无表达,肺癌组织TLR9表达增高的水平与肿瘤直径、淋巴结有无转移呈正相关,且TLR9表达与肺癌术后放疗的生存相关[12];因此,本研究利用前期研究的TLR9表达增高的放射抗拒肺癌A549细胞作为研究对象,通过siRNA脂质体转染技术,探讨抑制其TLR9表达对辐射治疗结果的影响。
本组前期对CpG ODN7909的辐射增敏研究发现[1],放射抗拒肺癌A549(R-A549)细胞TLR9表达明显增高,细胞倍增时间明显延长,辐射敏感性下降。本研究沿用了前期制备R-A549细胞的实验方法,并经Western blot证实R-A549细胞TLR9表达高于A549细胞;采用脂质体转染技术将TLR9 siRNA及阴性 siRNA对R-A549细胞进行瞬时转染并予以TLR9表达的验证,TLR9 siRNA转染组细胞呈现出TLR9蛋白的低水平表达,为后续的辐射增敏研究奠定基础。国内有研究者通过RNA干扰技术抑制MDC1蛋白表达,对放射线诱导食管癌细胞ECA109克隆形成率下降有促进作用[13]。本研究通过细胞克隆集落形成实验也得出类似结果。转染TLR9 siRNA组R-A549细胞照射后细胞克隆形成率低于R-A549细胞和A549细胞,转染阴性 siRNA组R-A549细胞照射后克隆形成与R-A549细胞克隆集落形成相差不大,经过单击多靶模型拟合,结果A549细胞和转染TLR9 siRNA组细胞均较R-A549细胞有较低的D0、Dq、N值,二者的放射增敏比分别为1.09和1.37,而转染阴性 siRNA组细胞较R-A549细胞D0值增高,Dq、N值降低,二者的放射增敏比为0.90;说明通过靶向siRNA抑制R-A549细胞TLR9表达,能够降低R-A549照射后的克隆集落形成率,具有放射增敏的作用。
进一步对siRNA转染细胞照射前后的细胞周期分布进行分析,结果显示,照射后R-A549组和TLR9 siRNA转染组细胞的G2/M期分布均较照射前增多,而G1/G0期细胞分布照射后二者均减少;其中照射后TLR9 siRNA转染组细胞的G2/M期分布比R-A549组明显增多,显示出TLR9 siRNA转染组细胞较R-A549细胞照射后有更多细胞阻滞在G2/M期;已有研究证实DNA损伤后细胞周期激酶立即被激活,通过激活下游调节通路,主要调节S期和/或G2/M期检测点[14]。周福祥等[15]发现放射抗拒细胞Hep-2R有CDC25基因下调,导致G2/M期细胞减少,而CDC25B基因主要是调节细胞向G2/M期转化,因此,本研究中TLR9 siRNA转染组细胞照射后发生G2/M期阻滞意味着放射敏感性的提高;同时照射后TLR9 siRNA转染组细胞的G1/G0期分布比R-A549组明显减少,也有效抑制了放疗后肿瘤细胞的潜在致死性损伤修复能力,也利于R-A549细胞放射敏感性的提高。本研究结果显示TLR9 siRNA转染细胞照射后S期细胞分布明显高于R-A549细胞,而S期细胞是对放射线最不敏感。
综上所述,本研究通过靶向干扰RNA方法成功抑制了R-A549细胞TLR9表达水平,降低了R-A549细胞的克隆形成,而且通过抑制TLR9表达使其放疗后发生G2/M期细胞阻滞并减少G1/G0期细胞分布。因此,具有辐射增敏的作用,为肺癌放疗效果预测或放疗增敏提供了新的思路。
利益冲突 本研究受上海市金山区科委基金资助,课题编号2014-3-19,与其他研究者未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证。与其他作者及基金无任何利益冲突作者贡献声明 高彩霞设计研究方案,执行实验的主要内容,收集数据后统计并起草论文;乔田奎指导实验过程,修改论文;张彬负责细胞照射;袁素娟负责细胞实验检测
| [1] | Yan L, Xu G, Qiao T, et al. CpG-ODN 7909 increases radiation sensitivity of radiation-resistant human lung adenocarcinoma cell line by overexpression of Toll-like receptor 9[J]. Cancer Biother Radiopharm , 2013, 28 (7) : 559-564 DOI:10.1089/cbr.2012.1450 |
| [2] | Kolumam GA, Thomas S, Thompson LJ, et al. Type I interferons act directly on CD8 T cells to allow clonal expansion and memory formation in response to viral infection[J]. J Exp Med , 2005, 202 (5) : 637-650 DOI:10.1084/jem.20050821 |
| [3] | Havenar-Daughton C, Kolumam GA, Murali-Krishna K. Cutting edge:the direct action of type I IFN on CD4 T cells is critieal for sustaining clonal expansion in response to a viral but not a bacterial infection[J]. J Immunol , 2006, 176 (6) : 3315-3319 DOI:10.4049/jimmunol.176.6.3315 |
| [4] | Jukkola-Vuorinen A, Rahko E, Vuopala KS, et al. Toll-like receptor-9 expression is inversely correlated with estrogen receptor status in breast cancer[J]. J Innate Immun , 2009, 1 (1) : 59-68 DOI:10.1159/000151602 |
| [5] | Väisänen MR, Jukkola-Vuorinen A, Vuopala KS, et al. Expression of Toll-like receptor-9 is associated with poor progression-free survival in prostate cancer[J]. Oncol Lett , 2013, 5 (5) : 1659-1663 DOI:10.3892/ol.2013.1204 |
| [6] | Qiu J, Shao S, Yang G, et al. Association of Toll like receptor 9 expression with lymph node metastasis in human breast cancer[J]. Neoplasma , 2011, 58 (3) : 251-255 DOI:10.4149/neo_2011_03_251 |
| [7] | Short SC, Woodcock M, Marples B, et al. Effects of cell cycle phase on low-dose hyper-radiosensitivity[J]. Int J Radiat Biol , 2003, 79 (2) : 99-105 DOI:10.1080/0955300021000045646 |
| [8] | Torres-Roca JF, Eschrich S, Zhao H, et al. Prediction of radiation sensitivity using a gene expression classifier[J]. Cancer Res , 2005, 65 (16) : 7169-7176 DOI:10.1158/0008-5472.CAN-05-0656 |
| [9] | Chen K, Huang J, Gong W, et al. Toll-like receptors in inflmmation, infection and cancer[J]. Int Immunopharmacol , 2007, 7 (10) : 1271-1285 DOI:10.1016/j.intimp.2007.05.016 |
| [10] | Ren T, Xu L, Jiao S, et al. TLR9 signaling promotes tumor progression of human lung cancer cell in vivo[J]. Pathol Oncol Res , 2009, 15 (4) : 623-630 DOI:10.1007/s12253-009-9162-0 |
| [11] | Xu L, Wang C, Wen Z, et al. CpG o1igodeoxynucleotides enhance the efficacy of adoptive cell transfer using tumor infiltrating lymphocytes by modifying the Th1 polarization and local infiltration of Thl7 cells[J]. Clio Dev Immunol , 2010, 2010 : 410893 DOI:10.1155/2010/410893 |
| [12] | 高彩霞, 乔田奎, 张彬, 等. 肺癌组织中Toll样受体9的表达及其对术后放疗生存的影响[J]. 癌变·畸变·突变 , 2015, 27 (4) : 294-298 Gao CX, Qiao TK, Znang B, et al. Effect of Toll-like receptor 9 expression in postoperative radiotherapy in lung cancer survivors[J]. Carcinogenesis, Teratogenesis & Mutagenesis , 2015, 27 (4) : 294-298 DOI:10.3969/j.issn.1004-616x.2015.04.008 |
| [13] | 刘志坤, 祝淑钗, 苏景伟, 等. RNA干扰MDC1基因对食管癌细胞X线照后细胞周期及相关蛋白表达影响[J]. 中华放射肿瘤学杂志 , 2015, 24 (6) : 708-712 Liu Zhikun, Zhu Shuchai, Su Jingwei, et al. Effect of RNA interference of MDC1 gene cell cycle and expression of related proteins in esophageal carcinoma cells after X-ray radiation[J]. Chin J Radiat Oncol , 2015, 24 (6) : 708-712 DOI:10.3760/cma.j.issn.1004.4221.2015.06.025 |
| [14] | Sasaki H, Yukiue H, Kobayashi Y, et al. Expression of the CDC25B gene as a prognosis marker in non-small cell lung-cancer[J]. Cancer Letters , 2001, 173 (2) : 187-192 DOI:10.1016/S0304-3835(01)00669-3 |
| [15] | 周福祥, 周云峰, 骆志国, 等. 放射抗拒Υ细胞模型基因表达异常对比研究[J]. 中华放射医学与防护杂志 , 2007, 27 (6) : 526-529 Zhou FX, Zhou YF, Luo ZG, et al. Alterations in gene expression profiles between radioresistant and radiosensitive cell lines[J]. Chin J Radiol Med Prot , 2007, 27 (6) : 526-529 DOI:10.3760/cma.j.issn.0254-5098.2007.06.003 |
 2016, Vol. 36
2016, Vol. 36


