乳腺癌是女性最常见的恶性肿瘤,死亡率位于女性所有肿瘤的第2位[1]。放射治疗是乳腺癌术后的主要辅助治疗手段[2]。然而,一些乳腺癌亚型在放疗后的复发率依旧很高[3]。因此,明确乳腺癌组织产生辐射抵抗的分子机制,能够为乳腺癌治疗方案的制定提供有效的理论依据。
自噬是发生在细胞内的一种“自食”现象。在乳腺癌的治疗过程中,自噬与乳腺癌放化疗耐受密切相关[3]。乙肝病毒X蛋白连接蛋白(HBXIP)是一种保守的细胞组成型蛋白[4]。研究表明,HBXIP作为转录辅激活子可以与CREB、TFⅡD、Sp1和E2F1等转录因子相互作用促进乳腺癌的发生和发展[5-7]。STAT3作为转录因子在调节肿瘤细胞自噬的过程发挥着重要作用[8-10]。本研究探讨了HBXIP对电离辐射引起的乳腺癌细胞自噬的影响,并对其机制进行了初步的探究。
材料与方法1. 试剂:青、链霉素(P/S)、吖啶橙(AO)购自美国Sigma公司,DMEM高糖培养基购自美国HyClone公司,放射免疫沉淀测定(RIPA)细胞裂解液购自北京博士德生物工程有限公司,鼠抗LC3、兔抗STAT3、p-STAT3(Y705)、HBXIP抗体购自美国Abcam公司,辣根过氧化物酶(HRP)耦联的GAPDH、HRP耦联的羊抗兔IgG、HRP耦联的羊抗鼠IgG均购自武汉三鹰生物科技有限公司,ECL发光液购自北京康为世纪生物科技有限公司,转染试剂Lipofectamine 2000购自美国Invitrogen 公司。
2. 细胞培养与照射:乳腺癌MDA-MB-231细胞由本实验室稳定传代。MDA-MB-231细胞用含10% 胎牛血清和1%青、链霉素的DMEM培养基于37℃、5%CO2饱和湿度的培养箱中培养,待细胞融合度达80%时传代,每2~3天更换培养液。用137Cs γ射线(型号USD,1Autocell40,加拿大原子能有限公司)照射细胞,吸收剂量4 Gy,吸收剂量率1 Gy/min,源靶距100 cm。实验分为对照组、HBXIP转染组、si-HBXIP转染组、HBXIP和si-STAT3共转染组。各处理组于照后0、24、48、72 h检测嗜酸性自噬泡及蛋白表达水平。
3. pCMV-HBXIP和siRNA-HBXIP的转染:利用Lipofectamine 2000试剂,按照说明书操作,转染目标量的pCMV-HBXIP及siRNA-HBXIP和siRNA-STAT3。主要步骤为:转染前8~12 h铺板,过夜待合适浓度后,将待转染的pCMV-HBXIP、siRNA-HBXIP和siRNA-STAT3及脂质体Lipofectamine 2000分别用DMEM无血清培养液稀释并按一定比例混合,室温作用15~30 min后加入待转染细胞,置37℃、5% CO2培养6~8 h后换液,24 h后收细胞进行照射。
4.流式细胞术检测嗜酸性自噬泡(acidic vesicular organelles,AVOs):将细胞收集到EP管中,用1 ml PBS重悬,向重悬的细胞中加入AO(终浓度为100 μg/ml)染液进行染色,15 min后1 000 r/min离心10 min,离心半径为10 cm。 PBS清洗细胞两次后用0.3 ml的PBS重悬,流式细胞仪进行检测。
5. Western blot检测蛋白的表达水平:收集处理过的细胞,冰上裂解30 min,4℃、12 000 r/min离心15 min,离心半径为10 cm。吸取上清,蛋白定量试剂盒测定蛋白质浓度,加入1/4体积的上样缓冲液煮沸10 min,制备成蛋白样品。取50 μg蛋白样品进行SDS-PAGE电泳,并转移至聚偏二氟乙烯膜(PVDF) 膜,5%脱脂奶粉室温封闭1 h,抗LC3(1∶1 000)、HBXIP(1∶1 000)、STAT3(1∶1 000)、p-STAT3(Y705)(1∶1 000)、GAPDH(1∶5 000)抗体4℃过夜杂交,HRP标记的二抗室温孵育2 h,滴加辣根过氧化物酶底物(ECL)发光液,化学发光成像系统成像分析。
6.统计学处理:数据用x±s形式表示。所有实验重复3次。采用Graphpad Prism 5.0软件作图并分析数据。采用SPSS 10.0统计学软件进行分析,多组间比较用单因素方差分析,两两比较用t检验。P<0.05为差异有统计学意义。
结 果1. HBXIP调节辐射诱导的细胞自噬:结果见图 1。经4 Gy γ射线照射后,外源性过表达HBXIP的人乳腺癌MDA-MB-231细胞中所含AVOs的细胞数明显低于对照组细胞含AVOs量(t=3.67、9.74、10.15,P<0.05),并且外源性过表达HBXIP的细胞中LC3-Ⅱ的表达量低于对照组细胞。相反,利用siRNA-HBXIP干扰HBXIP的乳腺癌细胞中含有AVOs的细胞数则高于对照组(t=3.50、4.15、12.12,P<0.05)。
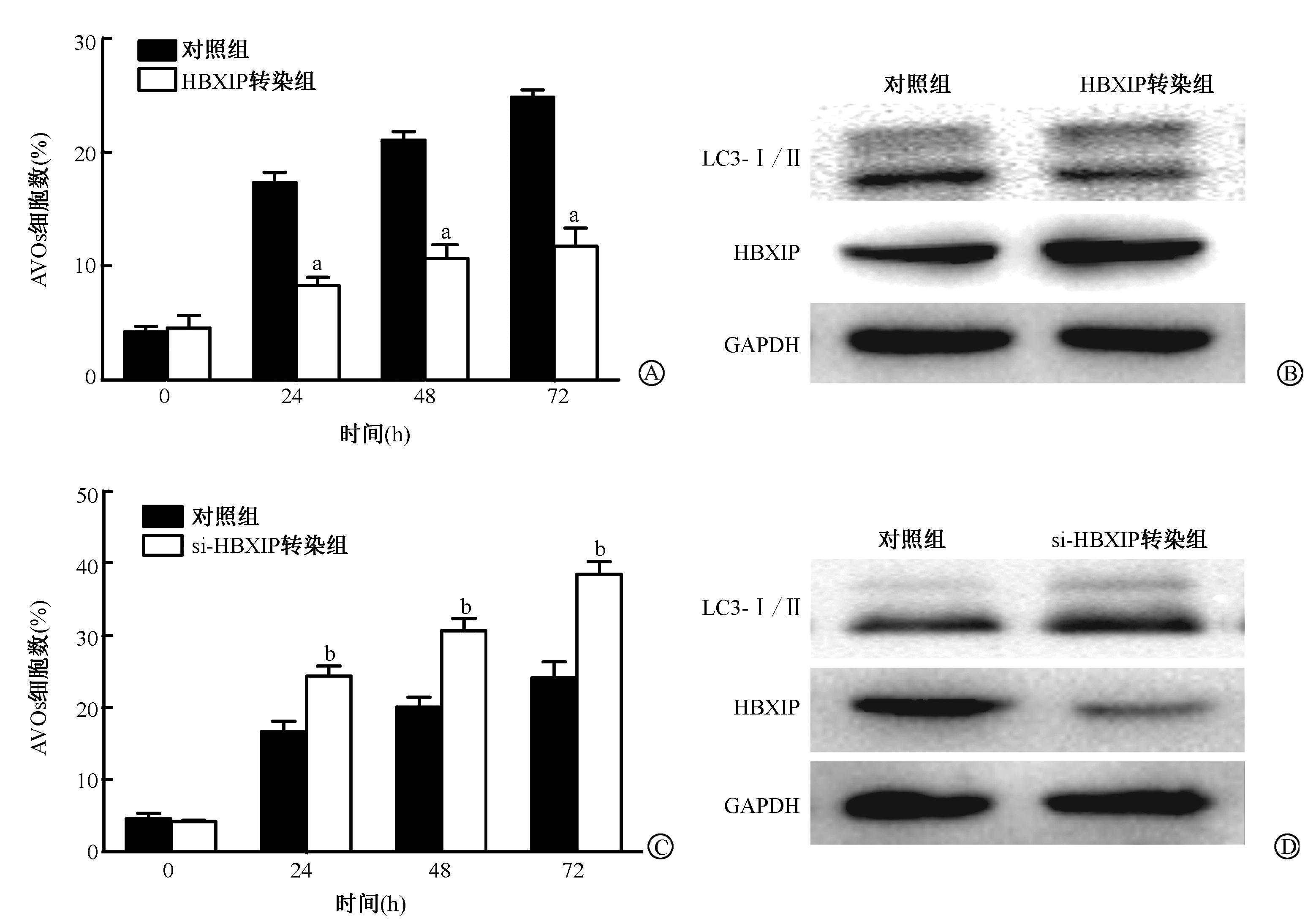
|
图 1 HBXIP对辐照诱导MDA-MB-231细胞自噬和LC3-Ⅰ/Ⅱ蛋白表达的影响 A.过表达HBXIP减少辐射诱导MDA-MB-231细胞AVOs的形成;B.过表达HBXIP减少辐射诱导的MDA-MB-231细胞中LC3-Ⅰ/Ⅱ蛋白的表达;C.干扰HBXIP增加辐射诱导MDA-MB-231细胞AVOs的形成;D.干扰HBXIP增加辐射诱导的MDA-MB-231细胞中LC3-Ⅰ/Ⅱ蛋白的表达 注:与同一时间对照组相比,at=3.67、9.74、10.15,P<0.05;bt=3.50、4.15、12.12,P<0.05 Figure 1 Effects of HBXIP on autophagy and expression of LC3-Ⅰ/Ⅱ proteins in irradiated MDA-MB-231 cells A. Overexpression of HBXIP significantly reduced the increase of AVOs formation in irradiated MDA-MB-231 cells;B. Overexpression of HBXIP significantly reduced LC3-Ⅱ protein expression in irradiated MDA-MB-231 cells;C. si-RNA-mediated depletion of HBXIP expression markedly improved AVOs formation in irradiated MDA-MB-231 cells;D. si-RNA-mediated depletion of HBXIP expression markedly improved LC3-Ⅱ protein expression in irradiated MDA-MB-231 cells |
外源性干扰HBXIP的乳腺癌MDA-MB-231细胞中LC3-Ⅱ的表达量明显高于对照组。Western blot实验结果验证了转染pCMV-HBXIP或者si-HBXIP质粒后HBXIP蛋白表达水平的改变,表明HBXIP表达水平的改变可以调节辐射诱导的乳腺癌MDA-MB-231细胞的自噬。
2. HBXIP调节射线诱导的乳腺癌细胞中p-STAT3(Y705)的表达:结果见图 2。外源性过表达HBXIP可以明显上调受照MDA-MB-231细胞中p-STAT3(Y705)蛋白磷酸化的表达水平,而且这种升高与转染的HBXIP表达量成正比;相反,siRNA-HBXIP降低HBXIP的表达可下调p-STAT3(Y705)的表达水平,且这种降低与HBXIP表达抑制量成正比。但是,人为干扰细胞中的HBXIP表达,无论是增加还是降低HBXIP蛋白表达水平对STAT3总蛋白都没有明显的影响。
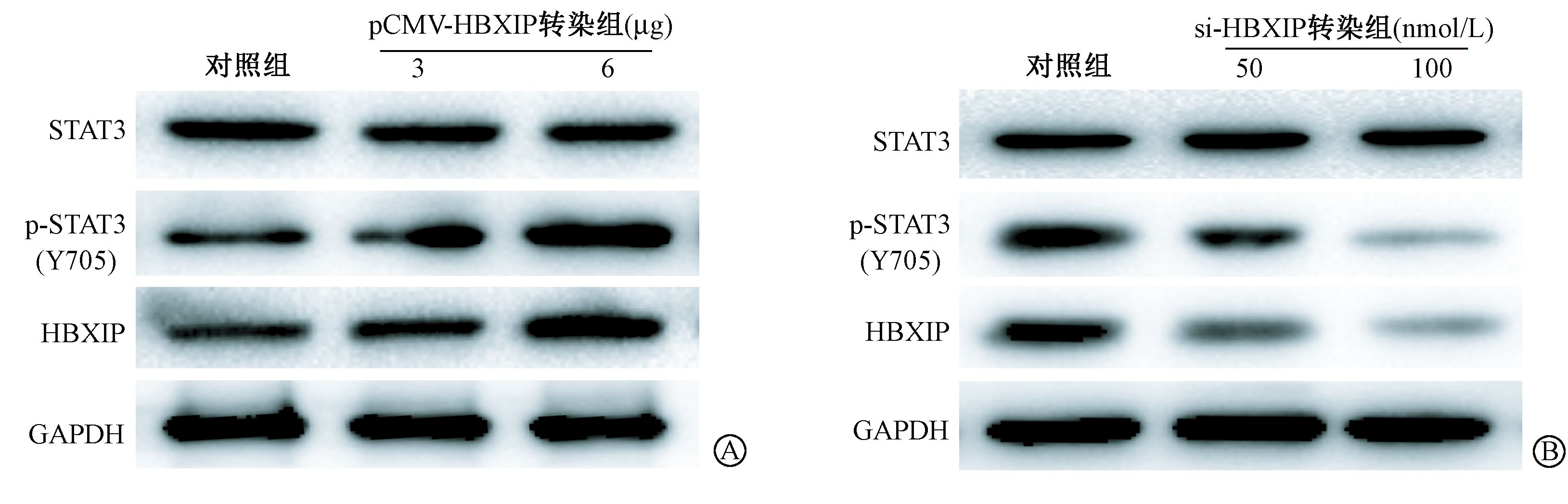
|
图 2 HBXIP对电离辐射诱导的MDA-MB-231细胞中STAT3(Y705)蛋白磷酸化的影响 A. 过表达HBXIP促进辐射诱导的MDA-MB-231 细胞中STAT3(Y705)蛋白磷酸化;B. 干扰HBXIP降低辐射诱导的MDA-MB-231细胞中STAT3(Y705)蛋白磷酸化 注:与同一时间对照组相比,at=3.67、4.13、4.89,P<0.05;bt=5.57、13.65、12.47,P<0.05 Figure 2 Effect of HBXIP on phosphorylation of STAT3 protein at Y705 in irradiated MDA-MB-231 cells A. Overexpression of HBXIP significantly improved STAT3(Y705) expression in irradiated MDA-MB-231 cells;B. si-RNA-mediated depletion of HBXIP expression markedly reduced STAT3(Y705) expression in irradiated MDA-MB-231 cells |
3. STAT3(Y705)磷酸化在HBXIP调节辐射诱导细胞自噬中的作用: 结果见图 3。与单纯照射的对照组相比,MDA-MB-231细胞同时转染了si-STAT3和pCMV-HBXIP质粒的细胞中STAT3蛋白表达水平明显减少,同时4 Gy γ射线照射诱导的STAT3(Y705)磷酸化水平增加也明显受到了抑制。与单独转染pCMV-HBXIP质粒的细胞相比,同时转染了si-STAT3和pCMV-HBXIP质粒的细胞中LC3-I明显增加,而LC3-Ⅱ蛋白的表达并不显现降低。与对照组相比,高表达HBXIP明显降低了辐照诱导的AOVs,即含有AOVs的细胞数明显减少(t=3.67、4.13、4.89,P<0.05),且出现时间依赖性;而过表达HBXIP同时敲降STAT3表达明显增加了辐照诱导的AOVs,即含有AOVs的细胞数显著增多(t=5.57、13.65、12.47,P<0.05)。以上结果表明,STAT3(Y705)磷酸化对于HBXIP调节辐射诱导的细胞自噬有着至关重要的作用。
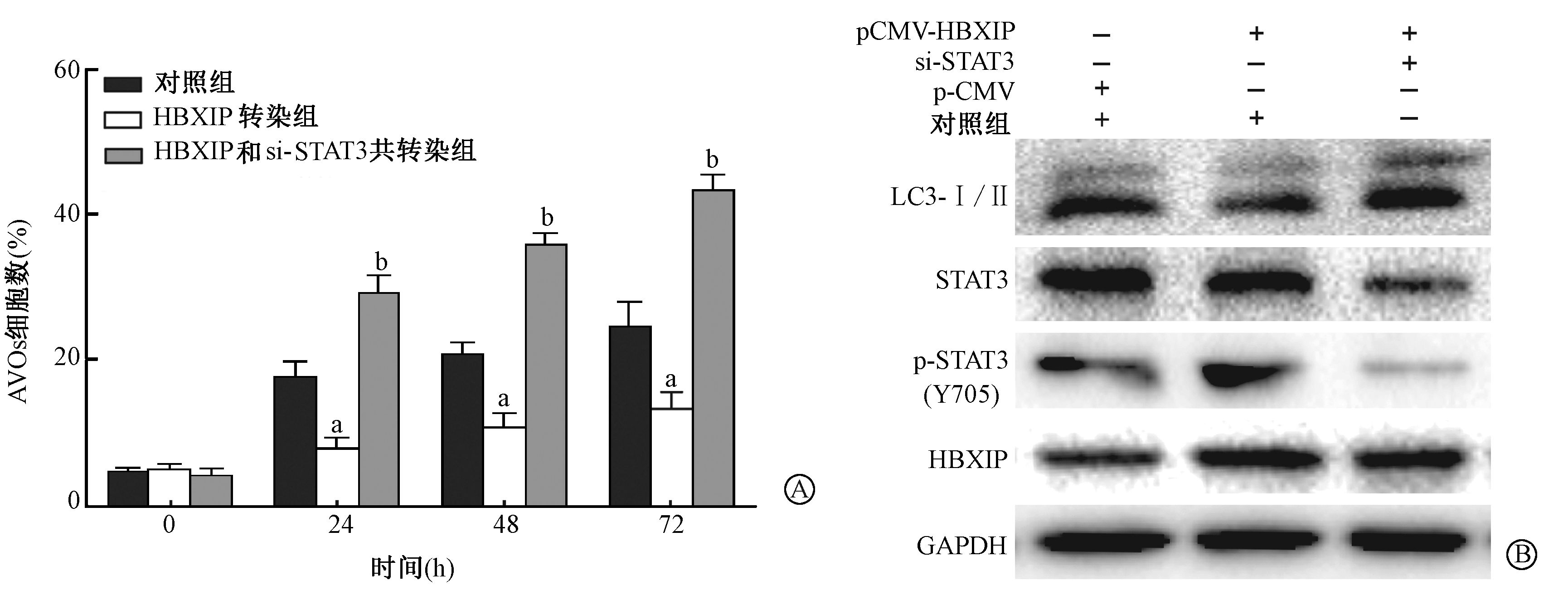
|
图 3 STAT3降低HBXIP对辐射诱导的MDA-MB-231细胞自噬的影响 A.干扰STAT3表达增加辐射诱导MDA-MB-231细胞AVOs的形成;B.干扰STAT3表达增加辐射诱导MDA-MB-231细胞中LC3-Ⅰ/Ⅱ蛋白的表达 Figure 3 STAT3 knock-down reduce the effect on HBXIP regulation of radiation-caused MDA-MB-231 cells autophagy A. si-RNA-mediated depletion of STAT3 expression significantly improved the increase of AVOs formation in irradiated MDA-MB-231 cells;B. si-RNA-mediated depletion of STAT3 expression significantly increased LC3-Ⅰ/Ⅱ protein expression in irradiated MDA-MB-231 cells |
讨 论
自噬在肿瘤的治疗过程中扮演着双重角色[11]。一方面,自噬通过维持肿瘤细胞中营养和能量平衡、清除融合蛋白和损伤的细胞器发挥细胞保护作用。一旦这种具有保护机制的自噬过程得到抑制,肿瘤细胞对电离辐射的敏感性就会增强。例如,利用3-甲基腺嘌呤抑制电离辐射诱导的乳腺癌细胞自噬能够显著提高乳腺癌细胞对电离辐射的敏感性[12]。另一方面,持续性过度自噬被称为Ⅱ型程序性细胞死亡[13]。过度自噬可以用来解释辐射诱导的细胞凋亡或坏死等细胞毒效应。研究表明,自噬在肿瘤细胞的电离辐射效应过程中也起到了关键的作用[8]。细胞发生自噬的主要特征是细胞中嗜酸性自噬体的形成。
HBXIP作为转录辅激活子在乳腺癌的发生和发展过程中起着非常重要的作用[8]。在乳腺癌细胞中HBXIP可以与NF-κB相互作用,提高乳腺癌细胞中NF-κB的磷酸化水平,促进肿瘤细胞的生长[14]。然而,HBXIP对乳腺癌细胞电离辐射敏感性的影响至今未见报道。本研究结果表明,乳腺癌细胞中HBXIP表达水平的提高明显抑制了辐射诱导的细胞自噬,相反细胞中HBXIP表达水平的降低则增加了辐射诱导的细胞自噬,这仅体现在含有AOVs数量的改变,同时也体现在与自噬应该的LC3-Ⅰ/Ⅱ蛋白表达水平的相应改变。这些结果都提示HBXIP可能通过抑制辐射诱导的癌细胞自噬来调节乳腺癌细胞的放射敏感性。
STAT3是一种能够将细胞外信号通过细胞表面磷酸化受体传递到细胞内的潜在转录因子[15]。705位酪氨酸被磷酸化对于STAT3转录活性至关重要[16]。近来研究表明,STAT3参与调节外界应激(如缺氧、营养不良、放化疗等)导致的乳腺细胞自噬[8]。本研究首次发现,外源性过表达HBXIP的乳腺癌细胞中辐射诱导的p-STAT3(Y705)的表达量明显升高,而siRNA降低HBXIP的乳腺癌细胞中辐射诱导的STAT3(Y705)磷酸化的表达量明显减少。另外,在外源性过表达HBXIP的乳腺癌细胞系中,辐射诱导的乳腺癌自噬明显受到抑制;而在过表达HBXIP同时降低STAT3表达的乳腺癌细胞系中,辐射诱导的乳腺癌细胞自噬明显增强。因此,HBXIP可能通过调节乳腺癌细胞中p-STAT3(Y705)的表达,进而抑制辐射诱导的乳腺癌细胞自噬产生。
放疗是肿瘤治疗的重要方法之一,但是在放疗过程中,许多肿瘤细胞会产生辐射耐受,影响放疗的疗效。因此,明确肿瘤细胞产生辐射耐受的机制,有利于提高肿瘤的辐射敏感性的药物开发。本研究表明,HBXIP通过调节STAT3磷酸化抑制辐射诱导的乳腺癌细胞自噬,从而影响乳腺癌细胞的放射敏感性和放疗疗效。因此,HBXIP作为一种影响乳腺癌细胞自噬的新靶点,对其开展深入研究,将为提高乳腺癌放疗疗效提供新的研究思路和方向。
利益冲突 本人与本人家属、其他研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 储小飞设计研究方案,进行实验,收集数据后统计并起草论文;薛晓蕾、赵舒怡、郑啔盛提供实验方法,协助进行实验操作;樊赛军指导实验思路,修改论文
| [1] | Jemal A, Siegel R, Xu J, et al. Cancer statistics, 2010[J]. CA Cancer J Clin , 2010, 60 (5) : 277-300 DOI:10.3322/caac.20073 |
| [2] | Akiyama Y, Iwaya T, Shioi Y, et al. Successfully treated advanced esophageal cancer with left axillary lymph node metastasis and synchronous right breast cancer:a case report[J]. Surg Case Rep , 2015, 1 (1) : 94 DOI:10.1186/s40792-015-0102-9 |
| [3] | Mizushima N, Komatsu M. Autophagy:renovation of cells and tissues[J]. Cell , 2011, 147 (4) : 728-741 DOI:10.1016/j.cell.2011.10.026 |
| [4] | Melegari M, Scaglioni PP, Wands JR. Cloning and characterization of a novel hepatitis B virus x binding protein that inhibits viral replication[J]. J Virol , 1998, 72 (3) : 1737-1743 |
| [5] | Kolev M, Dimeloe S, Le FG, et al. Complement regulates nutrient influx and metabolic reprogramming during Th1 cell responses[J]. Immunity , 2015, 42 (6) : 1033-1047 DOI:10.1016/j.immuni.2015.05.024 |
| [6] | Shi H, Li Y, Feng G, et al. The oncoprotein HBXIP up-regulates FGF4 through activating transcriptional factor Sp1 to promote the migration of breast cancer cells[J]. Biochem Biophys Res Commun , 2016, 471 (1) : 89-94 DOI:10.1016/j.bbrc.2016.01.174 |
| [7] | Wang Y, Cui M, Cai X, et al. The oncoprotein HBXIP up-regulates SCG3 through modulating E2F1 and miR-509-3p in hepatoma cells[J]. Cancer Lett , 2014, 352 (2) : 169-178 DOI:10.1016/j.canlet.2014.05.007 |
| [8] | You L, Wang Z, Li H, et al. The role of STAT3 in autophagy[J]. Autophagy , 2015, 11 (5) : 729-739 DOI:10.1080/15548627.2015.1017192 |
| [9] | Baehrecke EH. Autophagy:dual roles in life and death?[J]. Nat Rev Mol Cell Biol , 2005, 6 (6) : 505-510 DOI:10.1038/nrm1666 |
| [10] | Marotta LL, Almendro V, Marusyk A, et al. The JAK2/STAT3 signaling pathway is required for growth of CD44+CD24- stem cell-like breast cancer cells in human tumors[J]. J Clin Invest , 2011, 121 (7) : 2723-2735 DOI:10.1172/JCI44745 |
| [11] | Palumbo S, Comincini S. Autophagy and ionizing radiation in tumors:the "survive or not survive" dilemma[J]. J Cell Physiol , 2013, 228 (1) : 1-8 DOI:10.1002/jcp.24118 |
| [12] | Ito H, Daido S, Kanzawa T, et al. Radiation-induced autophagy is associated with LC3 and its inhibition sensitizes malignant glioma cells[J]. Int J Oncol , 2005, 26 (5) : 1401-1410 |
| [13] | Scott RC, Juhász G, Neufeld TP. Direct induction of autophagy by Atg1 inhibits cell growth and induces apoptotic cell death[J]. Curr Biol , 2007, 17 (1) : 1-11 DOI:10.1016/j.cub.2006.10.053 |
| [14] | Chaachouay H, Fehrenbacher B, Toulany M, et al. AMPK-independent autophagy promotes radioresistance of human tumor cells under clinical relevant hypoxia in vitro[J]. Radiother Oncol , 2015, 116 (3) : 409-416 DOI:10.1016/j.radonc.2015.08.012 |
| [15] | Levy DE, Darnell JE. Stats:transcriptional control and biological impact[J]. Nat Rev Mol Cell Biol , 2002, 3 (9) : 651-662 DOI:10.1038/nrm909 |
| [16] | van Soest RJ, de Morrée ES, Kweldam CF, et al. Targeting the androgen receptor confers in vivo cross-resistance between enzalutamide and docetaxel, but not cabazitaxel, in castration-resistant prostate cancer[J]. Eur Urol , 2015, 67 (6) : 981-985 DOI:10.1016/j.eururo.2014.11.033 |
 2016, Vol. 36
2016, Vol. 36


