随着核技术在军用和民用领域的广泛应用,核辐射事故时有发生,使急性放射病患者数量不断增加。紧急实施单倍体异基因造血干细胞移植可以迅速为重度骨髓型放射病患者提供合适供者,提高救治的成功率和延长患者的生存时间。但是单倍体相合造血干细胞移植风险大,移植失败和移植物抗宿主病(graft-versus-host disease,GVHD)是主要的制约因素。因此,有必要采用积极的手段降低GVHD发生率,保证移植成功。间充质干细胞(mesenchymal stem cell, MSC)是具有自我复制能力和多向分化潜能的成体干细胞,广泛来源于骨髓、脐带、脐血、真皮、脂肪等组织,已用于多种疾病的临床治疗研究[1]。Friedenstein等[2]成功分离出骨髓间充质干细胞(bone marrow derived mesenchymal stem cell, BMSC),BMSC是造血微环境的重要组成成分,具有多向分化潜能[3]、支持造血和促进造血干细胞植入、免疫调节等作用。本研究以急性骨髓型放射病小鼠模型为研究对象, 探讨BMSC联合单倍体相合造血干细胞移植对造血重建及GVHD的影响。
材料与方法1.实验动物:60只SFP级C57BL/6 (H-2b)与BALB/c (H-2d)杂交第1代[CB6F1(H-2b×d)]小鼠,6~8周龄, 体重18~22 g, 购自第三军医大学实验动物中心,动物质量合格证号SCXK(渝)2012-0002。所有动物均接受60Co γ射线8.0 Gy全身辐照(100 cGy /min),给予无菌饮食饲料饲养新桥医院动物中心,实验动物饲养设施合格证号SYXK(渝)2012-0011。
2.人骨髓血标本来源:骨髓取自本院血液科2015年3月—6月10名门诊骨髓检查无异常者,采集2~4 ml /人份(肝素抗凝)。所有标本采集均获患者本人及家属同意,并签署了知情同意书,该实验经本医院伦理委员会批准。
3.主要仪器设备与试剂:SFP级动物培养室(本院动物实验中心); CO2培养箱(SHELD2M 2300型,美国Becton Dickinson公司); 全血细胞分析仪(XS-800i,日本Sysmex公司)。胎牛血清(FBS)(16000-044,美国GIBCO公司,-20℃冻存备用),培养基α-MEM、PBS(SH30265、SH30256,均购自美国Hyclone公司); 成纤维细胞生长因子(BFGF)(10 ng/ml,13256-029,美国GIBCO公司)。
4. BMSC的分离培养:人BMSC的分离培养和鉴定按文献[4]进行。
5.单倍体相合造血干细胞制备:供体鼠C57BL/6 (H-2b)引颈脱臼处死后75%乙醇浸泡10 min,取股骨和胫骨,用PBS溶液冲出骨髓,制备单倍体相合造血干细胞悬夜,计数有核细胞的数量。
6.实验分组:按照完全随机设计分为照射对照组、单移植组和共移植组,每组20只。受者SPF级F1代小鼠经 60Co γ射线8.0 Gy全身照射后4 h之内,共移植组小鼠尾静脉注射200 μl供体C57BL/6 (H-2b)小鼠单倍体相合造血干细胞和BMSC混悬液,其中HSC 1×106个,BMSC 1×106个。单移植组小鼠尾静脉注射200 μl单倍体相合造血干细胞1×106个。照射对照组尾静脉注射200 μl生理盐水。每组10只用于生存期及GVHD观察,10只用于病理及其他相关指标检测。
7.小鼠一般情况及GVHD观察:每天动态观察小鼠有无体重下降、弓背、腹泻、耸毛等,并进行GVHD评分,由体重下降、活动度、姿势、耸毛和皮肤溃疡5项评分相加组成。体重下降<10%为0分,下降10%~25%为1分,下降>25%为2分。其余4项都有3个等级:0=正常,1=轻、中度,2=重度。每只小鼠GVHD评分总计0~10分,最高分为10分[5]。
8.小鼠生存期观察:每天观察小鼠的生存情况,存活超过30 d为长期生存,记录小鼠的生存时间和生存率。病理学检查:观察移植后14 d小鼠肝脏、小肠和皮肤的组织病理学改变。
9.外周血象及骨髓病理变化:各移植组分别于移植后第1、3、5、7、10、14、21、28天分别取5只小鼠断尾后取外周血20 μl/只,加入180 μl稀释液中, 以血细胞分析仪检测WBC、PLT、RBC和Hb水平。移植后第1、7、14、21、28天各组分别脱颈处死小鼠1只, 观察骨髓组织病理学改变。
10.骨髓细胞集落CFU-E、BFU-E、CFU-GM、CFU-GMEM培养:各组分别于移植后第7、14、28天取3只小鼠脱颈处死后取股骨,PBS溶液冲出骨髓后,RBC裂解液裂解成熟的RBC,计数有核细胞数量并将其密度调成2×106/ml、5×105/ml、2×105/ml 3种浓度。各取0.3 ml细胞悬夜分别与3 ml M3334、M3436、M3434培养基混匀后加入35 mm的培养皿。每种浓度细胞加入3个培养皿放置于37℃、5%CO2培养箱培养,分别于培养的第2和10天倒置显微镜观察集落数量。
11.统计学处理:实验结果以[AKx-D]±s表示。采用SPSS 18.0软件分析。组间比较采用单因素方差分析。P<0. 05为差异有统计学意义。
结果1. GVHD体征表现和生存分析:照射对照组小鼠第3天出现精神状态不佳、活动力减弱、腹泻、体重下降等GVHD现象,第5天出现弓背耸毛现象,对刺激反应减弱,之后GVHD症状逐渐加重,于受照后第10天全部死亡,平均生存时间为(7.13±0.31)d;单移植组小鼠在移植后第3天出现活动减少、腹泻、体重下降现象,第7天出现精神状态不佳、弓背耸毛现象,第14天出现活动增加, 反应灵敏, 进食及饮水量逐渐增加, 体重开始恢复,GVHD的症状逐渐减轻;共移植组小鼠也出现同样GVHD症状,但与单移植组相比明显减轻。移植后第28天,两组GVHD症状明显减轻。与单移植组相比,各时向点共移植组小鼠的GVHD评分明显降低(t=3.677、4.330、5.303、3.578,P < 0.05)。单移植组小鼠存活率为68.33%±2.89%,平均生存时间为(23.47±1.19) d。共移植组小鼠存活率为86.67%±2.89%,平均生存时间为(27.53±0.65)d。与单移植组相比,共移植组小鼠生存率和生存时间均明显提高(t=3.317、5.183,P < 0.05), 见表 1,2。
|
|
表 1 小鼠移植后不同时间GVHD评分(分,x±s) Table 1 GVHD score at different time after cell transplantation in mice(score, x±s) |
|
|
表 2 小鼠的生存率和生存时间(x±s) Table 2 The survival rate and survival time of mice(x±s) |
2.外周血象的变化:结果见图 1。单移植组小鼠WBC、PLT、RBC、Hb分别于移植后第5、10、14和14天降至最低。随后缓慢回升,至移植后第28天,WBC(6.51±1.38)×109/L、PLT(749.56±190.72)×109/L、RBC(8.15±0.74)×1012/L、Hb(115±10.44)g/L,回升程度低于正常水平。共移植组小鼠WBC、PLT、RBC、Hb分别于移植后第7、10、14和14天降至最低。随后迅速回升,至移植后第28天,WBC(12.50±2.07)×109/L、PLT(968.25±216.62)×109/L、RBC(9.22±1.04)×1012/L、Hb(137.57±14.89)g/L,回升程度接近正常水平。单移植组小鼠WBC、PLT、RBC、Hb的回升速度和恢复水平明显低于共移植组(t=6.665、3.164、3.011、2.520,P < 0.05)。
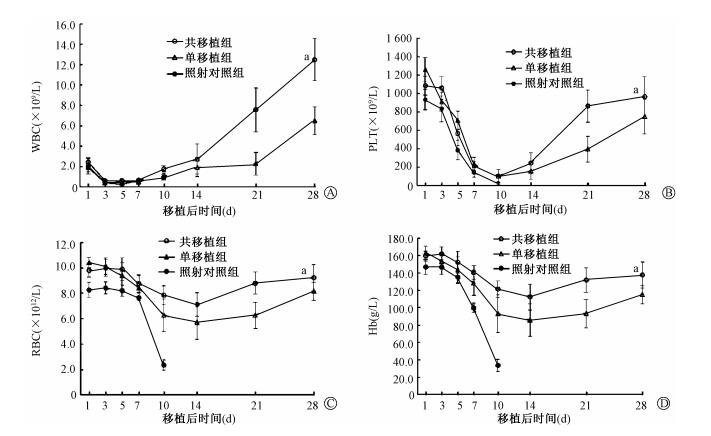
|
图 1 移植后小鼠外周血WBC、PLT、RBC、Hb的变化 Figure 1 The changes of the peripheral blood WBC, PLT, RBC and Hb in mice after transplantation |
3.骨髓病理组织学观察:结果见图 2。移植后第7天, 单移植组骨髓造血组织急剧减少, 骨小梁断裂, 纤维组织增生, 出现严重造血衰竭; 共移植组造血抑制程度较单移植组轻, 仍可见部分残存骨髓, 髓窦充血淤血, 脂肪细胞充塞。第28天, 单移植组和共移植组骨髓有核细胞增生活跃、比例增加, 共移植组有核细胞密布骨髓腔,恢复程度好于单移植组。
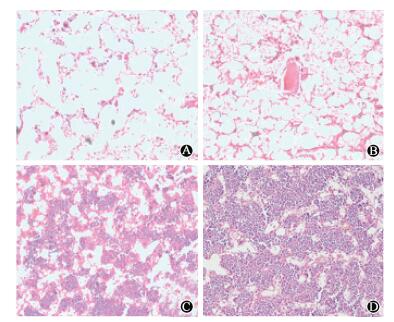
|
图 2 小鼠移植后不同时间骨髓组织病理HE染色×200 A.单移植组7 d;B.共移植组7 d;C.单移植组28 d;D.共移植组28 d Figure 2 Pathological changes of bone marrow at different time after transplantation in mice HE staining ×200 A. 7th day after single transplantation; B. 7th day after co-transplantation; C. 28th day after single transplantation; D. 28th day after co-transplantation. |
4.移植后小鼠肝脏、皮肤、小肠的病理组织学改变:移植后14 d单移植组肝脏汇管区肝静脉扩张,淋巴细胞浸润,肝细胞水肿出现点状坏死(图 3A);皮肤增厚,散在淋巴细胞浸润(图 3B);小肠绒毛断裂,隐窝部位充血水肿,黏膜下层水肿、散在淋巴细胞浸润(图 3C)。共移植组上述病变减轻明显。
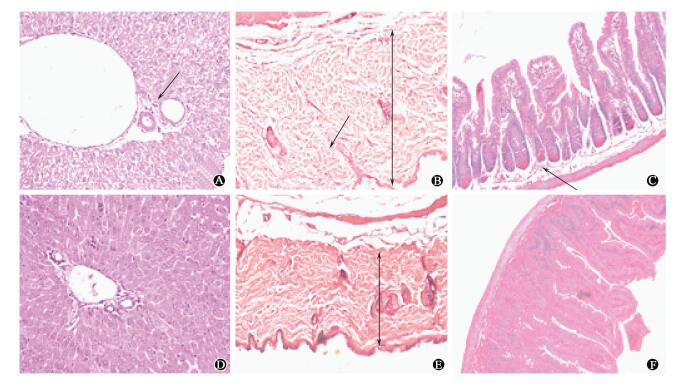
|
图 3 移植后14 d小鼠肝脏、皮肤和小肠组织病理变化HE染色×200 A.单移植组肝脏;B.单移植组皮肤;C.单移植组小肠;D.共移植组肝脏;E.共移植组皮肤;F.共移植组小肠 注:图中箭头所指为淋巴细胞 Figure 3 Pathological changes of liver, skin and small intestine of mice after 14 days of transplantation HE staining ×200 A. Liver of single transplantation group; B. Skin of single transplantation group; C. Small intestine of single transplantation group; D. Liver of co-transplantation group; E. Skin of co-transplantation group; F. Small intestine of co-transplantation group |
5.骨髓细胞集落培养:结果见表 3。移植后第7天,单移植组CFU-E、BFU-E、CFU-GM、CFU-GEMM集落数均明显低于共移植组(t=3.625、2.966、3.020、3.536,P < 0.05)。第28天,两组各细胞集落数量均明显增加,与外周血象变化趋势一致,共移植组细胞集落数量多于单移植组(t=4.369、4.849、5.044、4.243,P < 0.05)。
|
|
表 3 移植后不同时间小鼠CFU-E、BFU-E、CFU-GM、CFU-GEMM集落数量(x±s) Table 3 The number of CFU-E, BFU-E, CFU-GM, and CFU-GEMM colony of mice at different time after transplantation (x±s) |
讨论
造血系统对辐射高度敏感,造血损伤是骨髓型放射病的特征。对于重度骨髓型放射病而言,辐射后尽快进行异基因造血干细胞移植是唯一治愈的根本方法,而尽快找到合适供着进行抢救性移植亦是治疗本病的关键,因此,单倍体造血干细胞移植是治疗骨髓型放射病的重要手段。但是,由于HLA配型不合,移植排斥机率高、程度重、致死性感染机会高从而使得移植相关死亡率高达40%~50%[6]。前期研究发现,患者造血微环境的损伤程度与移植后的造血重建能力和稳定程度密切相关,也是影响造血干细胞移植成败的重要制约因素,辐射所致造血微环境损伤导致的造血功能衰竭更加持久甚至难以恢复。因此,亟待寻找较为可靠的移植治疗方法,以提高移植成功率和生存率,同时降低并发症。
间充质干细胞是属于中胚层的一类多能干细胞,主要存在于结缔组织和器官间质中,以骨髓组织中含量最为丰富[7]。骨髓间充质干细胞是造血微环境的重要组成成分,在体外易于分离培养,并能保持其多向分化潜能,遗传背景稳定。由于BMSC属于未分化的前体干细胞,其细胞表型的分化尚不成熟[8],因此,BMSC可被作为造血干细胞移植中较理想的辅助细胞。
既往研究表明,间充质干细胞具有促进造血重建和调控GVHD的作用[9]。因此,在单倍体造血干细胞移植的同时联合输注BMSC,是为了从改善造血微环境功能和调控免疫角度来解决HLA单倍型造血干细胞移植中的问题。选择C57BL/6(H2b)作为供体、C57BL/6(H-2b)与BALB/c(H-2d)杂交第1代[CB6F1(H-2b×d)]作为受体, 构建单倍体相合造血干细胞移植模型, 同时输注BMSC, 观察其对受体小鼠造血重建和GVHD的影响。本研究采用8.0 Gy剂量辐照F1代小鼠,构建了急性骨髓型放射病小鼠模型。结果表明,照射对照组小鼠辐照后造血功能逐渐衰竭并很快死亡,而移植组小鼠大部分成活,可见急性骨髓型放射病移植模型是构建成功的。共移植组小鼠的生存率和生存时间明显高于单移植组,BMSC可见BMSC提高了小鼠的存活率并延长了生存时间。共移植组表现出造血重建的速度和水平明显高于单移植组,移植后CFU-E、BFU-E、CFU-CM、CFU-GEMM集落数量多于单移植组,GVHD评分低于单移植组,说明BMSC联合输注改善了造血重建的效果。本课题组的前期研究结果表明,在辐射损伤的动物模型中输注脐血源基质细胞可修复造血微环境的结构和功能,促进辐射诱导的造血损伤的恢复和造血干细胞的植入[10-11]。BMSC输注后也可通过修复辐射损伤的造血微环境结构和功能,促进造血干细胞的归巢和造血重建。
GVHD是由于移植物组织中的免疫活性细胞与组织不相融性抗原受者的组织之间的免疫反应。GVHD是单倍体异基因造血干细胞移植后主要并发症和死亡原因。MSC同时具有免疫调控作用,可通过抑制CD3+T淋巴细胞的活性和上调Treg细胞的数量,降低急性GVHD的发生[12]。Zhang等[13]实验证实,MSC通过抑制T淋巴细胞增殖同时增加NK细胞的数量以及上调IFN-γ和IL-4的表达,降低了急性GVHD的发生。MSC通过分泌TGF-β、PGE2、HGF、LIF、IDO、IL-10、IL-6、NO、HLA-G5、MMPs、CCL2、CCL5和HO-1等,调节T淋巴细胞、B淋巴细胞、DC细胞、NK细胞和巨噬细胞的增殖和活性,进而调节GVHD的发生[14-15]。其中MSC主要通过上调Treg细胞和致耐受性DC细胞的增殖和活性,抑制T淋巴细胞对刺激的反应,进而降低GVHD的发生[16-17]。因此,MSC可通过调节机体免疫细胞的比例和活性降低机体的免疫活性,从而降低GVHD的发生率。本研究结果也证实,MSC的联合输注有效降低了单倍体造血干细胞移植小鼠的GVHD发生程度,从而有利于对急性骨髓型放射病的应急救治。
实验结果证实,BMSC联合单倍体造血干细胞移植能促进骨髓型放射病造血重建及植入, 提高移植成功率, 降低异基因单倍体移植的排斥反应和死亡率,具有重要的临床应用价值。同时,有关MSC促进骨髓型放射病造血干细胞移植后造血重建和GVHD降低的具体免疫机制尚不十分明确;不同来源MSC之间的作用是否相同;MSC的输注方式和剂量的最佳化等问题依然需要回答,是以后进一步研究的方向。
利益冲突 文章全体作者无学术纷争,所写内容均中立客观,不存在任何利益冲突作者贡献声明 贾延辉负责动物模型的建立、实验操作及论文撰写修改,参与整个实验过程;邓怡和杨世杰负责动物饲养和观察GVHD表现;高蕾、刘耀、张诚、高力协助数据收集和统计分析;孔佩艳、陈幸华和张曦负责整体实验设计、论文撰写指导及修改
| [1] | Keyser KA, Beagles KE, Kiem HP. Comparison of mesenchymal stem cells from different tissues to suppress T-cell activation[J]. Cell Transplant , 2007, 16 (5) : 555-562 DOI:10.3727/000000007783464939 |
| [2] | Friedenstein AJ, Gorskaja JF, Kulagina NN. Fibroblast precursors in normal and irradiated mouse hematopoietic organs[J]. Exp Hematol , 1976, 4 (5) : 267-274 |
| [3] | Tan SL, Ahmad TS, Selvaratnam L, et al. Isolation, characterization and the multi-lineage differentiation potential of rabbit bone marrow-derived mesenchymal stem cells[J]. J Anat , 2013, 222 (4) : 437-450 DOI:10.1111/joa.12032 |
| [4] | Liu Y, Wen Q, Chen XL, et al. All-trans retinoic acid arrests cell cycle in leukemic bone marrow stromal cells by increasing intercellular communication through connexin 43-mediated gap junction[J]. J Hematol Oncol , 2015, 8 : 110 DOI:10.1186/s13045-015-0212-7 |
| [5] | Przepiorka D, Weisdorf D, Martin P, et al. 1994 consensus conference on acute GVHD grading[J]. Bone Marrow Trans , 1995, 15 (6) : 825-828 |
| [6] | Cutler C, Antin JH. An overview of hematopoietic stemcell transplantation[J]. Clin Chest Med , 2005, 26 (4) : 517-527 DOI:10.1016/j.ccm.2005.06.016 |
| [7] | Kfoury Y, Scadden DT. Mesenchymal cell contributions to the stem cell niche[J]. Cell Stem Cell , 2015, 16 (3) : 239-253 DOI:10.1016/j.stem.2015.02.019 |
| [8] | Uccelli A, Moretta L, Pistoia V. Mesenchymal stem cells in health and disease[J]. Nat Rev Immunol , 2008, 8 (9) : 726-736 DOI:10.1038/nri2395 |
| [9] | Nombela-Arrieta C, Ritz J, Silberstein LE. The elusive nature and function of mesenchymal stem cells[J]. Nat Rev Mol Cell Biol , 2011, 12 (2) : 126-131 DOI:10.1038/nrm3049 |
| [10] | Liu Y, Chen XH, Si YJ, et al. Reconstruction of hematopoietic inductive microenvironment after transplantation of VCAM-1-modified human umbilical cord blood stromal cells[J]. PLoS One , 2012, 7 (2) : e31741 DOI:10.1371/journal.pone.0031741 |
| [11] | Liu SS, Zhang C, Zhang X, et al. Human umbilical cord blood-derived stromal cells:A new source of stromal cells in hematopoietic stem cell transplantation[J]. Crit Rev Oncol Hematol , 2014, 90 (2) : 93-98 DOI:10.1016/j.critrevonc.2013.12.002 |
| [12] | Gao L, Liu F, Tan L, et al. The immunosuppressive properties of non-cultured dermal-derived mesenchymal stromal cells and the control of graft-versus-host disease[J]. Biomaterials , 2014, 35 (11) : 3582-3588 DOI:10.1016/j.biomaterials.2014.01.008 |
| [13] | Zhang C, Chen XH, Zhang X, et al. Human umbilical cord blood-derived stromal cells, a new resource in the suppression of acute graft-versus-host disease in haploidentical stem cell transplantation in sublethally irradiated mice[J]. J Biol Chem , 2011, 286 (15) : 13723-13732 DOI:10.1074/jbc.M110.144691 |
| [14] | Bassi ĚJ, de Almeida DC, Moraes-Vieira PM, et al. Exploring the role of soluble factors associated with immune regulatory properties of mesenchymal stem cells[J]. Stem Cell Rev , 2012, 8 (2) : 329-342 DOI:10.1007/s12015-011-9311-1 |
| [15] | English K, French A, Wood KJ. Mesenchymal stromalcells:facilitators of successful transplantation?[J]. Cell Stem Cell , 2010, 7 (4) : 431-442 DOI:10.1016/j.stem.2010.09.009 |
| [16] | Tian Y, Deng YB, Huang YJ, et al. Bone marrow-derived mesenchymal stem cells decrease acute graft-versus-host disease after allogeneic hematopoietic stem cells transplantation[J]. Immunol Invest , 2008, 37 (1) : 29-42 DOI:10.1080/08820130701410223 |
| [17] | Di IM, Falzetti F, Carotti A, et al. Tregs prevent GVHD and promote immune reconstitution in HLA-haploidentical transplantation[J]. Blood , 2011, 117 (14) : 3921-3928 DOI:10.1182/blood-2010-10-311894 |
 2016, Vol. 36
2016, Vol. 36


