在人类基因组序列中超过90%的序列能够被转录为RNA,仅有约2%的RNA能编码蛋白质,其余均为非编码 RNA(ncRNA)。其中大部分是长度大于200个核苷酸的长链非编码RNA(lncRNA)[1]。人长链基因间非编码RNA-p21(lincRNA-p21)位于细胞周期调节基因p21上游约15 kb处,包含2个外显子,长度约3.0 kb。研究证实,lincRNA-p21在多种类型的肿瘤中均表 达下调,能被细胞中DNA损伤信号激活[2]。目前研究发现,在乏氧环境中乏氧诱导因子-1α(HIF-1α)能诱导lincRNA-p21表 达,使lincRNA-p21参与调控乏氧肿瘤细胞的多种生物学功能,包括促进其糖酵解和Warburg效应[3]。本实验选取人肝癌和脑胶质瘤细胞系,研究lincRNA-p21的乏氧诱导表 达规律,探讨敲低 lincRNA-p21对乏氧肿瘤细胞放射敏感性的影响及其机制。
1. 细胞系:人肝癌细胞SMMC7721(p53野生型),人脑胶质瘤细胞U251MG(p53突变型),冻存。
2. 试剂:DMEM高糖培养基、PBS缓冲液购于美国Hyclone公司。胎牛血清购于兰州华烨生物有限公司。胰酶购于美国GIBCO公司。TRIzol试剂购于美国Invitrogen公司。合成cDNA试剂盒购于美国Thermo公司。实时荧光定量PCR(QRT-PCR)试剂盒购于上海吉玛制药技术有限公司。细胞周期检测试剂盒购于美国Vazyme公司。细胞凋亡检测试剂盒购于美国SouthernBiotech公司。兔抗人HIF-1α和GLUT1单克隆抗体和HRP标记的山羊抗兔IgG购于美国Santa Cruz公司。
3. 细胞培养:SMMC7721、U251MG细胞均用含10%胎牛血清的DMEM高糖培养基,常氧条件下在恒温37℃,5%CO2的培养箱中培养,乏氧条件下在恒温37℃,1%O2,5%CO2,94%N2的培养箱中培养。用0.25%的胰酶消化,2~3 d传代1次。
4. 照射条件:美国Rad Source公司RS-2000 Pro X射线照射机,剂量率为1.23 Gy/min,源靶距40 cm。经2、4、6、8 Gy剂量X射线照射,置于恒温37℃、5%CO2培养箱中培养。
5. 慢病毒载体构建:含lincRNA-p21 siRNA序列(5′ CTGCAAGGCCGCATGATGA 3′)的穿梭质粒和包装质粒(pGap/Pol、pRev、pVSV-G)由上海吉玛制药技术有限公司构建制备。接种293T细胞于15 cm培养皿中培养过夜,按比例加入穿梭质粒和包装质粒共转染293T细胞,6 h后弃去转染液,加入细胞培养液继续培养。收集转染后72 h的293T细胞上清液,于4℃、4 000×g离心4 min以去除细胞碎片,0.45 μm过滤器过滤后,25 000×g离心2 h,以预冷的PBS液重悬病毒沉淀,病毒液命名为LV-anti-lincRNA-p21,-80℃保存。病毒液10倍稀释3~5个梯度,转染293T细胞,荧光显微镜计数荧光细胞计算病毒滴度。
6. 稳定转染细胞克隆筛选:将细胞系SMMC7721、U251MG接种到24孔板中,待细胞融合率达到50%时,分别加入100和20 μl慢病毒原液,按终浓度5 μg/ml加入Polybrene试剂增强感染效率,置于37℃、5% CO2培养箱中培养。24 h后移去细胞浸染后的病毒液,加入完全培养液继续培养。感染72 h后可以观察到绿色荧光蛋白(GFP)。 以终浓度为1 μg/ml的嘌呤霉素对感染后的细胞系进行稳定转染筛选,待细胞贴满培养皿底即传代,持续4周。实验分两组,阴性对照组和转染组。
7. 实时荧光定量PCR实验:取对数生长期的细胞,用TRIzol试剂消化细胞并提取细胞总RNA,测定RNA浓度。用cDNA合成试剂盒将总RNA反转录成cDNA,反转录反应条件为25℃,5 min;42℃,60 min;70℃,5 min。用定量PCR试剂盒检测分析lincRNA-p21表 达变化情况。lincRNA-p21上游引物为5′ GGGTGGCTCACTCTTCTGGC 3′,下游引物为5′ TGGCCTTGCCCGGGCTTGTC 3′。内参GAPDH上游引物为5′ AGCCACATCGCTCAGACAC 3′,下游引物为5′ GCCCAATACGACCAAATCC 3′。定量PCR反应程序为95℃,3 min;95℃,12 s;62℃,40 s;40个循环。对照组目的基因表 达量为1,处理组目的基因相对表 达量用2-ΔΔt表 示。
8. 流式细胞仪检测细胞周期实验:取转染组和阴性对照组对数生长期细胞SMMC7721和U251MG,在乏氧(1%O2)条件下培养48 h。每管收集3×106细胞,用冷PBS洗涤后缓慢滴加1 ml冰冷的75%乙醇,静置于4℃固定过夜。上机前,4℃ 1 000×g 5 min离心收集细胞。冷PBS洗涤 细胞,400 μl冷PBS重悬细胞。加入20 μl RNase A溶液,37℃水浴30 min。400目筛网过滤,加入400 μl PI染液混匀,4℃避光孵育60 min。流式细胞仪检测细胞周期,每个实验组设3个平行样。
9. 流式细胞仪检测细胞凋亡实验:取转染组和阴性对照组对数生长期细胞,在乏氧(1%O2)条件下培养48 h。冷PBS洗涤细胞2次,每管收集5×105细胞于100 μl染色缓冲液中。加入10 μl Annexin V-PE混匀,冰上避光孵育15 min,加入380 μl染色缓冲液,10 μl 7-AAD。流式细胞仪检测细胞凋亡,每个实验组设3个平行样。
10. 克隆形成实验:取对数生长期细胞,分别接种2×102、4×102、4×102、1×103、2×103细胞到6孔板中,培养24 h后经0、2、4、6和8 Gy X射线照射,每组3个样本,照射后继续培养14 d,弃去培养液,PBS洗2次。每孔加2 ml甲醇固定15 min,吸去甲醇,加2 ml结晶紫溶液染色30 min。在水中轻漂去色,烘箱干燥30 min,显微镜下计数>50个细胞的克隆数。以每次实验的0 Gy组计算克隆形成率,克隆形成率(PE,%)=克隆数/接种细胞数×100%,存活分数(SF)=克隆数/接种细胞数×克隆形成率。在GraphPad Prism 5软件中使用多靶单击模型计算放射生物学参数并拟合剂量存活曲线。
11. Western blot检测蛋白表 达:乏氧培养48 h收获细胞,用单去污剂裂解法提取总蛋白,每个样品取30 μl进行SDS-PAGE电泳分离。电泳完成后,通过半干式转移电泳槽将凝胶中的蛋白转移到硝酸纤维素膜(NC)上。转移结束后,将NC膜在含3%脱脂奶粉的PBS中室温封闭2 h,用单克隆抗体进行杂交,洗膜,暗室曝光。
12. 统计学处理:数据用±s表 示。采用SPSS 19.0软件进行分析,两组间比较采用t检验。P<0.05为差异有统计学意义。
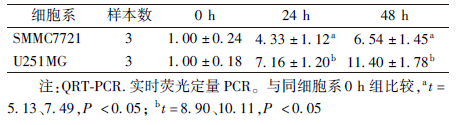
1. 乏氧促进lincRNA-p21的表 达:对数生长期细胞SMMC7721、U251MG在乏氧(1%O2)条件下培养24和48 h,经QRT-PCR检测lincRNA-p21相对表 达量,SMMC7721细胞24、48与0 h组相比,lincRNA-p21表 达明显升高(t=5.13、7.49,P<0.05)。U251MG细胞24、48与0 h组相比,lincRNA-p21表 达明显升高(t=8.90、10.11,P<0.05)。SMMC7721、U251MG细胞48与24 h组相比,lincRNA-p21表 达升高,但差异无统计学意义(P>0.05)。结果表 明,乏氧上调lincRNA-p21的表 达,且随乏氧培养时间逐渐增加(表 1)。
表 1 QRT-PCR检测乏氧不同时间lincRNA-p21
表 达的变化(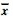 ±s)
Table 1 The expression of lincRNA-p21 detected by QRT-PCR at different time intervals of hypoxia treatment( ±s)
Table 1 The expression of lincRNA-p21 detected by QRT-PCR at different time intervals of hypoxia treatment(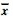 ±s) ±s) |
2. 稳定转染lincRNA-p21反义寡核苷酸下调乏氧肿瘤细胞中lincRNA-p21的表 达:稳定转染lincRNA-p21反义寡核苷酸敲低乏氧肿瘤细胞中lincRNA-p21,嘌呤霉素筛选4周后,2种细胞转染效率均达到90%以上,见图 1。转染组与阴性对照组对数生长期细胞SMMC7721、U251MG在乏氧条件下(1%O2)培养48 h,经QRT-PCR检测lincRNA-p21相对表 达量,SMMC7721、U251MG细胞转染组与阴性对照组相比,lincRNA-p21相对表 达量分别为0.076±0.011和0.055±0.005,表 达明显下调 (t=144.81、334.32,P<0.05)。结果表 明,稳定转染lincRNA-p21反义寡核苷酸能有效下调lincRNA-p21在乏氧肿瘤细胞中的表 达。
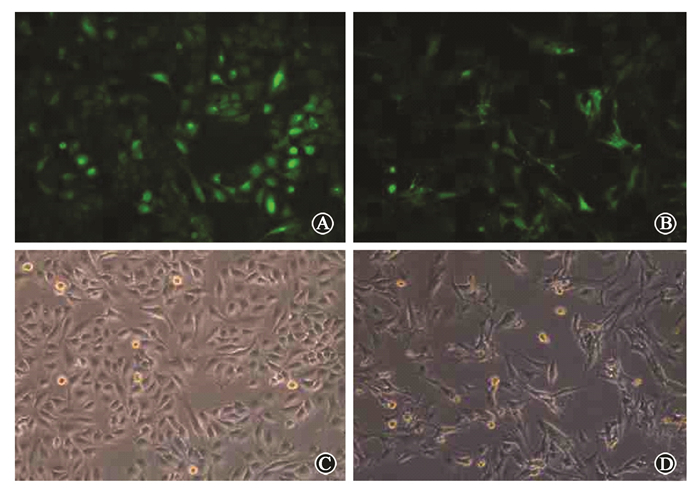
|
图 1 荧光显微镜下观察转染lincRNA-p21反义寡核苷酸96 h后肿瘤细胞转染效率 A. SMMC7721细胞绿色荧光;B. U251MG细胞绿色荧光;C. SMMC7721细胞明场;D. U251MG细胞明场 Figure 1 The efficiency of lincRNA-p21 antisense oligonucleo-tides transfer in tumor cells at 96 h after transfection A. SMMC7721 cells green fluorescence; B. U251MG cells green fluorescence; C. SMMC7721 cells bright-field; D. U251MG cells bright-field |
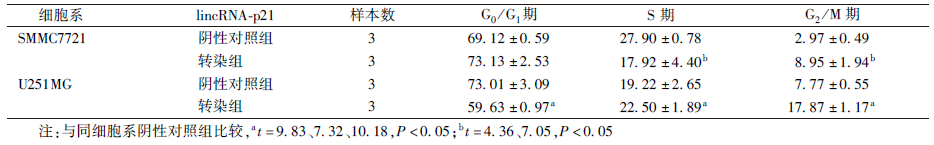
3. 敲低lincRNA-p21阻滞乏氧肿瘤细胞周期:转染组和阴性对照组对数生长期细胞SMMC7721、U251MG乏氧(1%O2)培养48 h,流式细胞仪检测细胞周期,G2/M期比例明显升高,差异有统计学意义(t=7.05、10.18,P<0.05)。说明敲低lincRNA-p21诱导细胞在G2/M期发生阻滞(表 2)。
表 2 敲低lincRNA-p21对乏氧肿瘤细胞的细胞周期影响(%,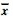 ±s)
Table 2 Effect of lincRNA-p21 knockdown on cell cycle arrest of hypoxic tumor cells(%, ±s)
Table 2 Effect of lincRNA-p21 knockdown on cell cycle arrest of hypoxic tumor cells(%, 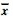 ±s) ±s) |
4. 敲低lincRNA-p21促进乏氧肿瘤细胞凋亡:用流式细胞术检测对数生长期细胞SMMC7721、U251MG乏氧(1%O2)培养48 h后,转染组和阴性对照组细胞凋亡情况。SMMC7721细胞阴性对照组和转染组细胞凋亡率为(1.27±0.05)%、(17.87±0.73)%;U251MG细胞阴性对照组和转染组细胞凋亡率为(1.96±0.59)%、(23.65±1.29)%,lincRNA-p21转染组凋亡率明显高于阴性对照组(t=42.27、24.79,P<0.05)。表 明敲低lincRNA-p21能够促进乏氧肿瘤细胞凋亡。
5. 敲低lincRNA-p21提高乏氧肿瘤细胞放射敏感性:克隆形成实验检测对数生长期细胞SMMC7721、U251MG乏氧(1%O2)培养48 h,经0、2、4、6、8 Gy X射线照射后,转染组和阴性对照组细胞放射敏感性的变化,采用多靶单击模型拟合细胞存活曲线,见图 2。lincRNA-p21转染组和阴性对照组细胞之间存活分数差异明显。乏氧SMMC7721转染组和阴性对照组细胞平均致死剂量值为2.77和3.40 Gy,乏氧U251MG转染组和阴性对照组细胞D0值为3.07和4.02 Gy,结果表 明,敲低lincRNA-p21能够提高乏氧肿瘤细胞放射敏感性,放射增敏比为1.23和1.31。
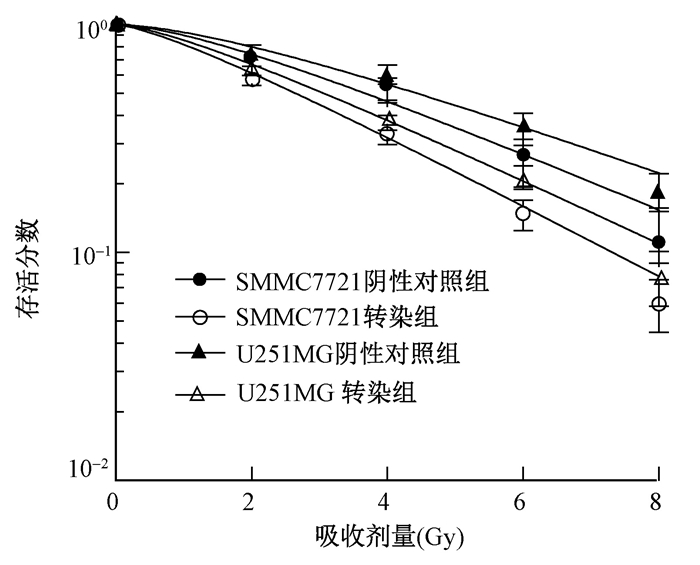
|
图 2 敲低lincRNA-p21对乏氧肿瘤细胞存活分数的影响 Figure 2 Effect of lincRNA-p21 knockdown on survival fraction of hypoxic tumor cells |
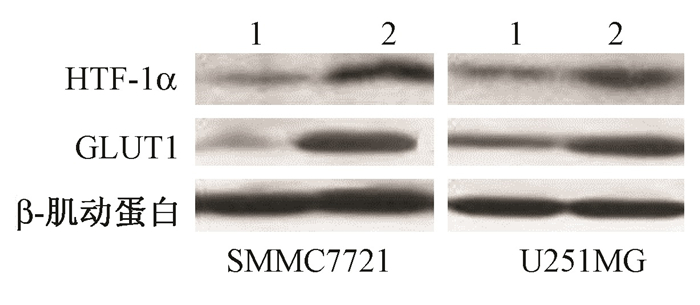
6. 敲低lincRNA-p21导致HIF-1α蛋白含量下降:乏氧(1%O2)培养细胞48 h,转染组HIF-1α 和GLUT1蛋白含量明显下降,表 明敲低lincRNA-p21能够降低乏氧肿瘤细胞HIF-1α和GLUT1蛋白含量(图 3)。
|
注:1.转染组;2.阴性对照组 图 3 细胞乏氧培养48 h后HIF-1α和GLUT1蛋白含量变化 Figure 3 The expressions of HIF-1α and GLUT1 in the tumor cells after 48 h of hypoxia culture |
实体肿瘤由于组织增生过快常发生局部缺氧,HIF-1α在乏氧环境中表 达上调[4],通过调控下游基因转录和蛋白表 达,影响肿瘤血管生成[5],肿瘤细胞增殖[6]、凋亡和能量代谢[7, 8],提高乏氧肿瘤细胞的辐射抗性[9]。lincRNA-p21参与多种人类疾病,特别是癌症的发生发展进程。本研究发现,lincRNA-p21是一种乏氧应答lincRNA,乏氧能提高lincRNA-p21表 达,且随着乏氧培养时间的延长而升高。同时建立稳定敲低lincRNA-p21的SMMC7721和U251MG细胞系,发现乏氧48 h后HIF-1α和GLUT1蛋白水平下降,表 明lincRNA-p21能够提高乏氧肿瘤细胞HIF-1α和GLUT1蛋白水平。肿瘤细胞表 现出氧化磷酸化减少和糖酵解增强的代谢特征,称为Warburg效应。Yang等[3]研究发现,lincRNA-p21通过调节HIF-1α通路对Warburg效应进行调控。常氧条件下HIF-1α脯氨酸羟基化后与 Von Hippel-Lindau(VHL) 结合,经泛素-蛋白酶体途径降解[10]。而乏氧条件下lincRNA-p21分别结合HIF-1α和VHL,干扰了VHL与HIF-1α之间的相互作用,减缓HIF-1α泛素化及随后的降解,从而稳定HIF-1α蛋白水平,HIF-1α反过来诱导lincRNA-p21表 达,从而形成一个正反馈环路。同时,证实了HIF-1α-lincRNA-p21环路会促进肿瘤形成。因此,lincRNA-p21可以作为一种药物靶点应用于癌症治疗中。
但是,在常氧条件下,Wang等[11]研究发现,过表 达lincRNA-p21通过抑制β-catenin信号通路和升高促凋亡基因Noxa的表 达来提高常氧结直肠癌(CRC)细胞的放射敏感性。根据lincRNA-p21的乏氧诱导特性,为探讨lincRNA-p21对乏氧肿瘤细胞放射敏感性的影响,本研究建立稳定敲低lincRNA-p21的SMMC7721和U251MG细胞系,发现在乏氧环境中敲低lincRNA-p21可提高乏氧肿瘤细胞放射敏感性,其机制可能与敲低lincRNA-p21诱导细胞G2/M期阻滞和细胞凋亡,并导致HIF-1α蛋白水平下降有关。
Dimitrova等[12]发现,小鼠lincRNA-p21将核不均一的核糖核蛋白K(hnRNP-K)聚集到p21启动子,使p53与p21启动子有效结合来启动p21转录,激活p21表 达。并证实lincRNA-p21缺失可以降低p21的表 达并促进小鼠胚胎成纤维细胞(MEF)的增殖。然而,Huarte等[2]和Bao等[13]在MEF中敲低lincRNA-p21后没有发现p21表 达降低。故小鼠lincRNA-p21对p21的调控作用尚存争议。而人lincRNA-p21是否参与调控p21基因,以及人lincRNA-p21对乏氧肿瘤细胞放射敏感性调控的分子机制,需要进一步深入研究。
利益冲突 沈月明、杨巍所投稿的研究成果由国家自然科学基金面上项目(81071958,31570851);江苏高校优势学科建设工程资助项目(PAPD)资助,之间没有可能影响研究结果的财务关系。且作者的配偶、工作伙伴和子女没有可能影响研究结果的财务关系。沈月明、杨巍没有可能影响研究结果的非财务冲突关系
作者贡献声明 沈月明负责进行试验、整理数据、论文撰写;杨巍负责提出研究思路、设计研究方案、分析数据和论文修改
| [1] | Esteller M. Non-coding RNAs in human disease[J]. Nat Rev Genet, 2011, 12(12): 861-874. DOI: 10.1038/nrg3074. |
| [2] | Huarte M, Guttman M, Feldser D, et al. A large intergenic noncoding RNA induced by p53 mediates global gene repression in the p53 response[J]. Cell, 2010, 142(3): 409-419. DOI: 10.1016/j.cell.2010.06.040. |
| [3] | Yang F, Zhang H, Mei Y, et al. Reciprocal regulation of HIF-1α and lincRNA-p21 modulates the Warburg effect[J]. Mol Cell, 2014, 53(1): 88-100. DOI: 10.1016/j.molcel.2013.11.004. |
| [4] | Unruh A, Ressel A, Mohamed HG, et al. The hypoxia-inducible factor-1 alpha is a negative factor for tumor therapy[J]. Oncogene, 2003, 22(21): 3213-3220. DOI: 10.1038/sj.onc.1206385. |
| [5] | Lee K, Qian DZ, Rey S, et al. Anthracycline chemotherapy inhibits HIF-1 transcriptional activity and tumor-induced mobilization of circulating angiogenic cells[J]. Proc Natl Acad Sci USA, 2009, 106(7): 2353-2358. DOI: 10.1073/pnas.0812801106. |
| [6] | Goda N, Ryan HE, Khadivi B, et al. Hypoxia-inducible factor 1alpha is essential for cell cycle arrest during hypoxia[J]. Mol Cell Biol, 2003, 23(1): 359-369. DOI: 10.1128/MCB.23.1.359-369.2003. |
| [7] | Kapitsinou PP, Haase VH. The VHL tumor suppressor and HIF: insights from genetic studies in mice[J]. Cell Death Differ, 2008, 15(4): 650-659. DOI: 10.1038/sj.cdd.4402313. |
| [8] | Moeller BJ, Dreher MR, Rabbani ZN, et al. Pleiotropic effects of HIF-1 blockade on tumor radiosensitivity[J]. Cancer Cell, 2005, 8(2): 99-110. DOI: 10.1016/j.ccr.2005.06.016. |
| [9] | Williams KJ, Telfer BA, Xenaki D, et al. Enhanced response to radiotherapy in tumours deficient in the function of hypoxia-inducible factor-1[J]. Radiother Oncol, 2005, 75(1): 89-98. DOI: 10.1016/j.radonc.2005.01.009. |
| [10] | Maxwell PH, Wiesener MS, Chang GW, et al. The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis[J]. Nature, 1999, 399(6733): 271-275. DOI: 10.1038/20459. |
| [11] | Wang G, Li Z, Zhao Q, et al. LincRNA-p21 enhances the sensitivity of radiotherapy for human colorectal cancer by targeting the Wnt/β-catenin signaling pathway[J]. Oncol Rep, 2014, 31(4): 1839-1845. DOI: 10.3892/or.2014.3047. |
| [12] | Dimitrova N, Zamudio JR, Jong RM, et al. LincRNA-p21 activates p21 in cis to promote polycomb target gene expression and to enforce the G\-1/S checkpoint[J]. Mol Cell, 2014, 54(5): 777-790. DOI: 10.1016/j.molcel.2014.04.025. |
| [13] | Bao X, Wu H, Zhu X, et al. The p53-induced lincRNA-p21 derails somatic cell reprogramming by sustaining H3K9me3 and CpG methylation at pluripotency gene promoters[J]. Cell Res, 2015, 25(1): 80-92. DOI: 10.1038/cr.2014.165. |
 2016, Vol. 36
2016, Vol. 36