目前,人类免疫缺陷病毒(HIV)阳性的人群逐渐增多。高效抗反转录病毒疗法(HAART)的应用,使HIV患者生存期延长、死亡率有所下降[1],HIV阳性患者后期极易发生肿瘤[2, 3, 4]。HIV阳性恶性肿瘤患者的放射治疗面临两个问题:HIV阳性恶性肿瘤患者能否放疗,是否有循证医学支持;放疗期间急性不良反应如何,患者能否耐受。国外学者尝试对HIV阳性恶性肿瘤患者行放疗,结果认为可行,但发现放疗反应重。Simonds等[5]首次报道了HIV阳性恶性肿瘤患者放疗的分组对照研究,结果显示,HIV阳性恶性肿瘤患者较HIV阴性患者完成放疗数明显低。国内HIV阳性的恶性肿瘤的放疗病例报道较少。本研究对本院14例HIV阳性恶性肿瘤患者放射治疗的情况进行回顾,并对放疗的急性反应做分析总结。
1. 临床资料:选取2008年2月至2013年12月本院放疗科收治的14例HIV阳性恶性肿瘤患者,其中,男4例,女10例。宫颈癌9例,鼻咽癌2例,肺癌2例,皮肤癌1例。艾滋病(AIDS)相关肿瘤9例,非AIDS相关肿瘤5例。经HAART治疗10例。中位年龄38岁(22~58岁)。HIV诊断标准:本院做艾滋病的初筛实验,阳性标本送云南省疾病预防控制中心HIV实验室做确认实验。本研究经云南省肿瘤医院伦理委员会讨论批准,患者均签署知情同意书。
2. 患者CD4淋巴细胞水平:参考国际原子能机构(IAEA)报告,以CD4水平进行分类[6],指导放疗。CD4>200/μl:患者有较好的免疫功能,常规放疗技术无需更改;50/μl<CD4<200/μl:患者免疫功能轻度受损,考虑标准治疗,但要谨慎(注意耐受性和感染);CD4<50/μl:患者免疫功能严重受损,考虑姑息性治疗。本研究中,患者中位CD4淋巴细胞为110/μl(42~582/μl),其中10例>50/μl,2例未进行CD4检测。
3. 放疗方法:放疗剂量34~70 Gy。 ①腹盆部肿瘤:9例宫颈癌均为AIDS相关肿瘤,采用前后对穿野外照射,盆腔大野30 Gy/15次,四野20 Gy/10次,根治性放疗同时加高剂量率腔内放疗7 Gy/次,42 Gy/6次。②胸部肿瘤:2例肺癌均行三维适形放疗(3D-CRT)。③头颈部肿瘤:1例鼻咽癌常规面颈大野普放根治性放疗,1例行根治性调强放疗(IMRT)。④皮肤肿瘤:未手术治疗,照射野相对较小,为肿瘤周边外放2 cm,予以高剂量的根治性放疗。
4. 不良反应评估标准:所有患者在放疗期间、放疗后1个月,进行放疗急性反应评估,依据照射部位进行急性放射反应分类,参照不良事件通用术语标准(CTCAE 3.0版)分级。
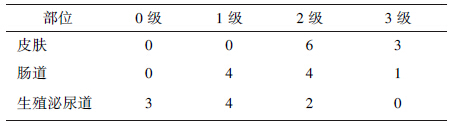
1. 腹盆部肿瘤:腹盆部肿瘤患者急性放射反应结果如表1所示。9例宫颈癌患者中,3例患者出现3级放射性皮肤反应,放疗中断2~5 d。放射性皮炎出现部位为腹股沟区或肛门皮肤皱褶处,需要特殊护理,1例出现3级肠道反应。放疗结束后3周皮肤恢复正常。2例患者由于皮肤及肠道反应,出现疲乏、体重及KPS评分下降,不能耐受,予以减量行姑息性放疗,未完成放疗计划。
| 表1 腹盆部肿瘤患者急性放射反应(例) |
2. 胸部肿瘤:2例均为肺癌,未能手术治疗。1例患者为右肺腺癌,T2N2M0,放疗至44 Gy/22次时出现严重吞咽痛,急性食管炎3级,需要服用镇痛药物,静脉补液,暂停放疗4 d。因食管受照长度达10 cm,照射剂量受限至50 Gy。另1例为左肺鳞癌,T2N1M0,予以放疗60 Gy/30次,食管区受照长度为3 cm,放疗至24 Gy/8次时出现2级食管黏膜反应。2例患者均未出现放射性肺炎症状。
3. 头颈部肿瘤:鼻咽癌2例,均为常规分割2 Gy/次。1例行常规面颈大野照射患者在10 Gy时出现黏膜反应,20 Gy时出现皮肤放射性红斑,30 Gy时黏膜反应严重,放疗暂停3 d。44 Gy时出现3级皮肤反应,暂停放疗5 d。1例患者行IMRT治疗出现急性反应更早,患者在行放疗2 Gy时即出现恶心、咽喉痛等急性黏膜反应,随放疗进行主观不适愈发明显,10 Gy时予以输液对症处理,皮肤2级反应在16 Gy时出现,38 Gy后因3级皮肤反应暂停放疗2次。2例患者均完成治疗,但放疗反应出现早、发展快,并中断治疗2次。
4. 皮肤肿瘤:鼻翼皮肤鳞癌1例,在治疗54 Gy时出现3级皮肤反应,暂停治疗4 d。
云南省因特殊地理位置及历史原因,HIV感染者甚多,恶性肿瘤目前为AIDS晚期患者死亡的重要原因[3, 4]。临床上对HIV阳性肿瘤患者分为AIDS相关肿瘤(ADC)及非AIDS相关肿瘤(NADC)。AIDS患者中出现卡波西氏肉瘤、非霍奇金淋巴瘤和宫颈癌3种恶性肿瘤被认为是AIDS相关恶性肿瘤[7]。其余肿瘤被认为是非AIDS相关肿瘤。本研究观察14例患者中有9例为AIDS相关恶性肿瘤,均为宫颈癌,5例为非AIDS相关恶性肿瘤,包括肺癌、鼻咽癌和皮肤癌。文献报道,在美国使用HAART治疗后ADC患者数量减少,而NADC患者则有增加[8, 9]。本院收治行放疗的14例患者中NADC占5例,反映了HIV患者在抗病毒治疗后,恶性肿瘤的种类变多。
李科等[10]报道,云南省肿瘤医院收集2006年1月至2010年12月首次住院的肿瘤患者及手术前、输血前和各种有创性检查前的HIV筛查的肿瘤患者45 036例,报道HIV感染227例,阳性率0.5%。对这些特殊人群如何开展抗肿瘤治疗,成为肿瘤治疗中的难点。感染HIV增加了正常组织的放射敏感性,其放疗早反应组织和晚反应组织较正常人群反应均较重,具体原因并不明确。由于急性放射反应,完成放射治疗的比例可能降低。
本研究中,14例HIV肿瘤患者接受放疗,6例患者放疗期间有3级皮肤反应,暂停放疗待皮肤损伤好转后继续放疗,2例3级黏膜反应,需口服镇痛药及补液处理。肿瘤患者3~4级急性放射性皮炎,可出现皮肤射野区的湿性脱皮(非皮肤反折或皱褶处的湿性脱皮),必然中断放疗待皮损缓解,以避免增加对患者特别是HIV患者的感染风险。
HIV阳性肿瘤患者出现急性不良反应较正常人群偏早,在头颈部及腹部照射野大时更明显。1例鼻咽癌行常规面颈大野照射患者在10 Gy时出现黏膜反应。另1例鼻咽癌患者IMRT治疗,放疗1次即出现咽喉部黏膜反应,恶心、呕吐、吞咽疼痛,5次就予以输液治疗。腹盆部放疗2例患者未能完成放疗。胸部放疗的患者相对照射面积比头颈部及腹部肿瘤小,耐受性相对好。照射计划设计时要注意保护食管黏膜,减少食管受照长度。
文献报道,人类免疫缺陷病毒1型反式激活因子(TAT)蛋白转导肽可破坏DNA双链,使辐射后细胞修复能力下降,从放射生物角度解释HIV阳性肿瘤患者放疗反应加大的原因[11]。临床观察HIV阳性的肿瘤患者放疗后急性放射反应趋向严重[12, 13],需要谨慎治疗。提醒在进行较大面积照射时,HIV阳性恶性肿瘤患者其组织耐受性下降,需要注意不良反应,避免出现严重的黏膜及皮肤反应。
本研究观察到放射治疗对部分患者是一个可选择的治疗手段。HIV阳性肿瘤患者出现早期放射治疗不良反应较常规更早,更重。这类患者进行头颈部、腹盆腔大野放疗期间的皮肤、黏膜急性反应需要予以高度关注,提前预防和处理,必要时延期放疗或终止放疗。目前,对HIV阳性肿瘤患者的抗肿瘤治疗都还处于探索阶段,今后还需要更多的疗效、不良反应观察数据及相关研究,建立并丰富治疗指南。
| [1] | Lima VD, Hogg RS, Harrigan PR, et al. Continued improvement in survival among HIV-infected individuals with newer forms of highly active antiretroviral therapy[J]. AIDS, 2007, 21(6): 685-692. |
| [2] | Engels EA, Pfeiffer RM, Goedert JJ, et al. Trends in cancer risk among people with AIDS in the United States 1980-2002[J]. AIDS, 2006, 20(12): 1645-1654. |
| [3] | Simard EP, Engels EA. Cancer as a cause of death among people with AIDS in the United States[J]. Clin Infect Dis, 2010, 51(8): 957-962. |
| [4] | Louie KJ, Hsu LC, Osmond DH, et al. Trends in causes of death among persons with acquired immunodeficiency syndrome in the era of highly active antiretroviral therapy, San Francisco, 1994-1998[J]. J Infect Dis, 2002, 186(7): 1023-1027. |
| [5] | Simonds HM, Wright JD, du Toit N, et al. Completion of and early response to chemoradiation among human immunodeficiency virus (HIV)-positive and HIV-negative patients with locally advanced cervical carcinoma in South Africa[J].Cancer, 2012, 118(11): 2971-2979. |
| [6] | International Atomic Energy Agency.The role of radiotherapy in the management of cancer patients infected by human immunodeficiency virus (HIV)[R]. Vienna: IAEA, 2001. |
| [7] | Silverberg MJ, Abrams DI. AIDS-defining and non-AIDS-defining malignancies: cancer occurrence in the antiretroviral therapy era[J]. Curr Opin Oncol, 2007, 19(5): 446-451. |
| [8] | Pantanowitz L, Schlecht HP, Dezube BJ. The growing problem of non-AIDS-defining malignancies in HIV[J]. Curr Opin Oncol, 2006, 18(5): 469-478. |
| [9] | Nutankalva L, Wutoh AK, McNeil J. Malignancies in HIV: pre- and post-highly active antiretroviral therapy[J]. J Natl Med Assoc, 2008, 100(7): 817-820. |
| [10] | 李科, 洪志鹏, 沈丽达,等. 云南省住院肿瘤患者艾滋病感染现状及分析[J]. 现代预防医学, 2013, 40(1):162-165. |
| [11] | Sun Y, Huang YC, Xu QZ, et al. HIV-1 Tat depresses DNA-PK(CS) expression and DNA repair, and sensitizes cells to ionizing radiation[J]. Int J Radiat Oncol Biol Phys, 2006, 65(3): 842-850. |
| [12] | Formenti SC, Chak L, Gill P, et al. Increased radiosensitivity of normal tissue fibroblasts in patients with acquired immunodeficiency syndrome (AIDS) and with Kaposi's sarcoma[J]. Int J Radiat Biol, 1995, 68(4): 411-412. |
| [13] | Gichangi P, Bwayo J, Estambale B, et al. HIV impact on acute morbidity and pelvic tumor control following radiotherapy for cervical cancer[J]. Gynecol Oncol, 2006, 100(2): 405-411. |
 2015, Vol. 35
2015, Vol. 35