2. 济南空军选拔中心
脑转移瘤是颅外恶性肿瘤累及脑实质、脑脊膜、脑神经和颅内血管的转移性肿瘤,当颅脑多发转移病灶个数较多时,三维适形放疗(3D-CRT)无法更加有效地保护危及器官和正常组织。由于颅脑危及器官解剖位置的限制,当靶区距离越接近脑干、眼晶状体等时,逆向调强放疗(IMRT)优势越明显[1, 2, 3]。逆向调强放疗计划设计复杂,合理的射野数目、角度及优化参数等可以提高IMRT计划的质量,但这些参数一般靠人为设定,不同经验的物理师存在人为误差[4]。国内外已有学者通过对射野角度、权重等参数进行优化,以期利用各种优化模型得到比人为设置参数更好的剂量分布[5, 6, 7]。本研究利用Eclipse 11.0计划系统的角度优化模块,对颅脑多发转移瘤逆向调强射线入射角度进行优化,并与7个射野角度均分的逆向调强计划进行比较,探讨不同射野角度对逆向调强计划质量的影响及射野角度优化的可行性。
1. 病例选择:单纯随机取样法选取2010至2013年在本院行放疗的11例多发脑转移瘤患者,其中男性7例,女性4例。年龄为54~73岁,中位年龄为64岁。每例患者多发脑转移瘤病灶个数在2~4之间,病灶总数28个,其解剖位置位于顶叶10个、额叶2个、颞叶6个、枕叶9个、小脑1个。本研究经山东省肿瘤医院伦理委员会讨论批准,患者均签署知情同意书。
2. 仪器设备:采用荷兰飞利浦公司生产的大孔径CT、头部固定仪和热塑面膜进行体位固定和CT扫描。采用美国Varian公司生产的Eclipse 11.0三维治疗计划系统和Trilogy加速器进行放疗计划设计,Trilogy加速器的多叶光栅由60对叶片组成,光栅中心40对叶片,每片宽度在等中心位置的投影为5 mm,两端20对叶片每片宽度在等中心位置的投影为10 mm。叶片最大运动速度2.5 cm/s,机架旋转速度4.8°/s,剂量率为300 MU/min。
3. 体位固定及CT扫描:选用塑形性较好的热塑面膜固定。定位时患者仰卧位平躺于头罩固定体架之上,双上肢自然下垂平放,双腿并拢,全身放松。CT增强扫描范围自颅顶向下包括整个脑组织,扫描层厚3 mm。扫描后CT图像由网络传输至Eclipse 11.0三维治疗计划系统。
4. 靶区、危及器官及辅助环带勾画:由放疗医师勾画出肿瘤靶区(GTV)和危及器官(包括眼球、眼晶状体、视神经、视交叉、脑干、正常脑组织),GTV外放5~8 mm生成计划靶区(PTV)。由物理师在治疗计划系统上生成优化器官以优化调强计划。
5. 计划设计:利用Eclipse 11.0三维治疗计划系统对11例患者分别设计两组IMRT计划,采用6 MV X射线,靶区处方剂量为2 Gy×30次。
(1)射野角度均分逆向调强计划(BAF组):计划射野为7野等中心共面照射野。射野角度分别为0°、51°、102°、153°、205°、256°、308°。机头角度﹑床角为0°。根据靶区处方剂量及保证处方剂量线包绕PTV体积≥95%的临床剂量要求和危及器官限量[8]:最大耐受剂量为脑 < 50 Gy、视神经 < 50 Gy、眼球 < 45 Gy、眼晶状体 < 5 Gy,设定相应的理想目标参数进行优化。
(2)射野角度优化逆向调强计划(BAO组):首先对射野角度进行优化,初始射野数目为均匀分布的120个射野,通过设置优化模型中的各项参数由治疗计划系统自动优化获得7个照射野,将7个照射野采用与BAF相同的逆向调强目标优化参数进行靶区剂量优化。
剂量计算均采用各向异性分析(AAA)算法,剂量计算网格大小为2.5 mm × 2.5 mm。保证所有计划中95%以上靶区体积达到处方剂量,剂量均归一于PTV的平均剂量[9]。
6. 计划评估与比较:利用剂量体积直方图(DVH)详细评估靶区、危及器官受照剂量,统计机器跳数。其中,靶区剂量统计了PTV的V100%、V105%、V108%、V110%、D2%、D98%,其中,Vx%指x%的处方剂量包绕的PTV的体积,Dx%指x%体积的PTV受照剂量。比较两组计划的靶区适形度(CI)和均匀性指数(HI)[10, 11]。CI和HI计算如公式(1)和(2)所示。
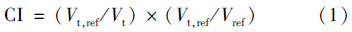
式中,Vt为靶区体积,cm3;Vt,ref为参考等剂量线包绕的靶区体积,cm3;Vref为参考等剂量线所包绕的所有区域的体积,cm3。
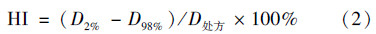
式中,D2%和D98%分别为DVH中2%和98%的靶区体积对应的剂量,cGy;D处方为计划给予的处方剂量,cGy。危及器官统计双侧眼球最大和平均受照剂量,双侧眼晶状体、视神经最大受照剂量,脑干、视交叉最大受照剂量及正常脑组织平均受照剂量。
7. 统计学处理:数据以 ± s表示。采用SPSS 19.0软件对两组计划的剂量学差异行配对t检验。P < 0.05为差异有统计学意义。
± s表示。采用SPSS 19.0软件对两组计划的剂量学差异行配对t检验。P < 0.05为差异有统计学意义。
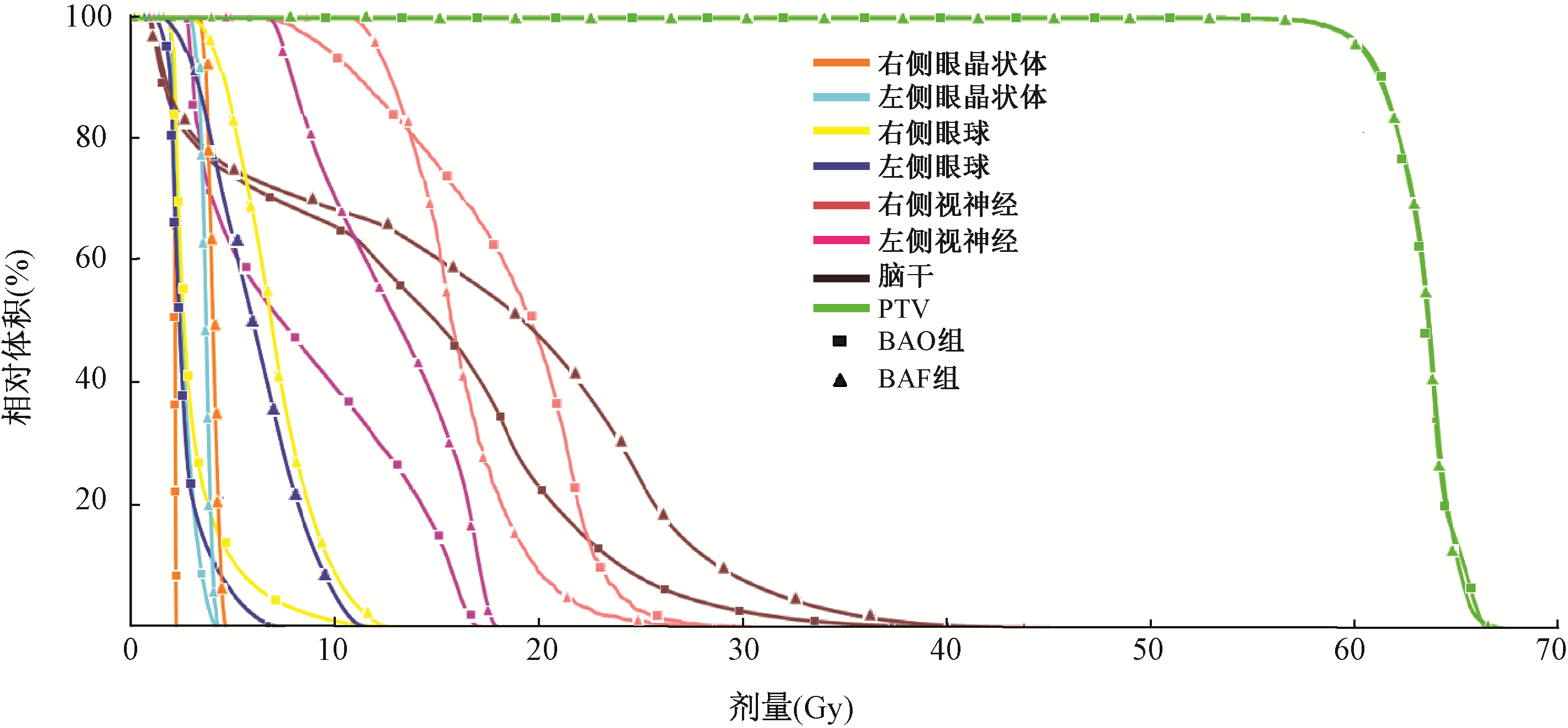
1. DVH比较:两组计划典型的DVH图如图1所示。BAO组计划中的右侧眼晶状体、两侧眼球和右侧视神经的受照射剂量均有不同程度降低。与BAF组相比,BAO组中右侧眼晶状体最大受照剂量约减少了2 Gy,右侧眼球的最大剂量减少了约1 Gy,左侧眼球的最大剂量减少了约4 Gy,左右眼球的平均剂量均减少了约5 Gy,左侧视神经的最大剂量减少了约1 Gy。结果显示,靶区剂量无明显变化,差异较小。
|
图1 某例多发脑转移瘤患者两组计划DVH比较 注:BAO.射野角度优化逆向调强计划;BAF.射野角度均分逆向调强计划;PTV.计划靶区 |
2. 靶区剂量:两组计划中,PTV的V100%均在98%以上。BAF组和BAO组中,PTV的V110%分别为(0.94±1.38)%和(1.27±1.86)%;CI分别为0.086±0.010和0.084±0.020;HI分别为(87±4)%和(86±5)%。结果显示,与BAF组相比,BAO组在靶区剂量方面差异不明显,其中靶区V100%、V105%、V108%、V110%、D2%、D98%及靶区适形度、均匀性方面差异均无统计学意义(P>0.05)。BAO组的V105%、V108%分别降低了4.9%、7.4%。
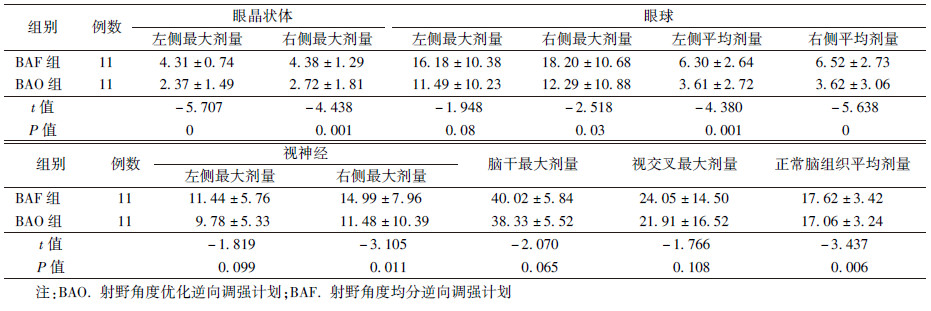
3. 危及器官受量:11例多发脑转移瘤患者两组计划的危及器官剂量比较结果列于表1。与BAF组相比,BAO组计划中双侧眼晶状体最大受照剂量、双侧眼球平均受照剂量均一定程度有所降低,其中,左、右眼晶状体最大受照剂量平均降低45%、37%(t=-5.707、-4.438,P<0.05);左、右眼球平均剂量分别降低42.6%、44.5%(t=-4.380、-5.638,P<0.05);右侧眼球的最大剂量平均降低32.5%(t=-2.518,P<0.05)。左、右侧视神经最大剂量平均降低15%、23%,视交叉最大剂量平均降低8%,但只有右侧视神经的最大剂量两组计划间差异有统计学意义(t=-3.105,P<0.05)。脑干的最大剂量两种计划差异无统计学意义(P>0.05)。BAO组中正常脑组织平均剂量降低3%(t=-3.437,P<0.05)。
表 1 11例多发脑转移瘤患者两组计划的危及器官剂量比较(Gy, ± s) ± s)
|
4. 机器跳数和计划设计时间比较:BAO组计划机器跳数均值为(612.50±269.95)MU,对应的BAF组为(631.70±259.02)MU,但两组结果差异无统计学意义(P>0.05)。BAF和BAO组的计划设计时间分别为(10.3±1.2)和(10.9±1.0)min,两组结果差异无统计学意义(P>0.05)。
逆向调强优化是IMRT设计中重要的一环,目的是利用计划系统将不同强度分布的剂量通过不同角度、面积的射野投射到靶区,以达到尽量降低周围危及器官受照剂量,同时获得靶区剂量高度适形的目的。逆向调强优化过程都需要计划系统在各种优化模型中寻求最符合目标函数的解。射野角度优化同样需要在模型中大量计算以获得最优的解,目前的优化模型,如牛顿梯度算法可能会由于很难获得最优的解而导致优化时间太长[12]。已有学者改进优化模型缩短了优化时间,并研究确认射野入射角度对正常器官有明显影响,证实了射线入射角度的选择会明显影响放射治疗计划质量[13, 14]。Kim等[15]发现在肝癌逆向调强放射治疗中5个围绕靶区且相互间距小的射野较5个均分角度射野更容易降低正常肝组织受照剂量。Srivastava等[16]通过剂量测量得到的结论,是对于大多数逆向调强计划,角度优化调强均优于手动选择射束角度的逆向调强,提高射束角度选择的准确性对于减少危及器官受照剂量至关重要。
本研究比较了通过射野角度优化模型得到的射野角度与均分射野角度调强计划的剂量学差异。经过角度优化后的逆向调强计划并没有使更多的靶区体积达到处方剂量,相对高剂量区域较7野均分调强计划亦没有明显降低,差异均无统计学意义。虽然在靶区剂量控制上没有更好的表现,但是经过角度优化后的逆向调强计划中,危及器官受照剂量均有所降低,这也与Kim等[15]和Srivastava等[16]的研究结果一致,其中,眼晶状体、眼球受量降低幅度较大且差异具有统计学意义。由于两组计划采用相同的剂量-体积优化参数,因此,可以认为入射角度不同是导致两组计划之间剂量学差异的原因。当针对多发脑转移瘤进行逆向调强计划设计时,通过理想的射野角度优化模型可以自动识别危及器官与靶区的距离及相互位置关系,特别是当危及器官体积较小或距离靶区较远时,通过射野角度自动优化很容易在优化模型中反复迭代计算出合适的解,从而自动形成躲避危及器官的理想射野角度。相比之下,由于多发脑转移瘤病灶数目较多且在颅脑组织中分布位置不固定,范围广泛且无规律性,导致人为选择射野角度难度加大。虽然角度优化相对增加了优化过程及优化时间,但是角度优化可以弥补人为选择入射角度时的经验不足,同时射野角度选择范围更大,灵活性更高,并且在达到与角度均分逆向调强靶区剂量相当的情况下,更好的保护小体积危及器官及正常脑组织。参考放疗剂量学原则及计划评估标准,本研究通过角度优化后的逆向调强计划优于角度均分逆向调强计划,角度优化在颅脑转移瘤逆向调强计划中具有一定优势,可为逆向调强计划设计提供积极作用。
本实验病灶数目相对较少,且靶区位置距离危及器官较远,若转移瘤数目众多或紧邻危及器官,可能会由于优化模型解空间太大而导致无解,需要进一步研究创新优化模型及优化算法,如可以优化非共面的射野布置可能显著提高计划质量,同时采集大样本病例数据,分析射野角度与靶区位置关系会对角度自动优化及角度选择提供更好的帮助。
| [1] | Yu CX, Amies CJ, Svatos M. Planning and delivery of intensity-modulated radiation therapy[J]. Med Phys, 2008, 35(12): 5233-5241. |
| [2] | Eisbruch A. Intensity-modulated radiation therapy in the treatment of head and neck cancer[J]. Nat Clin Pract Oncol, 2005, 2(1): 34-39. |
| [3] | Zelefsky MJ, Chan H, Hunt M, et al. Long-term outcome of high dose intensity modulated radiation therapy for patients with clinically localized prostate cancer[J]. J Urol, 2006, 176(4): 1415-1419. |
| [4] | Pugachev A, Xing L. Incorporating prior knowledge into beam orientaton optimization in IMRT[J]. Int J Radiat Oncol Biol Phys, 2002, 54(5): 1565-1574. |
| [5] | Wang X, Zhang X, Dong L, et al. Development of methods for beam angle optimization for IMRT using an accelerated exhaustive search strategy[J]. Int J Radiat Oncol Biol Phys, 2004, 60(4): 1325-1337. |
| [6] | 倪昕晔, 杨建华, 孙苏平, 等. 基于改良遗传算法的调强射野角度优化[J]. 中华放射肿瘤学杂志, 2009, 18(5): 409-412. |
| [7] | Woudstra E, Heijmen BJ, Storchi PR. Automated selection of beam orientations and segmented intensity-modulated radiotherapy (IMRT) for treatment of oesophagus tumors[J]. Radiother Oncol, 2005, 77(3): 254-261. |
| [8] | Emami B, Lyman J, Brown A, et al. Tolerance of normal tissue to therapeutic irradiation[J]. Int J Radiat Oncol Biol Phys, 1991, 21(1): 109-122. |
| [9] | Fogliata A, Clivio A, Nicolini G, et al. Intensity modulation with photons for benign intracranial tumours: a planning comparison of volumetric single arc, helical arc and fixed gantry techniques[J]. Radiother Oncol, 2008, 89(3): 254-262. |
| [10] | 金大伟,戴建荣,李晔雄,等.前列腺调强放疗的治疗方案比较[J].中华放射肿瘤学杂志,2005,14(1):47-51. |
| [11] | Wu Q, Mohan R, Morris M, et al. Simultaneous integrated boost intensity-modulated radiotherapy for locally advanced head-and-neck squamous cell carcinomas. I: dosimetric results[J]. Int J Radiat Oncol Biol Phys, 2003, 56(2): 573-585. |
| [12] | Potrebko PS, McCurdy BM, Butler JB, et al. Improving intensity-modulated radiation therapy using the anatomic beam orientation optimization algorithm[J]. Med Phys, 2008, 35(5): 2170-2179. |
| [13] | Narayanan VK, Vaitheeswaran R, Bhangle JR, et al. An experimental investigation on the effect of beam angle optimization on the reduction of beam numbers in IMRT of head and neck tumors[J]. J Appl Clin Med Phys, 2012, 13(4): 3912. |
| [14] | Lee CH, Aleman DM, Sharpe MB. A set cover approach to fast beam orientation optimization in intensity modulated radiation therapy for total marrow irradiation[J]. Phys Med Biol, 2011, 56(17): 5679-5695. |
| [15] | Kim SH, Kang MK, Yea JW, et al. The impact of beam angle configuration of intensity-modulated radiotherapy in the hepatocellular carcinoma[J]. Radiat Oncol J, 2012, 30(3): 146-151. |
| [16] | Srivastava SP, Das IJ, Kumar A, et al. Dosimetric comparison of manual and beam angle optimization of gantry angles in IMRT[J]. Med Dosim, 2011, 36(3): 313-316. |
 2015, Vol. 35
2015, Vol. 35