随着CT检查在临床上的应用日益广泛,其辐射剂量和生物损伤效应问题成为关注热点,CT辐射诱发癌症的风险成为放射医学人员研究的焦点[1]。有报道称,美国有1.5%~2.0%的癌症患者可能归因于CT检查所致的辐射损伤[2]。DNA双链断裂(DSBs)被公认为电离辐射诱发癌症和遗传性疾病的最重要的生物损伤机制[3],细胞对于双螺旋结构破坏最早的反应阶段之一就是形成H2AX组蛋白异型的磷酸化形式即γ-H2AX[4, 5]。本研究通过γ-H2AX免疫荧光分析技术,结合体内、外临床实验,对比分析CT扫描前后人外周血淋巴细胞的γ-H2AX焦点数量及与CT剂量的相关性,旨在量化评估CT辐射的生物学剂量-效应关系。
1. 研究对象:15例患者纳入本研究,其中,男性5例,女性10例,平均年龄51.2岁。纳入条件:满18周岁;无恶性血液系统疾病史;3个月内未曾行放疗或化疗;7 d内未曾行X射线检查。其中,11例患者行腹部+盆腔平扫+三期增强扫描,3例患者行腹部平扫+三期增强扫描,1例患者行盆腔平扫检查。本研究经苏州大学附属第二医院国家药物临床实验机构伦理委员会审查许可,研究对象均属自愿参加并签署知情同意书。
2. 血样采集:15例患者CT检查前经肘静脉采集血样4 ml/人,按2 ml/管分装入2个抗凝管中,分别标记为1空白对照组和2离体受照组。其中,第1管血样置于37℃孵育箱中以保持细胞活性,待处理;第2管血样固定于患者体表的扫描范围中心,CT扫描结束后记录辐射剂量,血样置入0℃冰箱待处理;CT检查完成后5 min,经患者肘静脉另行采集血样2 ml/人,编号3为在体受照组。1、2、3管立即同时进入实验室处理。
3. CT扫描:[JP3]美国GE公司LightSpeed VCT 64排螺旋CT机。采用螺旋扫描方式,扫描条件为120 kV,200 mAs,层厚5 mm,扫描视野(FOV)50 cm,螺距0.984[DK]∶1,CTDIvol 16.78 mGy。[JP]使用剂量长度乘积(DLP)代表CT辐射剂量[6]。
4. 免疫荧光检测:用Ficoll分层液法提取外周血淋巴细胞;取20 μl的细胞悬液滴片制作标本,自然晾干5 min,500 μl 4%多聚甲醛固定细胞15 min (4℃),2×柠檬酸缓冲液(SSC,自行配制,上海溶剂厂)+0.1%NP 40(北京绿源大德生物科技有限公司)洗涤3次;500 μl 0.2%的Triton-X 100(上海碧云天生物技术有限公司)通透15 min(室温),洗涤同前;200 μl山羊血清工作液(北京索莱宝科技有限公司)封闭45 min(37℃),洗涤同前;70%、85%、100%冰乙醇溶液梯度脱水,自然干燥;然后加入10 μl鼠抗γ-H2AX抗体(一抗,1[DK]∶150,美国Upstate公司),加盖玻片,密封,湿盒内孵育过夜(37℃);次日,洗涤,梯度脱水;加入20 μl FITC山羊抗鼠IgG抗体(二抗,1[DK]∶360,美国Molecular Probes公司),湿盒孵育45 min(37℃),洗涤;DAPI(南京凯基生物科技发展有限公司)20 μl复染5 min,90%甘油封片15 min,于Olympus BX51正置荧光显微镜下(日本Olympus公司)观察。
5. 荧光图像观察、计数和采集、处理:荧光显微镜下观察γ-H2AX荧光焦点,使用金菩嘉探针及荧光成像分析系统采集、处理图像,所有图像均在油镜(×1 000倍)条件下采集。γ-H2AX荧光焦点计数原则如下:1每个标本由2~3人(放射科医师或实验室技术人员)盲法下进行计数,计算平均值。2每个标本(细胞滴片)至少计数40个细胞(细胞数较多时)或40个焦点(细胞数较少时)[7, 8]。3尽量避免选择细胞堆积、融合或微小异物、杂质较多的视野。
6.统计学处理:采用SPSS 21.0统计软件包,所有数据资料均符合正态分布,对15例患者不同组别的γ-H2AX荧光焦点数均值(焦点数/细胞)进行两两配对设计资料的t检验、双变量Pearson简单相关分析和线性回归分析。P < 0.05为差异有统计学意义。
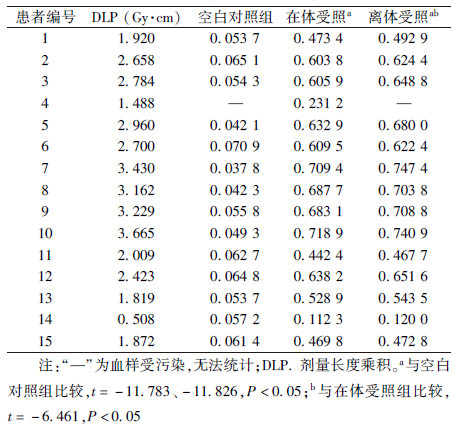
1. 各组外周血淋巴细胞γ-H2AX荧光焦点数量对比:表1为15例患者空白对照组及离体、在体受照后5 min的外周血淋巴细胞 γ-H2AX焦点数量,4号患者因实验过程中空白对照组和离体受照组血样不慎污染,仅观察到在体受照组的结果。其余14例患者离体受照组的外周血γ-H2AX焦点数量明显高于在体受照组(t=-6.461,P< 0.05)。
| 表1 15例患者不同组别外周血淋巴细胞γ-H2AX荧光焦点形成(焦点数/细胞) |
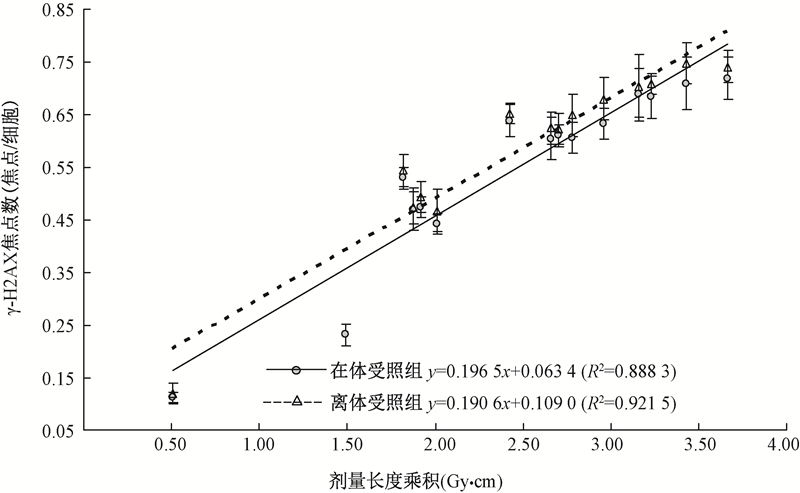
2. 在体、离体受照组的CT辐射剂量与外周血淋巴细胞γ-H2AX焦点数量的相关性:如图1所示,在体受照组的拟合直线回归方程模型为:y=0.196 5x+0.063 4(R2=0.888 3),离体受照组的拟合直线回归方程模型为:y=0.190 6x+0.109 0(R2=0.921 5)。可以看出,R离2>R在2,提示离体受照组中两者之间的线性相关程度要稍高于在体组。两条拟合直线近似平行,但离体受照组拟合直线的"高度"也要高于受照在体组的拟合直线。
|
图 1 在、离体受照组CT剂量与γ-H2AX焦点数关系图 |
免疫荧光法分析γ-H2AX简称γ-H2AX分析,是目前研究γ-H2AX的最主要的方法,也是近年来发展起来的一种检测电离辐射致DNA双链断裂的方法,根据DNA双链断裂可以诱导产生γ-H2AX,并且γ-H2AX数量和DNA双链断裂存在相互对应关系,运用γ-H2AX的特异性荧光抗体,结合免疫荧光标记技术,在荧光显微镜下可以观察到细胞核上的荧光亮点,称为γ-H2AX焦点[9, 10]。
本研究通过对15例临床患者CT扫描前后外周血淋巴细胞γ-H2AX焦点数量观察,其中1例患者因血样污染导致空白对照组和离体受照组无观察结果,另外14例患者的外周血γ-H2AX焦点基底水平平均值约0.055 1±0.01,与Rothkamm和Lbrich[11]对成纤维细胞的研究(0.04~0.06)基本一致,略低于Heydenreich等[12]研究8例欧洲青年男性健康志愿者外周血淋巴细胞基底水平(0.07~0.09)结果。在、离体受照后5 min 14例患者的外周血淋巴细胞γ-H2AX焦点数量均显著增加,说明CT照射激活了人类血细胞DNA损伤反应也就是γ-H2AX形成的程序链。受照后外周血淋巴细胞的γ-H2AX数量随CT辐射剂量增加而增加,这与之前一些有关皮肤成纤维细胞和外周血淋巴细胞的文献报道一致[7, 8, 11, 13, 14]。而γ-H2AX焦点数目和DLP值呈线性相关也说明CT辐射对外周血DNA的损伤既与局部照射剂量有关,又与CT扫描长度有关[8, 13, 14]。
本研究显示,离体受照组的γ-H2AX焦点数量明显高于在体受照组,并且离体受照组拟合直线的相关性高于在体受照组,分析原因可能主要为,在体受照组属于局部照射而非全身照射,照射后抽取的血样,受全身血液循环影响被部分稀释,外加人体组织器官厚度的影响阻挡部分X射线吸收。而离体受照血样则是全剂量照射,高于在体受照组的有效吸收剂量。这一点可以通过不经血液循环扩散的皮肤成纤维细胞γ-H2AX焦点来证实[8]。另外,DNA双链断裂后γ-H2AX依次结合Brcal、Rad50/51等因子启动修复过程[4, 5],在体CT照射后抽取血样的5 min里,γ-H2AX焦点数量可能因为DNA损伤修复而降低。Rothkamm等[7]研究证实,外周血单个核细胞离体经X射线照射后,γ-H2AX焦点数量回降速率很慢,照射后几天仍保持在一个较高水平。而在体内受照后,γ-H2AX焦点数量迅速修复回落,半小时后降低约50%。至于相关决定系数离体受照组高于在体受照组,原因可能正是体内血液循环和复杂微环境的影响所致。Lbrich等[8]曾对离体X射线照射后的γ-H2AX焦点数量与临床患者CT照射后进行了对比研究,结论显示在体内CT照射后的细胞受损的范围(出现γ-H2AX焦点的细胞个数)较离体后广泛,推测原因可能是低剂量电离辐射的"旁观者效应",表现为未直接受照的细胞中也会产生辐射损伤,这种损伤的诱发因子来自于邻近的受照细胞。
本研究尚存几点不足,一是定位初步临床研究病例数相对较少,且条件所限,本研究CT辐射剂量仅采用CT机上的DLP值为代表,并未转化为离、在体受照血样或患者的有效吸收剂量,有待后续研究补充物理剂量测定;二是缺乏与DNA损伤的"金标准"—染色体畸变分析对照研究的数据资料,Golfier等[13]对双着丝粒染色体和γ-H2AX进行了对照研究,得出结论,两种方法都是低剂量电离辐射损伤的敏感生物标记物,尤以γ-H2AX的敏感性更高,γ-H2AX可以同时反映CT照射后DNA损伤及修复情况,而染色体畸变分析则反映染色体DNA的永久损伤,二者各有优势不能相互替代。
γ-H2AX分析在监测低剂量电离辐射致DNA双链断裂方面具有独特的优势,如诊断水平剂量(mGy)的超高辐射敏感性,较宽范围的剂量效应线性关系,微小的血样采集创伤等,尽管存在一定的局限性,仍可作为电离辐射损伤的生物剂量标记物,但应审慎推广应用[15]。
| [1] | Tofilon PJ, Fike JR. The radioresponse of the central nervous system: a dynamic process[J]. Radiat Res, 2000, 153(4): 357-370. |
| [2] | Karin M, Lin A. NF-κB at the cross roads of life and death[J]. Nat Immunol, 2002, 3(3): 221-227. |
| [3] | Bours V, Bonizzi G, Bentires-Alj M, et al. NF-κB activation in response to toxical and therapeutical agents: role in inflammation and cancer treatment[J]. Toxicology, 2000, 153(1-3): 27-38. |
| [4] | Karin M, Cao Y, Greten F, et al. NF-κB in cancer: from innocent bystander to major culprit[J]. Nature Rev Cancer, 2002, 2(4): 301-310. |
| [5] | Liu SF, Malik AB. NF-κB activation as a pathological mechanism of septic shock and inflammation[J]. Am J Physiol Lung Cell Mol Physiol, 2006, 290(4): L622-L645. |
| [6] | 马辰莺,徐晓婷,涂彧,等. VEGF mRNA及蛋白在大鼠放射性脑损伤模型中的动态变化[J]. 中华放射医学与防护杂志, 2014, 34(6): 405-410. |
| [7] | 董晓荣,伍钢. 小胶质细胞和放射性脑损伤[J]. 中华神经医学杂志, 2009,8(6): 646-648. |
| [8] | Latzer J, Papoian GA, Prentiss MC, et al. Induced fit, folding, and recognition of the NF-κB-nuclear localization signals by IκBα and IκBβ[J]. J Mol Biol, 2007, 367(1): 262-274. |
| [9] | Tamanini A, Rolfini R, Nicolis E, et al. MAP kinases and NF-κB collaborate to induce ICAM-1 gene expression in the early phase of adenovirus infection[J]. Virology, 2003, 307(2): 228-242. |
 2015, Vol. 35
2015, Vol. 35