放射性肝纤维化是肝脏放疗后发生的制约剂量递增的严重并发症。在肝纤维化的发生发展过程中,肝星状细胞(HSC)的活化起着关键作用,活化的HSC可以合成大量细胞外基质并使其在肝组织内聚集[1, 2]。前期研究证实,射线使HSC活化,特异性表达平滑肌肌动蛋白(α-SMA),并且转化生长因子β1(TGF-β1)也出现分泌增加[3, 4]。而PI3K/Akt信号通路是TGF-β1下游的一条重要的信号通路[5],并证实PI3K/Akt信号通路在HSC的活化中有重要的作用[6]。而目前关于射线诱导HSC活化的机制研究较少。本研究探讨PI3K/Akt信号通路在HSC活化中的作用机制,使用X射线照射大鼠HSC细胞系,联合PI3K/Akt信号通路抑制剂,观察PI3K/Akt信号通路与HSC活化的关系,为临床治疗放射性肝纤维化寻找潜在的生物靶点。
1.主要材料与试剂:大鼠肝星状细胞系HSC-T6(南京凯基公司);DMEM培养液(美国GIBCO公司);胎牛血清(澳洲BI公司);TRIzol(美国Invitrogen公司);2×Taq PCR MasterMix(美国Roch公司);TGF-β1 ELISA试剂盒(美国R & D公司);流式细胞法(FCM)凋亡试剂盒(美国BD公司);兔抗鼠p-Akt单抗、兔抗鼠平滑肌肌动蛋白单抗(美国Cell Signaling公司)、二氨基联苯胺(DAB)显色剂(北京中杉金桥公司);Varian 2300C/D医用直线加速器(美国Varian公司);PI3K/Akt信号通路抑制剂LY294002(美国Sigma公司)。
2.细胞系培养及分组:大鼠HSC-T6细胞系采用含有10%胎牛血清的DMEM培养液,置于5%CO2饱和湿度、37℃恒温孵育箱中培养,每日倒置显微镜下观察细胞,当细胞贴满瓶底约80%时传代培养,取对数生长期细胞进行实验。在照射和加抑制剂后48 h收集细胞[7, 8]。实验分空白对照组、抑制剂组、10 Gy照射组、10 Gy+抑制剂组、20 Gy照射组、20 Gy+抑制剂组。
3.照射方法:采用6 MV X射线照射,源靶距100 cm,射野范围10 cm × 10 cm,吸收剂量率为3 Gy/min,吸收剂量分别为10和20 Gy。
4.流式细胞术(FCM)检测细胞凋亡率:用0.25%胰蛋白酶消化收集细胞,1 000×g离心5 min,冰磷酸盐缓冲液(PBS)洗2次,细胞数调整为1×106/ml,加入5 μl异硫氰酸荧光素(FITC)标记的膜连蛋白V(Annexin V)/5 μl碘化丙啶(PI)双标记染色,轻轻混匀于2~8℃避光条件下孵育 15 min,1 h内用流式细胞仪检测细胞凋亡率。实验重复3次。
5.ELISA法检测细胞上清液TGF-β1的浓度:取细胞培养上清液,1 000×g离心20 min。标准品进行倍比稀释(2 000、1 000、500、250、125、62.5、31.25、0 pg/ml)、待测样品稀释100倍后各取100 μl加入酶标板,覆膜,37℃孵育90 min。弃上清,每个孔中加入生物素化抗体工作液100 μl,37℃温育1 h。洗板3次,每孔加酶结合物工作液100 μl,37℃温育30 min。洗板5次,每孔加TMB底物溶液90 μl,酶标板覆膜37℃避光孵育15 min,每孔加终止液50 μl,终止反应,立即用酶标仪在 450 nm 波长测量各孔的吸光度(A)值。绘制标准曲线检测TGF-β1的浓度(所有值均在校准曲线范围内)。实验重复3次。
6. RT-PCR法检测α-SMA的 mRNA表达量:TRIzol法提取细胞总RNA,用分光光度计测定A260/A280比值在1.8~2.0范围内,PCR引物均由上海生工生物工程有限公司设计合成,α-SMA引物的上游序列为5'ATCCTGACCCTGAAGTATCCGATA 3',下游序列为5' CCACGCGAAGCTCGTTATAGA 3',β-肌动蛋白引物的上游序列为5' TAAGGCCAACCGTGAAAAGATG 3',下游序列为5' AGAGGCATACAGGGACAACACA 3',反应条件为95℃ 5 min,95℃ 30 s,55℃ 30 s,65℃ 30 s,65℃ 10 min,40个循环;按反转录试剂盒说明书合成cDNA。利用 SYBR绿色荧光技术,取2 μl反转录产物按20 μl体系在荧光定量 PCR 仪进行Real-time PCR反应,反应结束后,以β-肌动蛋白为内参,荧光强度到达阈值时的循环数 Ct值为统计参数,相对定量分析α-SMA mRNA的表达。实验重复3次。
7.Western blot检测p-Akt的表达量:用0.25%胰蛋白酶消化收集细胞,加入预冷的含蛋白酶抑制剂的RIPA裂解液,并用超声细胞破碎仪使细胞破碎。冰上反应30 min后,4℃ 6 500×g,离心10 min,取上清液。用BCA蛋白定量试剂盒测定蛋白浓度,分装上清,加蛋白上样缓冲液,并加热使细胞变性。按SDS-PAGE凝胶制备试剂盒配置10%分离胶和5%的浓缩胶,将蛋白样品加至上样孔中,进行恒压电泳、转膜后,5%脱脂奶粉封闭1 h,加入一抗(p-Akt 1[DK]∶5 000、β-肌动蛋白 1[DK]∶5 000)。4℃封闭过夜,洗膜后加入二抗,室温下孵育2 h,洗膜后显色。用凝胶图像分析系统进行采图分析。重复3次。
8.统计学处理:数据以 ± s表示。采用SPSS 17.0软件进行统计学分析,计量资料先进行正态性检验和方差齐性检验,方差齐性时用单因素方差分析进行多组间比较,两组之间比较采用t检验。方差不齐时用Tamhane's检验。P < 0.05为差异有统计学意义。
± s表示。采用SPSS 17.0软件进行统计学分析,计量资料先进行正态性检验和方差齐性检验,方差齐性时用单因素方差分析进行多组间比较,两组之间比较采用t检验。方差不齐时用Tamhane's检验。P < 0.05为差异有统计学意义。
1. HSC细胞凋亡率:各组细胞凋亡率的详细结果列于表1。由结果可知,与空白对照组相比,抑制剂组的细胞凋亡率差异无统计学意义(P>0.05);与空白对照组相比,10和20 Gy照射组的细胞凋亡率随照射剂量的增加而增加(t=8.43、11.63,P <0.05);与10 Gy照射组相比,10 Gy+抑制剂组的细胞凋亡率降低(t=8.09,P < 0.05);与20 Gy照射组相比,20 Gy+抑制剂组的细胞凋亡率降低(t=4.88,P < 0.05)。
表1 肝星状细胞的凋亡率、TGF-β1、α-SMA和p-Akt的比较( ± s) ± s)
|
2. HSC细胞TGF-β1浓度及α-SMA 的mRNA表达量:相关详细结果列于表1。由结果可知,与空白对照组相比,抑制剂组的TGF-β1和α-SMA的表达量差异无统计学意义(P>0.05);与空白对照组相比,10 Gy照射组TGF-β1和α-SMA的表达量均升高(t=11.51、18.50,P < 0.05);与10 Gy照射组相比,20 Gy 照射组TGF-β1和α-SMA的表达量随照射剂量的增加而增加(t=6.91、7.80,P < 0.05),10 Gy+抑制剂组TGF-β1和α-SMA的表达量均降低(t=6.17、15.11,P < 0.05);与20 Gy照射组相比,20 Gy+抑制剂组TGF-β1和α-SMA表达量降低(t=10.04、6.85,P < 0.05)。
3.HSC细胞p-Akt的表达量:各组肝星状细胞p-Akt、β-肌动蛋白表达量的比较如图1所示。与空白对照组相比,[JP2]10和20 Gy照射组的细胞p-Akt表达量随照射剂量的增加而增加(t=5.74、31.23,P < 0.05);与10 Gy照射组相比,20 Gy照射组的细胞p-Akt[JP2]表达量增加(t=9.28,P < 0.05),10 Gy+抑制剂组的细胞p-Akt表达量降低(t=10.34,P < 0.05);与20 Gy照射组相比,20 Gy+抑制剂组细胞p-Akt的表达量降低(t=23.84,P<0.05,表1、图1)。
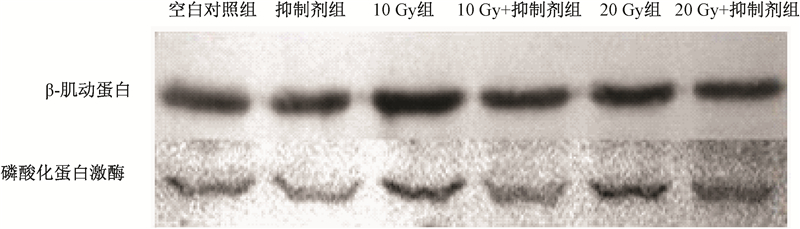
|
图 1 各组肝星状细胞p-Akt、β-肌动蛋白表达 |
HSC的活化是一个复杂的过程,涉及到多种细胞因子和生长因子[9]。活化的HSC发生形态和功能上的变化,细胞增殖、分化、趋化、收缩能力增强,胶原分泌增多,细胞外基质沉积与降解失衡,导致肝纤维化发生和发展[10]。其中TGF-β1能抑制肝细胞再生,诱导肝细胞凋亡,促进HSC活化,使细胞外基质(ECM)的合成增加,降解减少,在肝纤维化的发生和发展中具有重要作用[11]。有研究证实,α-SMA的表达是肝星状细胞活化的特征表现,因此,α-SMA被认为是肝纤维化的标志[12]。本组前期研究发现,结缔组织生长因子(CTGF)、TGF-β1的表达可能与肝纤维化的严重程度有关,在放射性肝纤维化过程中CTGF可能参与了激活TGF-β1信号通路,从而促进HSC的活化与增殖[13]。本研究结果显示,X射线能够使TGF-β1的分泌增加及α-SMA的表达量增加,促进了HSC的活化,引起肝纤维化的发生。这与Hsu等[14]的研究结果一致,药物致肝纤维化时,HSC分泌TGF-β1增加及α-SMA的表达量增加。Shah等[15]也证实,肝损伤时上调TGF-β1并抑制实质细胞增殖,引起HSC活化,使ECM和I型胶原蛋白的产生增加导致纤维化。
PI3K/Akt信号通路在细胞的增殖、凋亡、代谢等过程中起着重要的作用。Akt是PI3K信号转导通路下游的一个重要靶点,激活后的PI3K使其下游的Akt蛋白磷酸化即p-Akt,p-Akt 可以通过调节其下游核糖体40S小亚基S6蛋白激酶(p70S6K )、糖原合成酶激酶3(GSK-3β)等促进HSC活化[16]。本研究结果显示,X射线照射后p-Akt、α-SMA的表达量升高,激活了PI3K/Akt信号通路,从而使HSC的活化、凋亡率升高,导致了肝纤维化的发生;加入PI3K/Akt信号通路特异性抑制剂后,p-Akt、α-SMA的表达量减少,抑制了HSC的活化,细胞凋亡率也降低,减少了肝纤维化的发生。相关研究结果表明,抑制PI3K/Akt信号通路后可以有效地抑制HSCs的增殖,例如直接应用药物LY294002或雷帕霉素等可以明显抑制由血小板衍生因子(PDGF)/PI3K/Akt信号通路调控的HSCs增殖[17]。应用胰岛素样生长因子-I(IGF-I)也能达到同样结果[18]。Son等[19]用构建重组腺病毒(Ad-SMAdnPI3K)的方法,将其转入HSCs后发现可明显抑制PI3K信号通路,并有效地抑制了HSCs的增殖,以及ECM的表达。
本研究通过以不同剂量6 MV X射线(0、10和20 Gy)照射大鼠HSC,并用PI3K/Akt信号通路特异性抑制剂LY294002处理细胞。结果显示,各照射组的细胞凋亡率均高于空白对照组,并且随着照射剂量的增加,细胞的凋亡率升高;相同照射剂量加入抑制剂后,细胞凋亡率明显降低。与空白对照组相比,10和20 Gy照射组TGF-β1、α-SMA、p-Akt的表达量随照射剂量的增加而增加,然而加入抑制剂后表达量均降低。研究结果证实,抑制剂能够使细胞分泌TGF-β1的量减少,并抑制α-SMA、p-Akt的表达,减少HSC的凋亡。究其原因,本研究认为X射线通过激活PI3K/Akt信号通路使HSC的活化并促进其凋亡,并且活化程度随着照射剂量的增加而增加。加入PI3K/Akt信号通路特异性抑制剂后,抑制了该通道,从而抑制了HSC的活化。提示PI3K/Akt是使HSC活化的一条重要通路,通过抑制该通路可以达到抑制HSC活化及减轻放射性肝纤维化的作用。
综上所述,X射线照射使HSC活化,其机制可能与PI3K/Akt信号通路的激活有关,而HSC活化在肝纤维化的发生和发展中有非常重要的作用,通过抑制PI3K/Akt信号通路可以抑制HSC活化及减轻放射性肝纤维化。这可能是预防和治疗放射性肝纤维化的一个重要靶点,为进一步深入研究放射性肝纤维的发生机制及制定进一步的防治措施,提供了新的理论依据。
| [1] | Friedman SL. Liver fibrosis-from bench to bedside[J]. J Hepatol, 2003, 38(Suppl 1): 38-53. |
| [2] | Friedman SL. Mechanisms of disease: mechanisms of hepatic fibrosis and therapeutic implications[J]. Nat Clin Pract Gastroenterol Hepatol, 2004, 1(2): 98-105. |
| [3] | 吴戈, 肖蕾, 艾尼瓦尔·艾木都拉, 等. 放射性肝纤维化的实验研究中TNF-α、NF-κb p65和TGF-β1动态变化及表达意义[J]. 中华放射肿瘤学杂志, 2014, 23(5): 390-391. |
| [4] | 王云莲, 艾尼瓦尔·艾木都拉, 肖蕾,等. 血清转化生长因子β1在大鼠放射性肝纤维化中的动态表达及其相关性研究[J]. 现代生物医学进展, 2014, 14(30): 5829-5832. |
| [5] | Moustakas A, Heldin CH. The regulation of TGF-β signal transduction[J]. Development, 2009, 136(22): 3699-3714. |
| [6] | Paik YH, Kim JK, Lee JI, et al. Celecoxib induces hepatic stellate cell apoptosis through inhibition of Akt activation and suppresses hepatic fibrosis in rats[J]. Gut, 2009, 58(11): 1517-1527. |
| [7] | Xiao YT, Wang J, Chen YW, et al. Up-regulation of miR-200b in biliary atresia patients accelerates proliferation and migration of hepatic stallate cells by activating PI3K/Akt signaling[J]. Cell Signal, 2014, 26(5): 925-932. |
| [8] | 王慧, 任嫱, 陈卫刚, 等. P13K/Akt信号转导通路在硫化氢影响肝星状细胞Ⅰ和Ⅲ型胶原表达中的作用[J]. 中华肝脏病杂志, 2014, 22(6): 430-433. |
| [9] | Lee UE, Friedman SL. Mechanisms of hepatic fibrogenesis[J]. Best Pract Res Clin Gastroenterol, 2011, 25(2): 195-206. |
| [10] | Friedman SL. Hepatic stellate cells:protean, multifunctional,and enigmatic cells of the liver[J]. Physiol Rev, 2008, 88(1): 125-172. |
| [11] | Inagaki Y, Okazaki I. Emerging insights into transforming growth factor β Smad signal in hepatic fibrogenesis[J]. Gut, 2007, 56(2): 284-292. |
| [12] | Campbell JS, Hughes SD, Gilbertson DG, et al. Platelet-derived growth factor C induces liver fibrosis, steatosis, and hepatocellular carcinoma[J]. Proc Natl Acad Sci USA, 2005, 102(9): 3389-3394. |
| [13] | 王云莲, 艾力江·吐尔逊, 艾尼瓦尔·艾木都拉, 等. 结缔组织生长因子在放射性肝纤维化大鼠中动态表达及其与肝星状细胞活化的关系[J]. 中华放射医学与防护杂志, 2014, 34(10): 748-752. |
| [14] | Hsu YC, Lin YL, Chiu YT, et al. Antifibrotic effects of Salvia miltiorrhiza on dimethylnitrosamine-intoxicated rats[J]. J Biomed Sci, 2005, 12(1): 185-195. |
| [15] | Shah R, Reyes-Gordillo K, Arellanes-Robledo J, et al. TGF-β1 up-regulates the expression of PDGF-β receptor mRNA and induces a delayed PI3K-, AKT-, and p70S6K-dependent proliferative response in activated hepatic stellate cells[J]. Alcohol Clin Exp Res, 2013, 37(11): 1838-1848. |
| [16] | Borkham-Karnphorst E, van Roeyen CR, Ostendorf T, et al. Pro-fibrogenic potential of PDGF-D in liver fibrosis[J]. J Hepatol, 2007, 46(6): 1064-1074. |
| [17] | Gabele E, Reif S, Tsukada S, et al. The role of p70S6K in hepatic stellate cell collagen gene expression and cell proliferation[J]. J Biol Chem, 2005, 280(14): 13374-13382. |
| [18] | Gentilini A, Marra F, Gentilini P, et al. Phosphatidylinositol-3 kinase and extracellular signal-regulated kinase mediate the chemotactic and mitogenic effects of insulin-like growth factor-I in human hepatic stellate cells[J]. J Hepatol, 2000, 32(2): 227-234. |
| [19] | Son G, Hines IN,Lindquist J, et al. Inhibition of phosphatidylinositol 3-kinase signaling in hepatic stellate cells blocks the progression of hepatic fibrosis[J]. Hepatology, 2009, 50(5): 1512-1523. |
 2015, Vol. 35
2015, Vol. 35



