2. 石家庄国际和平医院妇产科
宫颈癌是高发的妇科恶性肿瘤,其发病率有升高趋势,且明显趋于年轻化,进一步改善其预后越来越受到关注。近年的肿瘤干细胞(CSC)理论揭示了肿瘤组织内部细胞的异质性,提出CSC是肿瘤无限增殖、复发及转移的根源[1, 2]。自肿瘤干细胞学说提出以来,其放射抗性成为肿瘤疗效的重要影响因素[3]。bcl-2、survivin是凋亡抑制蛋白(IAP)家族成员,具有肿瘤特异性表达的特点,有强大的抗细胞凋亡作用,成为近年来肿瘤研究的热点之一。Oct4是非特异性的干细胞标志物,在干细胞抗凋亡过程中的作用至关重要[4]。本实验拟对抗拒放疗的宫颈癌细胞中表达CD44+/CD24+的细胞进行研究,观察其放疗敏感性及凋亡相关基因的表达,为探讨提高宫颈癌治疗效果提供实验依据。
1. 材料、试剂与仪器:宫颈鳞癌(Siha)细胞系由河北医科大学第四医院科研中心提供。胎牛血清白蛋白(BSA)、RPMI 1640干粉为美国Sigma公司产品;胎牛血清为杭州四季青生物工程公司产品;DNA-ladder 抽提试剂盒购自美国Premega公司;CD24、CD44单克隆抗体购自美国EB公司;RNA提取试剂TRIzol购自美国GIBCO公司。FACS-420型流式细胞仪为美国BD公司产品,直线加速器为美国Varian公司产品。
2. 细胞培养与处理:将Siha细胞常规培养于含10%小牛血清的RPMI 1640培养基中,置于37℃、5%CO2培养箱中孵育,每周传代1~2次,取对数生长期的细胞进行后续的实验。细胞照射:采用直线加速器6 MV X射线,室温下照射对数生长期的Siha细胞,加1.0 cm补偿膜,源靶距100 cm,吸收剂量2 Gy/次,处理后置培养箱中继续培养。待细胞长满培养瓶壁70%~80%时,胰酶消化传代,细胞增殖进入对数生长期时,再次进行照射。
3. 流式细胞术(FCM)法检测CD24+、CD44+细胞含量:选取Siha细胞分为3组,分别给予累计照射剂量为8、16、30 Gy的照射。不同剂量照射组和对照组(不照射)单层细胞用0.25%胰酶和Accutase制备成细胞悬液,计数后调整细胞数量为1×106/组,加入CD44-PE(0.625 μl/样本)和CD24-FITC(0.25 μl/样本)抗体后,轻弹混匀,4℃避光孵育30 min,加2 ml PBS缓冲液,洗涤,1 200×g离心5 min,弃上清,加100~200 μl PBS缓冲液,进行检测,利用流式细胞仪分选得到的4[JP3]个群细胞,即CD44+/CD24-、CD44+/CD24+、CD44-/CD24+和CD44-/CD24-细胞亚群,软件分析数据记录各组细胞百分率。
4. 克隆形成实验:取对数生长期细胞,消化,计数,梯度倍数稀释。将102~105细胞接种于6孔板。贴壁8 h后,给予不同剂量(0、2、4、6、8、10 Gy)照射,常规培养,每隔2天换液,7~10 d终止培养。40 g/L多聚甲醛固定15 min,结晶紫染色20 min,显微镜下计数>50个细胞的克隆数。存活分数(SF)=照射组克隆形成率/对照组克隆形成率。采用GraphPad Prism软件,多靶单击模型拟合剂量存活曲线,分别求出放射生物学参数SF和D0、Dq及N,其中,LogN=Dq/D0。Dq反映细胞亚致死性损伤修复能力的大小,Dq值越大放射抗拒性越强;D0为曲线指数区存活率下降63%所需的剂量,D0越大,放射抗拒性越强;2 Gy照射后存活分数(SF2)越大,放射抗拒性越强。每个剂量设3个复孔,重复3次。
5. 形态学观察细胞凋亡:各组细胞经Hoechst 33258染色液染色5 min,荧光显微镜下观察。按照透射电镜的常规方法制片,透射电镜下观察细胞超微结构变化。
6. 琼脂糖凝胶电泳检测细胞凋亡:将各组细胞经过不同剂量射线处理后,提取细胞核中的DNA。严格按DNA提取试剂盒(美国Promega公司)步骤操作。取出DNA溶液5 μl,加入等量1×DNA上样缓冲液,进行1.5%琼脂糖凝胶电泳,80 V 30 min,紫外凝胶成像仪拍照。
7. 流式细胞仪检测细胞凋亡:分别收集各组细胞,制备成单细胞悬液,将细胞悬液收入5 ml试管中,840×g离心15 min,PBS液清洗3次,相同方法再次离心。70%乙醇4℃固定。RNaseA 31℃水浴30 min,碘化丙啶(PI)染色,用流式细胞分析仪做凋亡细胞分析。数据用Modfit 1.0软件计算凋亡细胞比例。
8. 反转录-聚合酶链反应(RT-PCR)技术检测bcl-2、survivin、Oct4 mRNA的表达:收集各实验组细胞,按TRIzol试剂盒说明书抽提细胞总RNA,取450 ng反转录成cDNA,以此为模板进行PCR扩增,采用20 μl反应体系: 2×Ultra SYBR Mixture 10 μl,PCR上、下游引物各0.4 μl,cDNA模板2 μl,加入灭菌蒸馏水至20 μl。bcl-2基因引物序列,上游:5' GCCTTCTTTGAGTTCGGTGGG 3',下游:5' TGCCGG[JP3]TTCAGGTACTCAGTCATC 3',扩增产物107 bp;survivin基因引物序列,上游:5' GAAGGCTGGGAGCCAGAT[JP2]GACG 3',下游:5' GGAAAGCGCAACCGGACGAA 3',扩增产物136 bp;Oct4基因引物序列,上游:5' CAGAAGGGCAAGCGATCAAG 3',下游:5' GGGCCAGAGGAAAGGACACT 3',扩增产物100 bp;以GAPDH基因为内参照,引物序列,上游:5' CCTCTGACTTCAACAGCGACAC 3',下游:5' TGGTCCAGGGGTCTTACTCC 3',扩增产物174 bp。PCR反应条件为:95℃预变性15 s; 60℃ 20 s,45个循环。实验所获得的数据采用2-△△Ct进行相对定量计算公式。
9. 统计学处理:数据以 ± s表示,每组实验重复3次。采用SPSS 11.5软件包进行统计学分析。计量资料两组间比较,满足正态分布、方差齐采用t检验;满足正态分布但方差不齐,采用t'检验。计量资料多组间比较,满足正态分布、方差齐,采用单因素方差分析,采用SNK法进行多重比较。P< 0.05为差异有统计学意义。
± s表示,每组实验重复3次。采用SPSS 11.5软件包进行统计学分析。计量资料两组间比较,满足正态分布、方差齐采用t检验;满足正态分布但方差不齐,采用t'检验。计量资料多组间比较,满足正态分布、方差齐,采用单因素方差分析,采用SNK法进行多重比较。P< 0.05为差异有统计学意义。
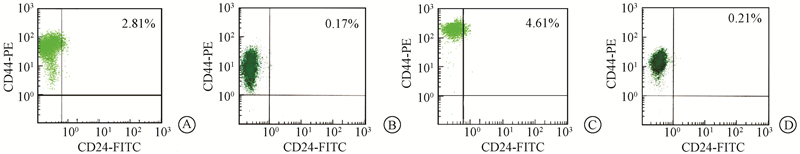
1. 流式细胞术检测CD44及CD24蛋白表达:3组Siha细胞中CD44和CD24的表达如图1所示。与对照组比较,接受8 Gy照射的细胞表达Siha CD44+/CD24+的比例未见明显变化(P>0.05);而当剂量达16 Gy时,表达Siha CD44+/CD24+细胞比例由对照组的(0.17±0.05)%升高为(2.81±0.13)%;当吸收剂量达30 Gy时,表达Siha CD44+/CD24+细胞比例由对照组的(0.21±0.05)%上升到(4.61±0.13)%,差异有统计学意义(F=1 788.67,P < 0.05)。
|
图 1 不同剂量射线照射前后Siha细胞中CD44+/CD24+的细胞比例 A.16 Gy照射后,实验组中Siha CD44+/CD24+细胞比例;B.对照组中Siha CD44+/CD24+细胞比例;C.30 Gy照射后,实验组中Siha CD44+/CD24+细胞比例;D.对照组中Siha CD44+/CD24+细胞比例 |
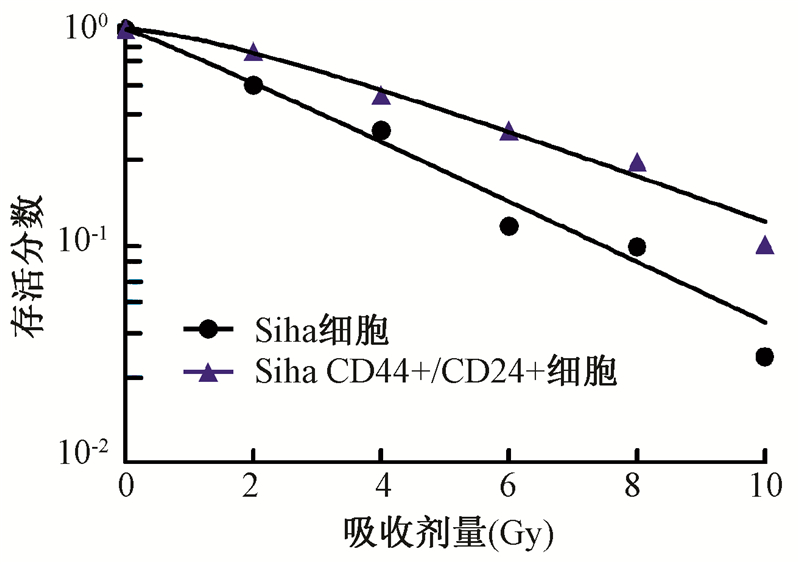
2. Siha CD44+/CD24+细胞和Siha细胞放射敏感性差异:Siha CD44+/CD24+细胞不同剂量照射后的存活分数明显高于Siha细胞。细胞存活曲线如图2所示。多靶单击模型中,Siha CD44+/CD24+细胞与Siha细胞相比,D0(4.02±0.08 vs. 3.11±0.11),差异有统计学意义(t=400.45,P < 0.05);Dq(1.91±0.12 vs. 0.34±0.21),差异有统计学意义(t=93.99,P < 0.05)。说明Siha CD44+/CD24+细胞比Siha细胞对射线抗拒。
|
图 2 两种细胞不同剂量照射后多靶单击模型拟合的剂量存活曲线 |
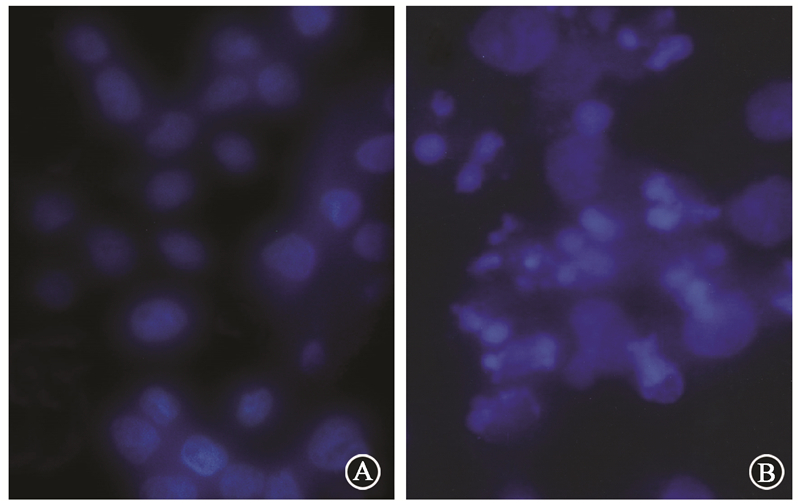
3. Hoechst 33258染色荧光显微镜观察:Siha细胞经30 Gy照射后48 h细胞凋亡形态学变化如图3所示。累计吸收剂量达30 Gy,受照细胞继续培养48 h后,可见大部分Siha CD44+/CD24+细胞保持正常形态,活细胞所发荧光弱而均匀。而Siha细胞出现明显的凋亡变化,细胞核明显固缩变小,并可见致密强荧光,部分染色质边缘化或成碎块状,出现典型的凋亡小体。
|
图 3 Siha细胞经30 Gy射线照射后48 h细胞凋亡形态学变化Hoechst 33258染色×400 A.Siha CD44+/CD24+细胞;B.亲代Siha细胞 |
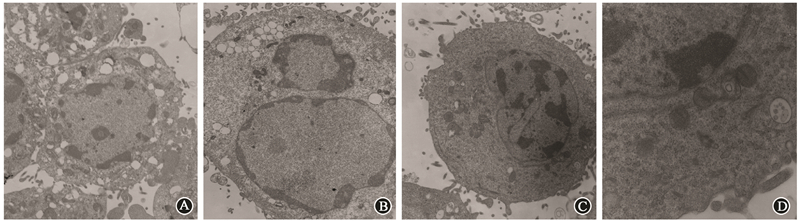
4. X射线照射后细胞超微结构的变化:Siha细胞经30 Gy照射后48 h细胞凋亡透射电镜下形态学变化如图4所示。累计吸收剂量达30 Gy后,受照细胞透射电镜下可见部分亲代Siha细胞呈现较为典型的凋亡超微形态学改变:核染色质浓缩、边集,核膜厚薄不均,部分细胞膜球形膨出,细胞表面微绒毛减少;而Siha CD44+/CD24+细胞则未呈现出凋亡的形态学改变。
|
图 4 Siha细胞经30 Gy射线照射后48 h细胞凋亡透射电镜下形态学变化 A.亲代Siha细胞×5 000;B.亲代Siha细胞×15 000;C.Siha CD44+/CD24+细胞×5 000;D.Siha CD44+/CD24+细胞×15 000 A.亲代Siha细胞×5 000; |
5. 琼脂糖凝胶电泳梯状DNA检测结果:琼脂糖凝胶电泳结果如图5所示。结果显示,当吸收剂量达30 Gy后,Siha细胞出现相差180~200 bp的特征性凋亡DNA梯状条带,而Siha CD44+/CD24+细胞未出现明显DNA凋亡片段,仅在接近点样处出现基因组大分子条带。
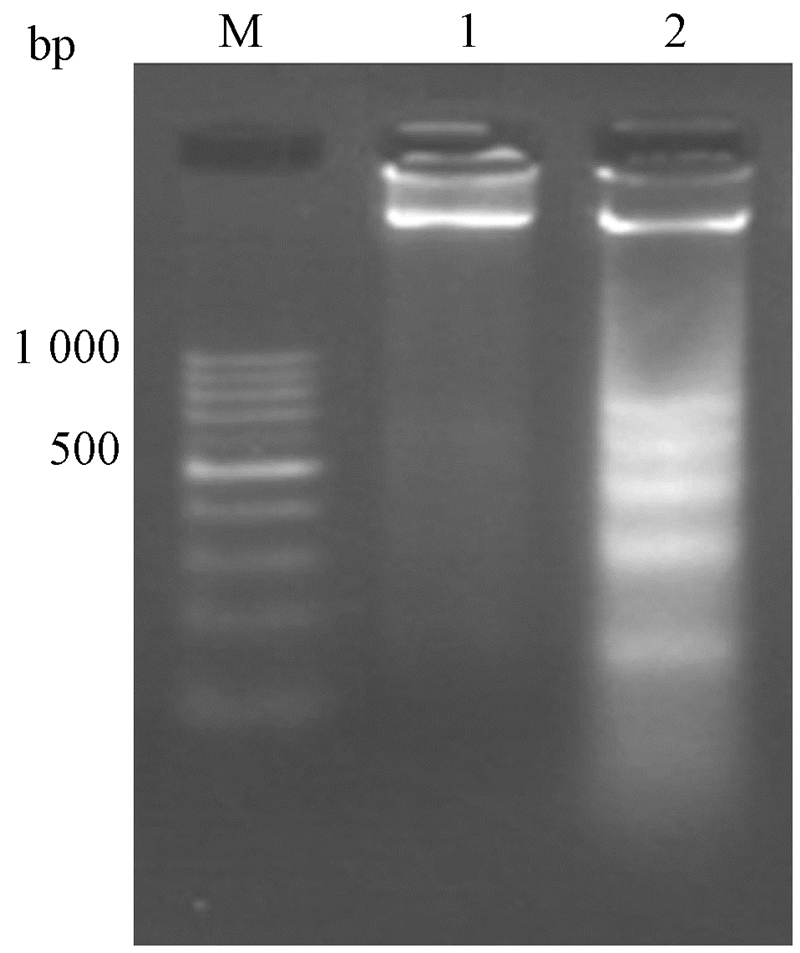
|
图 5 Siha CD44+/CD24+和Siha细胞经30 Gy照射后48 h DNA电泳结果 注:M.Marker;1.Siha CD44+/CD24+细胞;2.Siha细胞 |
6. 流式细胞术检测细胞凋亡率:FCM检测结果显示:当吸收剂量达30 Gy后,Siha CD44+/CD24+细胞与Siha细胞凋亡率分别为(0.37±0.05)%和(35.59±0.31)%,差异有统计学意义(t=841.01,P < 0.01)。Siha细胞在细胞周期G1期前出现亚二倍体的凋亡峰,而Siha CD44+/CD24+细胞无明显凋亡峰出现。
7. 凋亡相关基因的表达:经30 Gy照射后,Siha CD44+/CD24+细胞中bcl-2、survivin、Oct4基因表达水平明显高于亲代Siha细胞,差异具有统计学意义(t=221.35、941.65、82.27,P < 0.01,图6)。
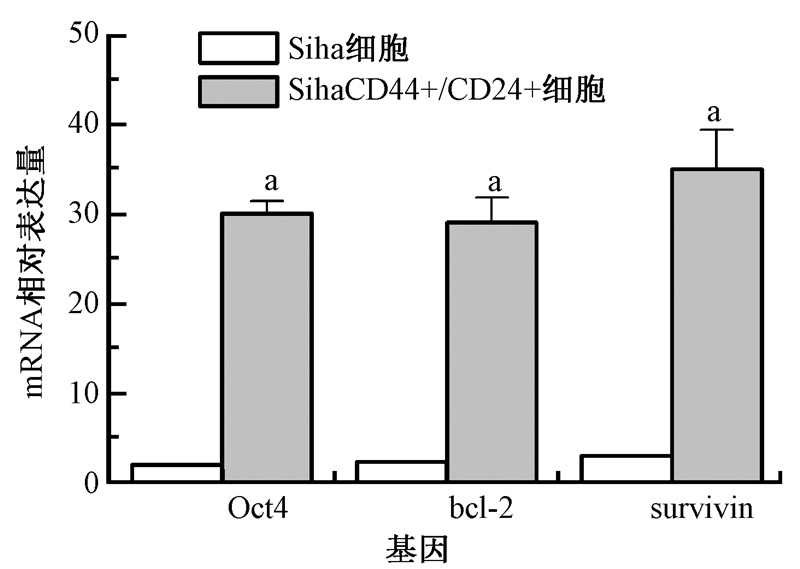
|
图 6 Siha CD44+/CD24+和Siha细胞经累计剂量为30 Gy照射后48 h Oct 4、bcl-2和survivin的mRNA表达 注:a与Siha细胞同一基因比较,t=221.35、941.65、82.27,P < 0.01 |
宫颈癌放疗失败的主要原因是局部未控或远处转移,而宫颈癌根治性放疗后复发的再放疗疗效较差,以上两种情况均与辐射耐受有关。肿瘤干细胞理论认为,肿瘤是CSC无限增殖的结果,CSC具有自我更新、多向分化和体内外形成肿瘤的能力,而non-CSC增殖能力很弱。CSC只占肿瘤组织的极少部分,但却有着强大的致瘤性、转移性和放疗抵抗性。研究显示,肿瘤干细胞很可能是复发后肿瘤细胞产生放射抗拒性的原因。Singh等[5]在脑瘤中分离纯化出肿瘤干细胞,并提示CD133+细胞是脑肿瘤干细胞;Bao等[6]研究发现,胶质母细胞瘤经过放射治疗后,CD133+细胞富集,且无论是体外细胞培养还是体内肿瘤细胞异种移植,CD133+细胞比率越高,经过射线照射后的肿瘤细胞存活率也越高。可见脑肿瘤的辐射耐受是由脑肿瘤干细胞造成。Al-Hajj等[7]在乳腺癌中通过特异性细胞表面标志分离纯化出乳腺癌干细胞。但到目前为止,有关宫颈癌的肿瘤干细胞研究尚不多见,对于放疗抗拒性的相关研究则更少。
细胞凋亡途径受到异常阻滞不仅是恶性肿瘤发生、发展的重要环节,也是影响肿瘤细胞对化学治疗和放射治疗耐受的重要因素之一。射线通过损伤细胞的DNA,影响细胞的增殖状态,改变细胞周期的分布,最终引起细胞的死亡或者凋亡。本实验通过逐步递增照射剂量,发现随着放疗剂量的增加,表达CD44+/CD24+的细胞比例逐渐升高。通过克隆形成实验、单击多靶模型拟合细胞存活曲线研究表达CD44+/CD24+的细胞放疗抵抗性,结果显示,Siha CD44+/CD24+细胞的SF2、D0、Dq及N值均高于亲代细胞,说明此类细胞比亲代细胞更具放射抗拒性。凋亡的形态学研究实验发现,经射线照射后,Siha CD44+/CD24+细胞未出现明显的凋亡改变。琼脂糖凝胶电泳梯状DNA检测仅在亲代细胞中出现特征性凋亡DNA梯状条带。通过流式细胞术检测发现,照射后Siha CD44+/CD24+细胞的凋亡率明显低于亲代细胞。由上述实验结果可以得出,表达CD44+/CD24+的细胞抗拒放射诱导的细胞凋亡,可能是其抗拒放疗的机制之一。
bcl-2是一种膜结合蛋白,主要分布于核膜、内质网膜和线粒体外膜。研究表明,bcl-2基因是许多病理、生理过程中调节凋亡的关键性因子,是凋亡的抑制基因,而且在X射线诱导的凋亡过程中具有重要作用[8]。survivin基因是调亡抑制蛋白家族(AIP)中的一个重要成员,在绝大多数肿瘤组织内survivin呈高表达,并与许多肿瘤的病程发展、预后及复发相关[9]。研究发现,survivin直接作用于凋亡通路最下游的效应分子Caspase-3和Caspase-7,具有强大的抗凋亡作用[10, 11, 12, 13],表明肿瘤细胞中survivin的高表达极可能影响肿瘤细胞对放射治疗的敏感性。Oct4是胚胎和生殖细胞肿瘤中常见的一种干细胞相关基因,作为一种重要的转录因子,它不仅在胚胎干细胞的调控中,也在干细胞抗凋亡过程中发挥重要的作用[14]。本研究通过实时定量PCR法检测了上述3个基因在Siha和Siha CD44+/CD24+细胞中的表达水平,发现其在放射抗拒性细胞Siha CD44+/CD24+中的含量均比其在亲本细胞Siha中的含量显著升高。
尽管放疗技术的不断提高,但基于肿瘤干细胞的放疗迄今尚无实质性进展。目前,治疗复发和转移宫颈癌的瓶颈在于放疗的不良反应和治疗缺乏肿瘤特异性。基于以上研究,认为表达CD44+/CD24+的宫颈癌细胞抗拒放射诱导的细胞凋亡是肿瘤干细胞的部分特性,但该细胞是否具备干细胞的其他特性还有待进一步研究。
| [1] | Bernards R.Cancer: cues for migration[J].Nature, 2003, 425(6955): 247-248. |
| [2] | Leth-Larsen R, Terp MG, Christensen AG, et al. Functional heterogeneity within the CD44 high human breast cancer stem cell-like compartment reveals a gene signature predictive of distant metastasis[J]. Mol Med, 2012, 18: 1109-1021. |
| [3] | 丁丽娟, 董丽华, 王树东, 等. 肿瘤干细胞辐射抗性及相关的调控信号通路[J]. 中华放射医学与防护杂志, 2015, 35(4): 316-320. |
| [4] | Guo Y, Mantel C, Hromas RA, et al. Oct-4 is critical for survival/antiapoptosis of murine embryonic stem cells subjected to stress: effects associated with stat3/survivin[J]. Stem Cells, 2008, 26(1):30-34. |
| [5] | Singh SK, Clarke ID, Terasaki M, et al.Identification of a cancer stem cell in human brain tumors[J].Cancer Res, 2003, 63(18): 5821-5828. |
| [6] | Bao S, Wu Q, McLendon RE, et al.Glioma stem cells promote radioresistance by preferential activation of the DNA damage response[J].Nature, 2006, 444(7120): 756-760. |
| [7] | Al-Hajj M, Wicha MS, Benito-Hernandez A, et al.Prospective identification of tumorigenic breast cancer cells[J].Proc Natl Acad Sci USA, 2003, 100(7):3983-3988. |
| [8] | Martin SJ, Green DR. Apoptosis and cancer: the failure of controls on cell death and cell survival[J]. Crit Rev Oncol Hematol, 1995, 18(2): 137-153. |
 2015, Vol. 35
2015, Vol. 35


