据统计,临床约50%的肿瘤患者接受了放射治疗,但放疗后的不良反应较多[1]。大部分腹盆腔肿瘤患者接受放疗后,除出现全身性乏力、困倦等表现外,还伴有受照局部黏膜炎症和放射性肠炎等症状。特别是核与辐射事故受照者出现以感染性肠炎为特征的厌食、恶心、呕吐、腹泻和血便等症状尤为常见[2, 3]。既往研究主要从组织病理学角度揭示电离辐射直接对肠黏膜机械屏障的损害效应,包括对肠上皮的增殖、修复的影响,及其与放疗患者不良反应的关联性[4],但不能充分解释放疗患者受到不足以破坏肠黏膜组织结构的较小剂量照射而发生炎症,甚至感染性肠炎等现象。因此,本研究以小鼠为实验对象,模拟临床患者腹盆腔放疗,探讨放疗照射对肠道微生态(即菌群组成结构及相互关系)和微生态与肠黏膜内稳态的影响,以及放疗诱发炎症或感染发生的可能机制,为有效预防和治疗放疗不良反应提供实验依据。
1.主要试剂:TRIzol试剂购自美国Invitrogen公司;RT-PCR试剂盒和Real-Master-Mix(SYBR Green)试剂盒购自日本TaKaRa公司;血液、淋巴结和回肠内容物DNA的提取试剂盒均购自美国Qiagen公司。
2.实验动物与照射方式:SPF级BALB/c 小鼠24只,雌雄各半,6周、体重20~21 g,由本校实验动物中心提供,许可证号:SCXK(渝)2012-0003。小鼠按随机数字表法分为健康对照组、照射3周组、照射5周组、照射6周后停照1周组,每组6只。采用第三军医大学西南医院肿瘤放疗中心直线加速器(6 MeV,德国西门子公司)为放射源。照射方式:麻醉小鼠背卧平放固定,以1 cm厚带孔(1 cm×1 cm)铅板为放射栅,固定照射野(剑状软骨突起下沿与耻骨上沿间的腹部正中区域)[5],源皮距1 m,吸收剂量率2.0 Gy/min,吸收剂量2.0 Gy/d,连续照射5 d/周,连续照射3周、5周或6周。健康对照组小鼠未接受照射。
3.样本收集:定时选用CO2窒息方式固定小鼠,无菌操作剖开腹腔,采集心脏血液(约0.2 ml)和肠系膜淋巴结,用作细菌DNA含量检测。同时收集回肠中段约3.0 cm肠管内容物(约0.5 g),迅速冻存于-80℃以用做微生态分析;并且收集约1.0 cm肠管组织(冰预冷,PBS冲冼3次)于-80℃冻存作基因表达分析。
4.实时荧光定量RT-PCR:参照TRIzol试剂说明书提取组织总RNA。以500 ng总RNA为模板,Oligo dT为引物,RT-PCR试剂盒推荐反应条件与体系(25 μl)获得反转录cDNA。在定量PCR仪(美国Bio-Rad公司)中进行实时PCR分析。按照参考文献[6]的方法,反应体系25 μl/孔(3个平行孔/样本),0.5 μl cDNA/孔为模板,基因上下游引物工作浓度均为0.4 μmol/L;反应条件为95℃,10 min;95℃,30 s;58℃,60 s;45个循环。引物序列列于表1,并见文献[6, 7, 8, 9]。
| 表1 引物序列表 |
荧光定量PCR数据分析:定量PCR数据采用比较Ct值方法[10],以β-肌动蛋白为内参抗体,依据公式计算目的基因的相对表达量;采用Bio-Rad CFX 3.0软件采集数据。目的基因mRNA的表达变化以相对量表示,即以健康对照组样本中靶基因mRNA表达量作为参比对照(定为1),其他样本中的均为对照样本的倍数。
5.血液和淋巴结组织中细菌DNA的检测:DNA提取参考试剂盒说明进行,按参考文献[8]方法,PCR反应体系:以20 ng 总DNA为模板,反应条件为95℃,3 min;95℃,30 s;60℃,15 s;72℃,20 s;30个循环;72℃,5 min。琼脂糖凝胶电泳检测,特异条带胶回收并测序,在线Genbank序列比对分析(PCR 引物序列,表1)。
6.肠道细菌微生态的检测与分析:肠内容物菌群总DNA的提取参考Tsai和Olson[9]建立的方法。PCR反应条件:95℃,5 min;94℃,30 s;56℃,30 s;72℃,1 min;40个循环;72℃,7 min。变性梯度凝胶电泳(denatured gradient gel electrophoresis,DGGE)分析参照Muyzer等[10]方法,即选用8%聚丙烯胺凝胶(含40%体积百分比甲酰胺和7 mol/L尿素),在DCodeTM 核酸碱基突变检测仪(美国Bio-Rad公司)中电泳,硝酸银染色。凝胶电泳采用Quantity One(美国Bio-Rad公司)软件进行条带数、多样性和非加权配对聚类分析(unweighted pair-group method with arithmetic means,UPGMA)。
变性梯度凝胶电泳特殊条带的测序与分析:回收特异DNA条带,重新PCR扩增(引物见表1),再回收纯化单一条带DNA,委托上海英骏公司测序,在线Genbank序列比对分析。
7.统计学处理:数据以 ± s表示。采用SPSS 13.0软件统计分析数据,两组间数据比较采用独立样本t检验。P< 0.05为差异有统计学意义。
± s表示。采用SPSS 13.0软件统计分析数据,两组间数据比较采用独立样本t检验。P< 0.05为差异有统计学意义。
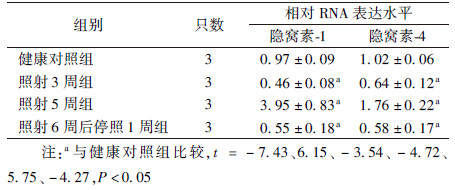
1.腹盆腔放疗模拟照射小鼠回肠隐窝素-1和-4的表达变化:潘氏细胞抗菌肽的表达列于表2。与健康对照组相比,照射3周组和照射6周后停照1周组小鼠回肠隐窝素-1和-4均呈现显著性地降低(t=-7.43、-3.54、-4.72、-4.27,P< 0.05);而照射5周组,隐窝素-1和-4均呈现显著性高表达(t=6.15、5.75,P<0.05)。结果提示,腹盆腔放疗模拟照射诱发了小鼠肠道潘氏细胞抗菌肽表达异常、功能紊乱,导致肠道固有免疫功能失衡。
表2 模拟腹盆腔放疗照射对小鼠回肠隐窝素-1和隐窝素-4表达的影响( ± s) ± s)
|
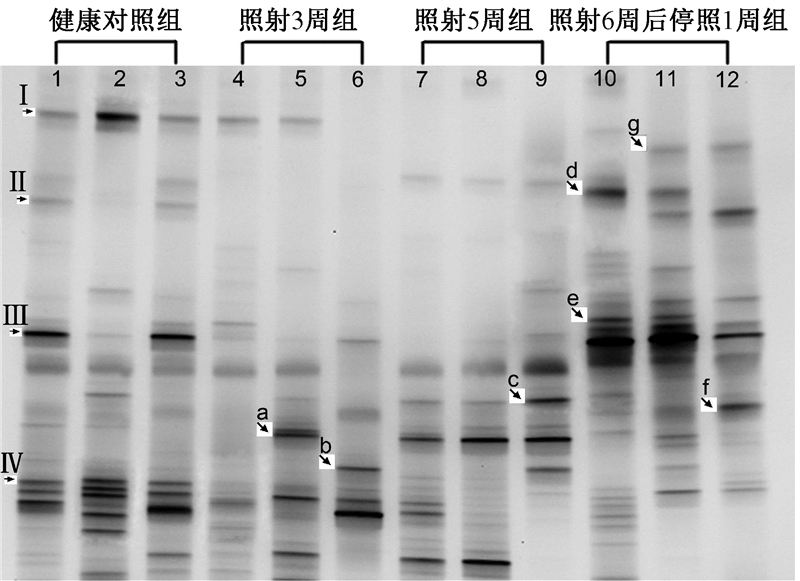
2.照射后小鼠回肠微生态的变化:针对细菌16S RNA V1~V3区引物的变性梯度凝胶图谱,见图1。健康对照组、照射3周组、照射5周组和照射6周后停照1周组小鼠回肠中的平均菌属条带数分别为(23.7±2.3)、(15.3±4.6)、(15.0±3.0)和(17.7±6.4)个。与健康对照组比较,其余3组菌属条带不仅位置有明显变化,且照射3周组和照射5周组的菌属带数量明显减少(t=-2.80、-3.98,P< 0.05)。结果表明,照射后微生态的结构组成和多样性出现明显改变。受照3周后有一些菌属条带消失(图1箭头Ⅰ、Ⅱ、Ⅲ和Ⅳ),同时出现一些新的菌属条带(图1箭头a~g)。测序分析表明,照射中不同程度消失的条带对应的最相似菌属分别为:拟杆菌属(相似度97%);乳酸杆菌属(相似度91%);芽胞拟杆菌属(相似度98%);片球菌属(相似度90%)。照射诱发出现的优势菌属带分别为:a.梭状芽胞杆菌属(相似度93%);b.大肠埃希菌属(相似度98%);c.芽胞杆菌属(相似度91%);d.尿肠球菌属(相似度98%);e.丹毒丝菌属(相似度89%);f.扭链瘤胃球菌属(相似度97%);g.弗氏志贺氏菌属(相似度95%)。
|
图 1 腹盆腔模拟放疗小鼠回肠细菌微生物区系16S RNA V1~V3区引物的变性梯度凝胶电泳图谱 注:Ⅰ、Ⅱ、Ⅲ和Ⅳ为受照3周后消失的条带;a~g.新出现的优势细菌属条带。a.梭状芽胞杆菌属;b.大肠埃希菌属;c.芽胞杆菌属;d.尿肠球菌属; e.丹毒丝菌属;f.扭链瘤胃球菌属;g.弗氏志贺氏菌属。1~12分别表示同组内每2只小鼠小肠内容物的混合物,共24只 |
凝胶电泳UPGMA结果显示,4组小鼠的DGGE图谱基本可以各聚为一簇,表明照射处理诱发了小鼠肠道菌群多样性的明显改变;同组内个体间肠道菌群的相似性分别为健康对照组85.6%、照射3周组57.5%、照射5周组72.5%和照射6周后停照1周组64%。放疗处理3周和5周组小鼠的聚类分析出现部分叠加,表明照射3周以后小鼠肠道菌群多样性的持续变化不明显。
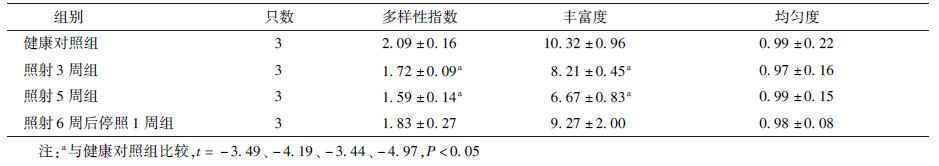
不同处理组小鼠小肠细菌微生物区系的总体多样性指数分析列于表3。与健康对照组比较,照射3周组和照射5周组的DGGE图谱条带减少,其多样性和丰富度显著降低(t=-3.49、-4.19、-3.44、-4.97,P< 0.05);而照射6周后停照1周组小鼠回肠微生态的多样性和丰富度则仍低于健康对照组,结果差异无统计学意义(P>0.05)。不同处理组小鼠肠道微生态的均匀度无明显差异。
| 表3 模拟放疗处理组小鼠回肠菌群V1~V3区引物变性梯度凝胶电泳图谱的微生态分析 |
3.照射小鼠肠源性细菌移位检测:肠系膜淋巴结和血液中细菌DNA含量列于表4。由表4可知,腹盆腔受照小鼠出现细菌移位率明显增高,淋巴结中细菌总DNA阳性率高达58.8%(10/17),健康对照组仅为16.7%(1/6);受照的3组血液阳性率高达41.1%(7/17),而健康对照组仅0(0/6)。多数淋巴结细菌DNA阳性的受照小鼠血清也呈现阳性(各组中分别有1只除外)。PCR扩增条带测序鉴定为大肠埃希菌(10只)、弗氏志贺氏菌(5只)、空肠弯曲杆菌(3只)、金黄色葡萄球菌(1只)。
| 表4 细菌DNA在受照小鼠肠系膜淋巴结和血液中的移位状况 |
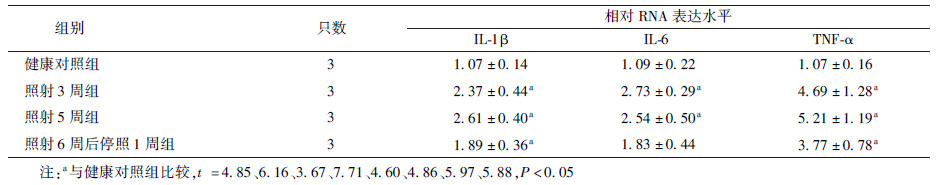
4.腹盆腔放疗小鼠回肠组织IL-1β、IL-6和TNF-α的表达变化:小肠组织3种炎性细胞因子的表达变化列于表5。与健康对照组比较,受照3周或5周后回肠IL-1β、IL-6和TNF-α的mRNA表达均出现明显提高(t =4.85、6.16、7.71、4.60、4.86、5.97,P < 0.05)。与照射3周和5周组相比,照射6周后停照1周组小鼠的表达量有所下降,但IL-1β和TNF-α仍然显著高于健康对照组(t=3.67、5.88,P <0.05)。结果显示,受照后小鼠肠道呈现持续性炎症反应。
| 表5 模拟腹盆腔放疗照射对小鼠回肠IL-1β、IL-6和TNF-α转录表达的影响 |
目前放疗技术虽有重大进展,但放疗的不良反应仍是当前远未解决的难题之一。文献指出,有80%~90%的腹盆腔肿瘤放疗患者经受胃肠道功能失调,其中约50%伴发胃肠综合征[3, 4, 5, 6, 7, 8, 9, 10, 11, 12]。原因在于除肿瘤靶组织受照诱发的一系列病理反应外,可能还与腹盆腔放疗过程中小肠等敏感组织遭受不必要照射有关。如何预防或减轻放疗诱发的胃肠道不良反应,一直是放疗实践和辐射安全领域的重要课题。本研究从肠道天然防御素与微生态视角,发现模拟腹盆腔放疗照射可诱发肠道天然免疫功能紊乱和微生态失调,导致细菌移位率和肠源性感染的发生率提高。研究结果可为有效地预防或减轻放射性肠炎提供新的理论认识和新策略。
腹盆腔放疗消化道不良反应可分为短期效应(急性反应)和晚期效应(亚急性反应)[6]。前者主要发生在放疗前3周,以肠上皮凋亡、黏膜急性坏死、脱落等病理变化及消化道功能紊乱为特征;后者主要发生在放疗第4周以后,以受照组织局部溃疡、慢性萎缩与纤维化等病理改变和慢性便血、大便失禁等临床表现为特点。研究证实,放射黏膜炎发生的程度与受照剂量大小、射线种类与剂量率和照射方式密切相关。其原因主要是肿瘤靶组织和癌旁细胞对电离辐射的反应结局[13]。Crawford和Gordon[14]研究发现,肠道微生态在生理条件下具有调节肠道黏膜免疫内稳态平衡的重要作用,但在病理条件下参与了放射性肠炎发生与发展的过程。
Manichanh等[15]研究显示,患者放疗前肠道微生态的失调决定了放疗后腹泻的发生及严重程度。本研究按标准腹盆腔放疗方案照射正常小鼠,结果证实照射3周即诱发了肠道微生态多样性和丰富度的显著性降低,并且菌群的失调状态持续较长时间,直至照射周期结束后的1周仍未恢复正常。实验揭示了照射诱发的微生态失调主要以乳酸杆菌等益生菌减少,梭状芽胞杆菌和大肠埃希菌等条件性致病菌增多为特征。本研究提示放疗可诱发正常菌群的失调,进一步解释了部分患者放疗后出现腹泻的可能原因。同时,也进一步解释了放疗后肠道促炎因子IL-1β、IL-6和TNF-α等表达增强的可能原因为大肠杆菌等病原菌成分激活了经典的NF-κB信号通路[6]。
放疗照射诱发肠道微生态失调主要可能在于以下两种原因:一方面,电离辐射射线直接作用于肠腔内的微生态;另一方面,受照后菌群与肠黏膜间共生相互作用的平衡拮抗机制被打破。研究表明,潘氏细胞在肠黏膜固有免疫的内稳态中扮演着重要的角色[16],其表达分泌的多种抗菌肽和杀菌酶不仅是阻制肠腔细菌入侵黏膜的“防卫军”,更是微生态稳态的“调控者”[7]。本研究首次证实放疗照射诱发肠道防御素表达紊乱。隐窝素-1和隐窝素-4表达量的显著性降低至少可部分地解释放疗后一些条件致病菌迅速繁殖为优势菌群的原因[7]。防御素的表达变化提示了放疗照射诱发了潘氏细胞的功能改变。Gorbunov和Kiang[17]的研究表明,γ射线全身照射促进了小肠潘氏细胞自噬的发生。潘氏细胞对射线诱发的自噬反应可能是一种生存机制,也可能是一种死亡方式。本研究显示,在照射5周时隐窝素表达升高的现象,可能是潘氏细胞对射线照射的适应性反应,也可能是其对紊乱菌群刺激的周期性保护反应[17],但具体机制尚待进一步研究。
总之,本研究表明,腹盆腔放疗照射可诱发肠道防御素表达紊乱,引起肠道微生态失调,进而导致肠源性细菌移位与感染及肠炎的发生。研究显示,肠道微生态的调节可能成为预防或减轻放射性肠炎的有效策略。
| [1] | Abayomi J, Kirwan J, Hackett A. The prevalence of chronic radiation enteritis following radiotherapy for cervical or endometrial cancer and its impact on quality of life [J]. Eur J Oncol Nurs, 2009, 13(1): 262-267. |
| [2] | Theis VS, Sripadam R, Ramani V, et al. Chronic radiation enteritis [J]. Clin Oncol, 2010, 22(1): 70-83. |
| [3] | 江波, 陈杰, 张达光, 等. 自适应放疗研究现状及进展[J]. 中华放射医学与防护杂志, 2014, 34(1): 73-75. |
| [4] | Matsuzaki-Horibuchi S, Yasuda T, Sakaguchi N, et al. Cell-permeable intrinsic cellular inhibitors of apoptosis protect and rescue intestinal epithelial cells from radiation-induced cell death [J]. J Radiat Res, 2015, 56(1): 100-113. |
| [5] | MollàM, Panés J, Casadevall M, et al. Influence of dose-rate on inflammatory damage and adhesion molecule expression after abdominal radiation in the rat [J]. Int J Radiat Oncol Biol Phys, 1999, 45(4): 1011-1018. |
| [6] | Ong ZY, Gibson RJ, Bowen JM, et al. Pro-inflammatory cytokines play a key role in the development of radiotherapy-induced gastrointestinal mucositis [J]. Radiat Oncol, 2010, 5(1): 22-30. |
| [7] | Karlsson J, Pütsep K, Chu H, et al. Regional variations in paneth cell antimicrobial peptide expression along the mouse intestinal tract [J]. BMC Immunol, 2008, 9(2): 37-48. |
| [8] | Gómez-Hurtado I, Santacruz A, PeiróG, et al. Gut microbiota dysbiosis is associated with inflammation and bacterial translocation in mice with CCl4-induced fibrosis [J]. PLoS One, 2011, 6(7): e23037. |
| [9] | Tsai YL, Olson BH. Detection of low numbers of bacterial cells in soils and sediments by polymerase chain reaction [J]. Appl Environ Microbiol, 1992, 58(5): 754-757. |
| [10] | Muyzer G, de Weel EC, Uitterlinden AG. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J]. Appl Environ Microbiol, 1993, 59(3): 695-700. |
| [11] | 谭伟,尹姣姣,周丽君,等. 60Coγ射线对盐诱导激酶2的诱导表达作用[J].中华放射医学与防护杂志, 2014, 34(1): 22-25. |
| [12] | Khalid U, McGough C, Hackett C, et al. A modified inflammatory bowel disease questionnaire and the vaizey incontinence questionnaire are more sensitive measures of acute gastrointestinal toxicity during pelvic radiotherapy than rtog grading [J]. Int J Radiat Oncol Biol Phys, 2006, 64(5): 1432-1441. |
| [13] | Knutsen A, Adell G, Sun XP. Inflamatory infiltration, fibrosis, necrosis and mucinous content is relation to clinicopathological and molecular factors in rectal cancers with or without preoperative radiotherapy [J]. Oncol Rep, 2006, 16(2): 321-327. |
| [14] | Crawford PA, Gordon JI. Microbial regulation of intestinal radiosensitivity[J]. P Natl Acad Sci USA, 2005,102(37): 13254-13259. |
| [15] | Manichanh C, Varela E, Martinez C, et al. The gut microbiota predispose to the pathophysiology of acute postradiotherapy diarrhea [J]. Am J Gastroenterol, 2008, 103(7): 1754-1761. |
| [16] | Roth S, Franken P, Sacchetti A, et al. Paneth cells in intestinal homeostasis and tissue injury [J]. PLoS One, 2012, 7(6): e38965. |
| [17] | Gorbunov NV, Kiang JG. Up-regulation of autophagy in small intestine paneth cells in response to total-body gamma-irradiation [J]. J Pathol, 2009, 219(2): 242-252. |
 2015, Vol. 35
2015, Vol. 35