直肠癌全系膜切除术(TME)联合术前或术后同步放化疗是局部晚期直肠癌的标准治疗方法[1, 2],局部复发率明显降低。但是仍有5%~15%的患者局部复发,且一旦复发治疗是棘手的[3]。复发后手术完全切除是长期生存的重要预后因素,但由于既往治疗导致盆腔纤维化完全切除的比例并不高,有较高的死亡率及严重并发症[4, 5, 6]。行二次切除的患者占30%~50%,其中能达到完全切除的不足50%[7, 8]。对于不能手术患者,首选仍是局部放疗。目前局部放疗的剂量一般在50~55 Gy,且多采用1.8~2.0 Gy/次的常规分割,提高单次分割及总剂量是否提高局部控制率(LC)、总生存率(OS)及与预后相关性,文献报道不多。本研究对直肠癌局部复发不能再次手术,采用累及野超常规大分割高剂量照射,同步口服卡培他滨的近期疗效及影响疗效的相关因素进行分析。
1. 一般临床资料:回顾性分析本院2006年1月至2013年1月收治的52例术后局部复发直肠癌患者,接受超常规大分割照射,同步口服卡培他滨治疗的疗效。其中男39例,女13例,中位年龄62岁(28~87岁)。既往手术采用前切术(AR)46例,腹会阴联合切除术(APR)6例。原发肿瘤距肛缘中位距离5 cm(2~13 cm)。接受过盆腔放疗的14例,其中9例术前放疗,5例术后放疗,剂量45~50 Gy/25次,复发时间13~18个月;其余38例未接受过放疗。复发时不能或拒绝接受再次手术切除,复发时不伴盆腔外的转移。吻合口复发40例,骶前22例,瘤床20例,区域淋巴结12例,会阴区4例。患者的其他临床资料列于表1。单一部位复发22例,其中吻合口17例,瘤床2例,骶前2例,区域淋巴结1例。该研究经北京军区总医院伦理委员会讨论批准,患者均签署知情同意书。
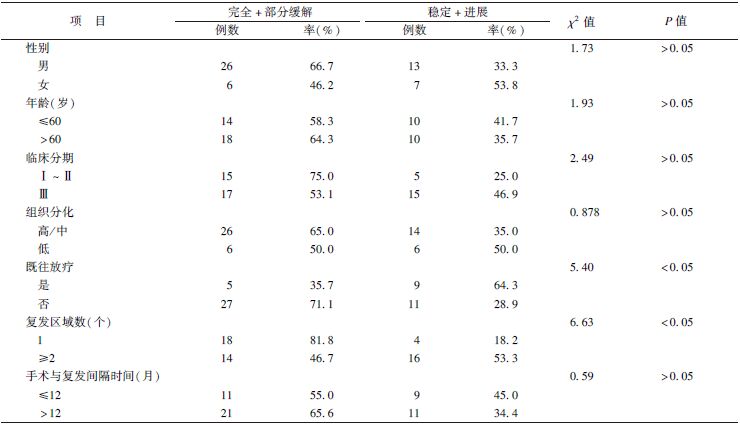
| 表1 临床因素与局部疗效相关性分析 |
2. 治疗前评估:全部患者均接受结肠镜检查,吻合口及会阴区复发有病理证实为腺癌,盆腔CT或MRI判断淋巴结及盆腔其他部位的复发,其中36例接受美国GE公司生产的Discovery LS型号PET-CT诊断。髂内、外、闭孔及髂总淋巴结转移定义为区域淋巴结复发,除骶前及吻合口复发外的原系膜内肿块定义为瘤床复发,包括前壁和盆腔侧壁复发。其他检查包括胸部CT、腹部CT、生化常规和肿瘤标记物。
3. 治疗方案:复发肿瘤或淋巴结体积(GTV)外扩2~3 cm构成临床靶区1(CTV1),CTV1外扩0.8~1 cm定义为肿瘤计划靶体积(PGTV)。13例勾画髂内、骶前、闭孔及部分髂外淋巴结预防照射构成临床靶区2(CTV2),CTV2外扩0.8~1 cm设为计划靶区(PTV),其余仅照射复发区没有进行淋巴结预防照射。PGTV中位剂量63.4 Gy(61.6~64.4 Gy),2.2~2.3 Gy/次,5次/周,13例预防照射区则采用同步补量技术,预防区剂量45~50.4 Gy,1.8~2.0 Gy/次。采用瑞典医科达公司6 MV X直线加速器照射,5~7野调强放疗(IMRT)。同步化疗采用每天口服卡培他滨1 650 mg/m2,分2次口服,连续5 d/周。31例放疗后接受4~6周期系统化疗。
4. 疗效及不良反应评估:放疗期间每周纪录不良反应,放疗后1~3个月复查直肠镜、盆腔CT或MRI,根据实体瘤疗效评价指标(RECIST 1.0标准)分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)。有效率(%)=(CR+PR)/总例数×100%,局部控制率(%)=(CR+PR+SD)/总例数×100%。放疗结束后每3个月进行一次全面复查,1年后每6个月复查一次。急性放化疗不良反应采用常见不良反应事件评价标准(CTCAE v 3.0)进行分级[9]。
5. 统计学处理:采用SPSS 15.0统计软件分析,分类资料的比较采用Pearson χ2或Fisher确切概率法,Kaplan-Meier方法分析LC及OS。P<0.05为差异有统计学意义。
1. 近期疗效:中位随访时间20个月(3~86个月)。全部患者中CR 12例(23.1%),PR 20例(38.5%),SD 17例(32.7%),PD 3例(5.8%)。既往盆腔未接受过放疗的患者近期有效率为71.1%,好于既往放疗过患者35.7%(χ2=5.40,P<0.05);单一区域复发有效率为81.8%高于两个及以上复发区域的有效率46.7%(χ2=6.63,P<0.05);其他临床因素包括年龄、性别、肿瘤分化、复发后的再次分期及复发时间均与近期疗效无关,见表1。
14例既往放疗的患者均为术后放疗,其中APR手术2例,AR手术12例。首次复发中位时间16.6个月(8.1~71.5个月)。总生存的中位时间34.3个月(13.0~91.4个月)。3例单一区域复发,均为吻合口复发,疗效为PR,另外11例均为两个及以上区域复发,14例中1例CR(区域淋巴结和骶前复发),4例PR,6例SD,3例PD。
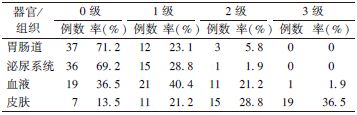
2. 不良反应:全部患者的急性不良反应情况列于表2。其中,3级皮肤不良反应19例,3级血液学不良反应1例,没有患者发生4级急性不良反应。晚期不良反应以吻合口狭窄为主,其中40例吻合口复发患者,放疗后4例发生吻合口重度良性狭窄,经扩张治疗后效果不明显行横结肠造瘘术,9例因肿瘤局部进展导致恶性狭窄行姑息性横结肠造瘘术。
| 表2 患者不同器官的急性不良反应情况 |
3. 远期疗效:25例(48.1%)患者发生远处转移,中位转移时间7个月(1~53个月)。肝转移14例,肺转移12例,骨转移2例,腹膜转移2例,脑转移1例,远处淋巴结转移1例。1、3和5年局部控制率分别为80.7%、56.5%和49.1%,中位28个月(0~56个月);1、3和5年的OS分别为76.4%、55.4%和23.1%,中位25个月(18~32个月)。
临床实践中局部复发直肠癌,如果不能手术切除,往往给予局部姑息剂量放疗,仍很难达到长期控制。近几年随着放疗设备的更新,照射的精确性不断提高,可以更安全的提高靶区剂量而不增加正常器官的剂量,另外新的化疗或靶向药物与放疗的联合应用更普遍,使既往只能接受姑息治疗的患者,通过积极系统的局部和全身治疗有可能达到更好的预后。多数研究已表明,局部复发直肠癌高强度的治疗不仅影响局部控制率,也影响长期生存[5, 6, 7, 10],局部不能切除5年OS为0~22%,根治切除则达到50%~66% [7, 11]。
直肠癌手术后局部复发再次切除较困难,本研究采用局部超常规大分割高剂量同步放化疗,发现近期不良反应以会阴区皮肤溃破为主,主要原因是入组患者中低位直肠癌较多,且吻合口复发较多,放疗野包括会阴区,导致较重的皮肤反应;但胃肠道反应及膀胱炎均较轻,可能是多数患者接受累及野照射,小肠基本不在照射野内,因此,不会引起较重的小肠损伤。晚期较重的不良反应是吻合口狭窄。
Valentini等[7]采用的超分割放化疗方法,局部复发累及野放疗总剂量40.8 Gy,1.2 Gy/次,2次/d,有效率44.1%。本研究大分割放疗有效率61.5%高于该研究结果,可能的原因是较多的吻合口复发(76.9%),易于早期发现,复发时肿瘤体积较小,导致较高的缓解率。Kusters等[5]的研究也证实吻合口复发预后好于其他部位的复发。本研究发现局部复发区域≥2个差于单一部位的复发,而单一部位复发以吻合口为主(17例),可间接说明吻合口疗效优于其他部位,但由于单一其他部位的复发仅5例,因此,未进行不同复发部位间的比较。另外,入组患者中既往未接受过放疗的患者占较大比例(73.1%),与既往盆腔放疗过的患者比较,前者有效率明显高于后者。手术联合放疗导致盆腔血运差,复发后的肿瘤处于相对乏氧环境中,因此,对放疗的敏感性不如没有放疗过的盆腔。
近年来兴起的大分割治疗在头颈部、非小细胞肺癌、乳腺癌等肿瘤中显示出满意的疗效,但由于缺乏相关的放射生物学的理论支持,放疗方案无统一标准,多依赖于临床疗效观察和经验的积累[12, 13, 14]。直肠癌短程大分割研究较多,疗效与常规比较未见优势,但常规大分割目前研究较少,初步结论是安全的,但疗效报道不一[15, 16, 17]。Li等[15] 术前50.6 Gy/22次,2.3 Gy/次,手术后病理证实CR 31%。Arbea等[16]术前47.5 Gy/20 次 (2.5 Gy/次)同步化疗,术后肿瘤体积消退96%及以上者达50%。Vestermark 等[17]常规照射局部剂量60 Gy/30 次,CR 33%。本研究单次剂量不高(2.2~2.3 Gy/次),但总剂量较高,中位63.4 Gy,CR 23.1%,PR 38.5%。但本研究的缺陷是,全部患者均未接受再次手术,因此,疗效评价为临床缓解而非病理证实,所以与文献比较存在差距。但是复发后给予局部如此高剂量放疗,还是罕有报道的,且未发现严重的早晚期不良反应,安全可行,远期疗效也较理想,因此,本研究为局部复发直肠癌患者提供了一种治疗选择。
Calvo等[10]采用手术及术后放疗治疗复发直肠癌的结果显示,1、3和5年PFS分别为86%、52%和44%,本研究1、3和5年局部无进展生存率分别为80.7%、56.5%和49.1%;目前文献研究复发后直肠癌能达到完全切除的患者预后差异较大,有报道5年OS 16%~31%[3, 8, 18],也有报道5年OS 40%~66%[5, 7, 10, 11],而本研究1、3和5年OS分别为76.4%、55.4%和23.1%,结果也较理想。
对局部复发直肠癌局部给予超常规大分割高剂量放疗同步卡培他滨化疗,可行性较强,不良反应可以接受,有较高的有效率、局部控制率和长期生存率。同时,本研究仍存在一些不足,作为回顾性分析,病例数偏少,依靠影像学评估疗效主观影响大,且既往治疗不统一,系统化疗及化疗方案不一致,但仍不失为局部复发不能手术的直肠癌患者治疗提供一定的临床价值。
| [1] | Sauer R, Liersch T, Merkel S, et al. Preoperative versus postoperative chemoradiotherapy for locally advanced rectal cancer: results of the German CAO/ARO/AIO-94 randomized phase Ⅲ trial after a median follow-up of 11 years[J]. J Clin Oncol, 2012, 30(16): 1926-1933. |
| [2] | van Gijn W, Marijnen CA, Nagtegaal ID, et al. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer: 12-year follow-up of the multicentre, randomized controlled TME trial[J]. Lancet Oncol, 2011, 12(6): 575-582. |
| [3] | Yu TK, Bhosale PR, Crane CH, et al. Patterns of locoregional recurrence after surgery and radiotherapy or chemoradiation for rectal cancer[J]. Int J Radiat Oncol Biol Phys, 2008, 71(4): 1175-1180. |
| [4] | Wells BJ, Stotland P, Ko MA, et al. Results of an aggressive approach to resection of locally recurrent rectal cancer[J]. Ann Surg Oncol, 2007, 14(1): 390-395. |
| [5] | Kusters M, Dresen RC, Martijn H, et al. Radicality of resection and survival after multimodality treatment is influenced by subsite of locally recurrent rectal cancer[J]. Int J Radiat Oncol Biol Phys, 2009, 75(5): 1444-1449. |
| [6] | Haddock MG, Miller RC, Nelson H, et al. Combined modality therapy including intraoperative electron irradiation for locally recurrent olorectal cancer[J]. Int J Radiat Oncol Biol Phys, 2011, 79(1): 143-150. |
| [7] | Valentini V, Morganti AG, Gambacorta MA, et al. Preoperative hyperfractionated chemoradiation for locally recurrent rectal cancer in patients previously irradiated to the pelvis: a multicentric phase Ⅱ study[J]. Int J Radiat Oncol Biol Phys, 2006, 64(4): 1129-1139. |
| [8] | Tepper JE, O'Connell M, Hollis D, et al. Analysis of surgical salvage after failure of primary therapy in rectal cancer: results from intergroup study 0114[J]. J Clin Oncol, 2003, 21(19): 3623-3628. |
| [9] | Trotti A, Colevas AD, Setser A, et al. CTCAE v3.0: development of a comprehensive grading system for the adverse sffects of cancer treatment[J]. Semin Radiat Oncol, 2003, 13(3): 176-181. |
| [10] | Calvo FA, Sole CV, Alvarez de Sierra P, et al. Prognostic impact of external beam radiation therapy in patients treated with and without extended surgery and intraoperative electrons for locally recurrent rectal cancer: 16-year experience in a single institution[J]. Int J Radiat Oncol Biol Phys, 2013, 86(5): 892-900. |
| [11] | Dresen RC, Gosens MJ, Martijn H, et al. Radical resection after IORT containing multimodality treatment is the most important determinant for outcome in patients treated for locally recurrent rectal cancer[J]. Ann Surg Oncol, 2008, 15(7): 1937-1947. |
| [12] | Freedman GM, White JR, Arthur DW, et al. Accelerated fractionation with a concurrent boost for early stage breast cancer[J]. Radiother Oncol, 2013, 106(1): 15-20. |
| [13] | Sanghera P, McConkey C, Ho KF, et al. Hypofractionated accelerated radiotherapy with concurrent chemotherapy for locally advanced squamous cell carcinoma of the head and neck[J]. Int J Radiat Oncol Biol Phys, 2007, 67(5): 1342-1351. |
| [14] | Soliman H, Cheung P, Yeung L, et al. Accelerated hypofractionated radiotherapy for early-stage non-small-cell lung cancer: long-term results[J]. Int J Radiat Oncol Biol Phys, 2011, 79(2): 459-465. |
| [15] | Li JL, Ji JF, Cai Y, et al. Preoperative concomitant boost intensity-modulated radiotherapy with oral capecitabine in locally advanced mid-low rectal cancer: a phase Ⅱ trial[J]. Radiother Oncol, 2012, 102(1): 4-9. |
| [16] | Arbea L, Martínez-Monge R, Díaz-González JA, et al. Four-week neoadjuvant intensity-modulated radiation therapy with concurrent capecitabine and oxaliplatin in locally advanced rectal cancer patients: a validation phase II trial[J]. Int J Radiat Oncol Biol Phys, 2012, 83(2): 587-593. |
| [17] | Vestermark LW, Jensen HA, Pfeiffer P. High-dose radiotherapy (60 Gy) with oral UFT/folinik acid and escalating doses of oxaliplatin in patients with non-resectable locally advanced rectal cancer (LARC): a phase trial[J]. Acta Oncol, 2012, 51(3): 311-317. |
| [18] | Rades D, Kuhn H, Schultze J, et al. Prognostic factors affecting locally recurrent rectal cancer and clinical significance of hemoglobin[J]. Int J Radiat Oncol Biol Phys, 2008, 70(4): 1087-1093. |
 2015, Vol. 35
2015, Vol. 35