2. 香港威尔斯亲王医院临床肿瘤科
食管癌通常使用多方针治疗模式,如手术、同步化疗和术前术后放射治疗[1, 2]。由于上段食管癌的靶区形状不规则,颈部和胸部之间轮廓变化大,且受到危及器官(OAR)限制,传统三维适形放疗技术难以达到满意的靶区剂量分布和危及器官保护,而调强放疗(IMRT)技术可以克服该缺点,达到较优的剂量分布[3, 4]。IMRT的特点是通过调节辐射野内射束强度分布,使得肿瘤靶区剂量均匀、适形,周围剂量快速下跌,最终提高肿瘤控制率和提高生存质量[5]。然而,Eclipse治疗计划系统(美国Varian Medical Systems)中,上段食管癌IMRT计划靶区欲达到均匀的剂量分布存在一定难度,主要原因在于优化程序中的计划与最终计算剂量的计划存在一定差异[6],即优化收敛误差 [7, 8]。优化收敛误差容易导致最终剂量过高(热点)或过低(冷点)[9]。由于受到计算机运算速度的限制,目前商业性治疗计划系统只能采用简化的算法计算优化过程中的剂量,而用另一种算法计算最终的剂量。简化算法在空腔、低密度组织和建成区等电子失衡区域计算精度较差,而上段食管癌靶区通常包含气管腔、食管腔、肺组织、皮肤等,故优化收敛误差较为严重。
为此,本研究提出一种简单实用的优化方法以补偿优化收敛误差,即基部剂量计划补偿(base dose plan compensation,BDPC)优化方法。将该优化方法与目前常用的热点冷点控制(hot and cold spot control,HCSC)优化方法[9, 10]进行对比,评估其应用效果。
1.临床资料:本研究入组患者为2012年5月至2013年4月在汕头大学医学院附属肿瘤医院接受根治性放射治疗的19例初治上段食管癌患者。所有患者均病理确诊无远处转移,年龄41~74岁,中位年龄58岁,男性16例,女性3例。组织学上确定为鳞状细胞癌。根据美国癌症联合委员会(AJCC) 2010年第7版分期标准,肿瘤分期为:T2N0M0 1例,T3N0M0 4例,T3N1M0 7例,T4N0M0 3例,T4N1M0 4例。
2. CT模拟定位:CT模拟定位前患者进行静脉注射造影。扫描时患者呈仰卧体位,自由呼吸,双手自然平放并贴于胸腹部两侧,双腿自然平放,使用头颈肩热塑面罩固定。采用荷兰Philips Brilliance 85 cm大孔径CT模拟定位机进行增强扫描,层厚及层间距均为5 mm。CT影像数据通过DICOM 3.0网络传输至Eclipse V10.0。
3.靶区勾画及危及器官的勾画:颈段食管癌靶区勾画范围:自食管入口或环状软骨下缘起至胸骨柄上缘(第2~3胸椎水平)平面,长4.5~5 cm。胸上段食管癌靶区勾画范围:自胸骨柄上缘平面至气管分叉平面,其下界距上门齿约24 cm。大体肿瘤区(GTV)包括食管肿瘤病灶和食管旁肿大淋巴结。临床靶区(CTV)包括高危临床靶区CTV64,低危临床靶区CTV54。CTV64包括GTV轴线外扩5~10 mm,纵向外扩20 mm的食管及食管旁组织;CTV54在CTV64基础上加上纵隔淋巴引流区以及双侧锁骨上淋巴引流区。计划靶区体积(PTV)包括高危计划靶区PTV64和低危计划靶区PTV54,分别在CTV64和CTV54的基础上外扩5 mm边界而形成。PTV64平均体积为(130±74)cm3,PTV54平均体积为(317±90)cm3。危及器官包括脊髓和肺。脊髓计划区(PRV)由脊髓均匀外扩5 mm边界而形成。
4. 治疗计划设计:在Eclipse V10.0上设计IMRT计划,治疗机器为直线加速器 TrueBeam(美国Varian Medical Systems),采用5个共面滑窗(sliding window)射野,能量为6 MV光子线,机架角度为216°、288°、0°、72°、144°。准直器角度均为0°。PTV64处方为64 Gy,PTV54处方为54 Gy,分32次。优化算法采用DVO算法,最终剂量算法采用AAA,计算网格为2.5 mm。借助分布式计算框架(distributed calculation framework,DCF)加快AAA计算速度。剂量限制条件见表1。Dx%表示x%体积达到或超过的剂量;VxGy表示接受至少x Gy剂量的体积;Dmean为平均剂量,Dmax为最大剂量。最终计划均以处方剂量64 Gy刚好覆盖95%的PTV64体积进行归一。
| 表1 治疗计划剂量限制要求 |
对计划进行初始优化得到初始计划。然后在保持原始优化条件不变的情况下使用以下两种方法分别进一步优化得到两组计划:
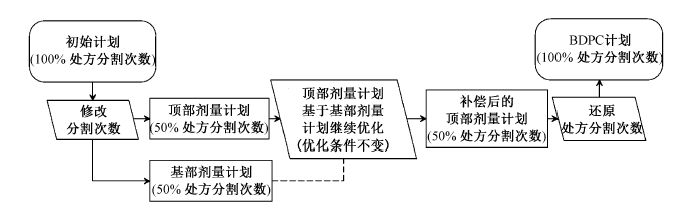
(1)BDPC方法:初始计划的分割(fraction)数改为处方分割数的50%,即将分割数32次改为16次,使得计划剂量减半,生成一个基部剂量计划。复制基部剂量计划得到一个“顶部剂量计划”。继续优化(re-optimize)顶部剂量计划,在优化界面中利用Eclipse V10.0基部剂量计划(base dose plan)功能将顶部剂量计划与基部剂量计划关联起来,以最高迭代优化次数为30次进行优化。优化完计算最终剂量,将顶部剂量计划的分割数由16改回原处方分割数32,BDPC计划即设计完成,流程见图1。
|
图1 BDPC优化方法流程图 |
(2)HCSC方法:在初始计划中,用105%的处方等剂量线生成PTV64热点控制结构,同时用脊髓计划区超过45 Gy的等剂量线生成脊髓计划区热点控制结构;使用PTV64减去64 Gy等剂量线得PTV64冷点控制结构。然后,将热点和冷点控制结构重新设置剂量要求,添加到优化条件中。PTV64热点控制结构设定上限目标(upper objective):处方剂量的98%,即6 272 cGy。脊髓计划区热点控制结构设定上限目标:45 Gy。PTV64冷点控制结构设定下限目标(lower objective):处方剂量的102%,即6 528 cGy。然后以最大迭代次数为30次继续优化计划并计算剂量。若剂量不达标则再次优化1~2次。HCSC计划即设计完毕。
5. 评估指标:评估靶区剂量分布指标:近似最高剂量D2%;近似最低剂量D98%;中位剂量D50%;适形指数(CI)[11],CI=(TVRI/TV) × (TVRI/VRI),TV为靶区体积,TVRI为处方等剂量线包绕的靶体积,VRI为处方等剂量线包绕的所有体积,CI取值0~1,越接近1,说明靶区适形性越好;均匀指数(HI),采用ICRU 83号报告[5]的定义:HI=(D2%-D98%)/D50%。HI值越小,说明靶区剂量分布越均匀。评估危及器官受照剂量指标有:Dmax、Dmean和VxGy。其他相关参数:计划设计时间;机器跳数(MU);投照时间,从机器开始出射束至全部出束完毕,包括过程中机架旋转时间。
6. 统计学处理:数据用 ±s表示。使用统计软件SPSS V19进行双尾配对Wilcoxon符号秩和检验分析处理。P<0.05为差异具有统计学意义。
±s表示。使用统计软件SPSS V19进行双尾配对Wilcoxon符号秩和检验分析处理。P<0.05为差异具有统计学意义。
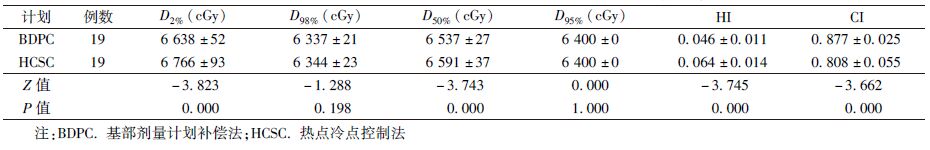
1.靶区剂量:BDPC计划与HCSC计划均能满足靶区剂量限制要求,结果见表2,3。高危靶区PTV64:BDPC计划D2%比HCSC计划低1.9%(Z=-3.823,P<0.05);HI明显低于HCSC计划(Z=-3.745,P<0.05),幅度达26.4%;CI明显高于HCSC计划(Z=-3.662,P<0.05),幅度达9.0%;而D98%两者差异无统计学意义(P>0.05)。低危靶区PTV54:BDPC计划的CI高于HCSC计划(Z=-3.340,P<0.05),幅度为3.7%;D95%低于HCSC计划(Z=-3.582,P<0.05),幅度为17.6%;D98%低于HCSC计划(Z=-2.616,P<0.05),幅度为1.1%。从CT图像等剂量分布上看,BDPC计划靶区中的热点剂量体积,如105%处方剂量体积明显少于HCSC计划。从剂量体积直方图(DVH)上看,BDPC计划的靶区DVH曲线跌落更快。
表2 BDPC计划和HCSC计划的靶区PTV64剂量体积参数( ±s) ±s)
|
表3 BDPC计划和HCSC计划的靶区PTV54剂量体积参数( ±s) ±s)
|
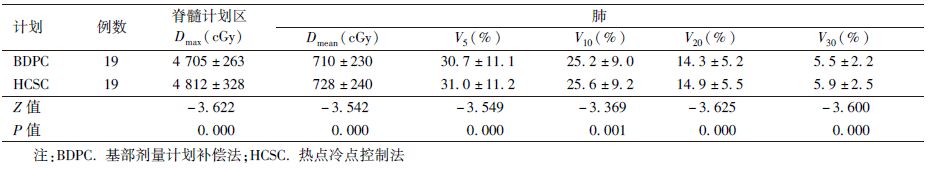
2.危及器官剂量:危及器官受照剂量均满足要求,结果见表4。BDPC计划的脊髓计划区的Dmax比HCSC计划的低2.1%(Z=-3.622,P<0.05)。而肺的Dmean、V5、V10、V20和V30均比HCSC计划略低。DVH图上,BDPC计划肺和脊髓计划区的曲线略偏左移。
表4 BDPC计划与HCSC计划的危及器官剂量体积参数( ±s) ±s)
|
3.其他相关参数:计划设计时间:BDPC计划为(26.05±0.88)min,比HCSC计划的(33.73±3.24)min节省22% (Z=-3.823,P<0.05)。MU:BDPC计划为1 019±167,比HCSC计划的1 003±159高1%(Z=-2.616,P<0.05)。投照时间:BDPC计划为(3.52±0.29)min,比HCSC计划的(3.50±0.28)min多1%(Z=-2.548,P<0.05)。
国内外已报道IMRT技术能提高食管癌的局部控制率[12, 13],或减少并发症[14, 15]。为使IMRT技术发挥更大的临床优势,有必要进一步完善优化方法。本研究表明,BDPC方法可进一步改善靶区剂量覆盖并减少危及器官受照剂量,可能有助于提高肿瘤局部控制率和减少正常组织并发症,获得更高治疗增益比。
BDPC方法最突出的优点是能在较大程度上改善靶区剂量均匀性,幅度高达26%。Werner-Wasik等[16]报道,食管中小体积的高剂量照射,都有可能导致急性食管不良反应的发生。其中,食管穿孔、食管瘘等[17, 18],属于严重并发症,甚至可能危及生命。因此,大幅度改善靶区剂量均匀性可能具有一定的临床意义。
BDPC方法能在一定程度上提高靶区剂量适形性。本研究结果显示,PTV64的CI可提高约9%,PTV54的CI可提高约4%。靶区剂量适形性是IMRT的优点之一,因此,BDPC优化方法能使IMRT的优点得到进一步发挥,保护靶区周围正常组织。
在脊髓保护方面,BDPC优化方法可减少约2%的最高剂量,可能有助于降低放射性脊髓炎的发生概率,尤其是对于局部残留或复发的食管癌需要进行再程放疗时更显必要。在肺保护方面,BDPC方法可减少约2%的平均剂量,降低V5、V10、V20、V30多个体积参数。放射性肺炎是放疗主要并发症之一,重者可出现肺部广泛渗出或纤维化,导致呼吸功能障碍甚至死亡[19, 20]。研究表明,放射性肺炎与肺平均剂量、V5、V10、V20、V30密切相关。Kumar等[21]的研究表明急性放射性肺炎主要与V30相关,而慢性放射性肺炎主要与V20相关。因此,BDPC优化方法有望小幅度降低放射性肺炎发生率。
BDPC方法步骤简单,操作简便,只需要修改一个参数(即分割数),而且优化结果更容易达到要求,通常1次再优化即可达到满意效果,缩短了计划设计时间,提高了工作效率,有助于减少患者等待开始治疗的时间。而HCSC优化方法需要花时间勾画热点冷点控制区,而且一次再优化后新的热点或冷点可能会出现在其他区域,经常需要多次再优化才能达到满意效果,比较费时。
Eclipse基部剂量计划(base dose plan)功能模块原本设计的目的是:优化第2个放疗计划(顶部剂量计划),补偿第1个放疗计划(基部剂量计划),使得两个计划叠加,达到计划总和(plan sum)均匀剂量分布效果。然而,本研究中,基部剂量计划功能并不是以传统的方式使用,因为传统方式获得的是优化程序中的plan sum,而BDPC方式获得的是最终剂量模式下的顶部剂量计划。在BDPC优化方法中,基部剂量计划功能被用于补偿优化收敛误差。假设优化收敛误差使得初始计划(基部剂量计划)计算最终剂量时产生了一个冷点,进一步优化时BDPC计划(顶部剂量计划)将尝试在同一位置放置一个热点以弥补初始计划(基部剂量计划)的冷点,而当BDPC计划(顶部剂量计划)计算最终剂量时其热点在优化收敛误差的又一次作用下得以消除,使得BDPC计划(顶部剂量计划)的最终剂量接近所要求的剂量。
优化收敛误差的主要来源为组织非均匀性、剂量建成区效应、未考虑多叶准直器(MLC)叶片序列,以及优化算法不能找到全局最优解[7, 8]。国外已有学者做了关于补偿优化收敛误差的研究。HCSC优化方法正是Süss等[9]所描述的方法,而Xhaferllari等[10]与Kan等[22]报道使用了HCSC方法。HCSC方法是直接有效的补偿优化收敛误差的方法,但仅做局部区域的剂量控制,而且控制区域的勾画及其优化条件需要人为调整,是一种“反复试误”(trial and error)方法[10]。相反,BDPC方法可以做全局的剂量补偿,是一种系统性的方法。在Broderick等[23]的综述与其他研究[24, 25]中所报道的直接射野优化(direct aperture optimization,DAO)技术[26]在优化程序中考虑了MLC叶片序列,显然,DAO方式是优于先优化射野理想通量,再考虑MLC叶片序列的方式,能够消除优化收敛误差的主要来源之一。但是,由上段食管癌的组织非均匀性和建成区效应导致的优化收敛误差成分仍然存在,而且,在一些没有DAO技术的治疗计划系统,如Eclipse V10.0,暂时无法实现直接MLC射野优化。而BDPC优化方法在多个治疗计划系统中都能实现,这是因为欲达到最优的两段计划总和而优化第二段计划的功能是治疗计划系统最基础的功能之一。Verbakel等[27]在优化肺癌IMRT计划时为补偿组织非均匀性部分的优化收敛误差,将靶区分为肺组织区和非肺组织区进行优化,设置肺组织靶区优化目标值比非肺组织靶区高2~4 Gy。然而,该方法仅减少了一个优化收敛误差的来源,如果应用于多靶区计划,该方法操作较复杂。Zacarias和Mills[28]同样利用基部剂量计划功能模块,通过递归的方法多次给原始计划添加剂量校正计划(Plan Correction),使用自定义递归公式Plan (i+1)=Plan(i)+Plan Correction,得到一个计划总和,最终将计划总和通过一定操作步骤和软件转换为单个计划。但这个方法存在以下缺点:需要借助第三方工具,步骤繁多,效率低下。因此,该方法不能普遍应用。而BDPC优化方法由于操作简便,效率高,可以普遍应用于临床实践。
然而,BDPC优化方法增多了计划的MU和投照时间。理论上,增多的MU可能会增加二次致癌的概率[29],增加的投照时间可能会导致患者体位变化而影响治疗精度。不过,MU和投照时间增多的幅度非常小,仅1%,完全在可接受范围内,不影响其应用。
综上所述,本研究对BDPC优化方法应用于上段食管癌的剂量学特性进行了评估,发现BDPC优化方法不仅可以改善靶区剂量分布,包括均匀性和适形性,而且能够降低危及器官剂量,可以提高计划设计效率。因此,BDPC优化方法值得推荐应用于临床实践。
| [1] | Martin S, Chen JZ, Rashid Dar A, et al. Dosimetric comparison of helical tomotherapy, RapidArc, and a novel IMRT & Arc technique for esophageal carcinoma[J]. Radiother Oncol,2011,101(3):431-437. |
| [2] | Shridhar R, Almhanna K, Meredith KL, et al. Radiation therapy and esophageal cancer[J]. Cancer Control,2013,20(2):97-110. |
| [3] | Fenkell L, Kaminsky I, Breen S, et al. Dosimetric comparison of IMRT vs. 3D conformal radiotherapy in the treatment of cancer of the cervical esophagus[J]. Radiother Oncol,2008,89(3):287-291. |
| [4] | 张武哲, 陈志坚, 李德锐, 等. 胸上段食管癌调强放疗与适形放疗计划的剂量学比较[J]. 癌症,2009,28(11):1127-1131. |
| [5] | Hodapp N. The ICRU Report 83: prescribing, recording and reporting photon-beam intensity-modulated radiation therapy (IMRT)[J]. Strahlenther Onkol,2012,188(1):97-99. |
| [6] | McGarry CK, Bokrantz R, O'Sullivan JM, et al. Advantages and limitations of navigation-based multicriteria optimization (MCO) for localized prostate cancer IMRT planning[J]. Med Dosim,2014,39(3):205-211. |
| [7] | Jeraj R, Keall PJ, Siebers JV. The effect of dose calculation accuracy on inverse treatment planning[J]. Phys Med Biol,2002,47(3):391-407. |
| [8] | Dogan N, Siebers JV, Keall PJ, et al. Improving IMRT dose accuracy via deliverable Monte Carlo optimization for the treatment of head and neck cancer patients[J]. Med Phys, 2006,33(11):4033-4043. |
| [9] | Süss P, Bortz M, Küfer KH, et al. The critical spot eraser-a method to interactively control the correction of local hot and cold spots in IMRT planning[J]. Phys Med Biol,2013,58(6):1855-1867. |
| [10] | Xhaferllari I, Wong E, Bzdusek K, et al. Automated IMRT planning with regional optimization using planning scripts[J]. J Appl Clin Med Phys,2013,14(1):4052. |
| [11] | Feuvret L, Nol G, Mazeron JJ, et al. Conformity index: a review[J]. Int J Radiat Oncol Biol Phys,2006,64(2):333-342. |
| [12] | Lin SH, Wang L, Myles B, et al. Propensity score-based comparison of long-term outcomes with 3-dimensional conformal radiotherapy vs intensity-modulated radiotherapy for esophageal cancer[J]. Int J Radiat Oncol Biol Phys,2012,84(5):1078-1085. |
| [13] | 龚哲, 尚闯. 调强适形放疗联合同期化疗治疗胸上段食管癌的临床疗效分析[J]. 当代医学,2014,20(7):25-26. |
| [14] | Freilich J, Hoffe SE, Almhanna K, et al. Comparative outcomes for three-dimensional conformal versus intensity-modulated radiation therapy for esophageal cancer[J]. Dis Esophagus, 2015,28(4):352-357. |
| [15] | 王文高, 闫爱云, 王琍, 等. 胸上段颈段食管鳞癌调强放疗疗效观察[J]. 安徽医学,2009,30(11):1318-1320. |
| [16] | Werner-Wasik M, Yorke E, Deasy J, et al. Radiation dose-volume effects in the esophagus[J]. Int J Radiat Oncol Biol Phys,2010,76(3 Suppl):S86-93. |
| [17] | Kwint M, Uyterlinde W, Nijkamp J, et al. Acute esophagus toxicity in lung cancer patients after intensity modulated radiation therapy and concurrent chemotherapy[J]. Int J Radiat Oncol Biol Phys,2012,84(2):e223-228. |
| [18] | Ahn SJ, Kahn D, Zhou S, et al. Dosimetric and clinical predictors for radiation-induced esophageal injury[J]. Int J Radiat Oncol Biol Phys,2005,61(2):335-347. |
| [19] | 王明臣, 刘洪明, 刘杰, 等. 放射性肺炎影响因素的多元回归分析[J]. 中华放射肿瘤学杂志,2003,12(z1):49-51. |
| [20] | Guckenberger M, Baier K, Polat B, et al. Dose-response relationship for radiation-induced pneumonitis after pulmonary stereotactic body radiotherapy[J]. Radiother Oncol,2010,97(1):65-70. |
| [21] | Kumar G, Rawat S, Puri A, et al. Analysis of dose-volume parameters predicting radiation pneumonitis in patients with esophageal cancer treated with 3D-conformal radiation therapy or IMRT[J]. Jpn J Radiol,2012,30(1):18-24. |
| [22] | Kan MW, Wong W, Leung LH, et al. A comprehensive dosimetric evaluation of using RapidArc volumetric-modulated arc therapy for the treatment of early-stage nasopharyngeal carcinoma[J]. J Appl Clin Med Phys,2012,13(6):3887. |
| [23] | Broderick M, Leech M, Coffey M. Direct aperture optimization as a means of reducing the complexity of intensity modulated radiation therapy plans[J]. Radiat Oncol,2009,4:8. |
| [24] | Jones S, Williams M. Clinical evaluation of direct aperture optimization when applied to head-and-neck IMRT[J]. Med Dosim,2008,33(1):86-92. |
| [25] | Dobler B, Pohl F, Bogner L, et al. Comparison of direct machine parameter optimization versus fluence optimization with sequential sequencing in IMRT of hypopharyngeal carcinoma[J]. Radiat Oncol,2007,2:33. |
| [26] | 黄劭敏, 高兴旺, 邓小武, 等. 独立准直器调强技术在鼻咽癌放射治疗的应用评估[J]. 南方医科大学学报,2010,30(10):2229-2232. |
| [27] | Verbakel WF, van Reij E, Ladenius-Lischer I, et al. Clinical application of a novel hybrid intensity-modulated radiotherapy technique for stage Ⅲ lung cancer and dosimetric comparison with four other techniques[J]. Int J Radiat Oncol Biol Phys,2012,83(2):e297-303. |
| [28] | Zacarias AS, Mills MD. Algorithm for correcting optimization convergence errors in Eclipse[J]. J Appl Clin Med Phys,2009,10(4):3061. |
| [29] | Hall EJ, Wuu CS. Radiation-induced second cancers: the impact of 3D-CRT and IMRT[J]. Int J Radiat Oncol Biol Phys,2003,56(1):83-88. |
 2015, Vol. 35
2015, Vol. 35