2. 中山大学肿瘤防治中心放疗科
胸部放疗是局限期小细胞肺癌(small cell lung cancer,SCLC)患者综合治疗中不可或缺的部分[1, 2]。放疗靶区中纵隔淋巴结引流区的照射方式基于已有的临床研究,倾向于采用累及野照射(involved field radiation therapy,IFRT),而所报道的照射野外失败率多在5%以内[3, 4, 5],这与手术治疗后的结果有较大不同[6, 7]。本研究探讨采用IFRT时各组淋巴结受照剂量与淋巴结失败之间的关系,为IFRT的应用提供辐射剂量学依据。
1.临床资料:研究中的患者均来源于本课题组开展的局限期SCLC胸部放疗靶区的随机对照临床研究[3]。收集2006年6月至2011年12月入组的76例患者,中位年龄59岁(32~74岁),随访时间3.5~80.0个月,中位随访时间17.4个月。其中75例患者接受3D-CRT,1例患者接受IMRT。初治时有纵隔淋巴结转移的患者中存在两组及以上转移的占88.2%。其中T1\|4期分别有6、21、7和41例,N0-3期分别有1、7、23和45例。采用加速超分割放疗,处方剂量均为45 Gy/30次,2次/d,共19 d。且要求治疗计划95%处方剂量曲线包括95%以上PTV体积。
2.淋巴结区勾画:通过Pinnacle(美国飞利浦公司)放射治疗计划系统,参考国际肺癌研究学会(IASLC)2009版肺癌淋巴结分区图谱的定义[8],以及Michigan大学2005版肺癌CT纵隔淋巴结勾画图谱[9],在患者原治疗计划纵隔窗上勾画淋巴结引流区,分别勾画双侧锁骨上区(1L、1R,L为左,R为右)、双侧上气管旁(2L、2R)、血管前(3A,A为前)、气管后(3P,P为后)、双侧下气管旁(4L、4R)、主肺动脉窗(5)、主动脉弓旁(6)、隆突下(7)、食管旁(8)、双侧肺韧带(9L、9R)及双侧肺门(10L、10R)引流区。统计初诊时各组淋巴结区的淋区结转移情况。判断阳性淋巴结标准为:短径≥1 cm,或纵隔镜病理活检阳性,或1个区域内多个成簇出现的短径<1 cm的淋巴结,或治疗前PET/CT标准摄取值(SUV)≥2.5,或淋巴结中央坏死伴周边强化[3]。
3.剂量获取:通过Pinnacle放射治疗计划系统的剂量-体积直方图(DVH)读取每组淋巴结区受照剂量与体积的关系。收集每组淋巴结区受照的平均剂量、最小剂量、最大剂量,V90(处方剂量的90%所覆盖的淋巴结区体积百分比)、V80、V60,D90(淋巴结区90%的体积受到的照射剂量)、D80、D60(本研究仅分析平均剂量)。
4.随访及局部失败的定义:在放化疗结束后的2年内,患者每3个月随访1次,2年到5年间每半年随访1次,5年后每年随访1次,随访时常规行胸部及上腹部增强CT扫描。在患者随访中,观察随访胸部CT上淋巴结失败的位置,并与原治疗计划对比,从辐射剂量学角度确定区域失败与照射野的关系(位于处方剂量80%等剂量曲线以内为照射野内失败,处方剂量80%~20%等剂量曲线以内为照射野边缘失败,处方剂量20%等剂量曲线以外为照射野外失败),找出相应淋巴结区域所受目的性/附带照射剂量。
1. 初诊时各组淋巴结转移情况:各淋巴结区初诊时总转移率超过50%的分别为4R(68.7%)、4L(57.9%)、10R(57.9)、2R(56.6%)、7(51.3%)。当原发病灶位于左肺时,各组淋巴结区转移发生率超过50%的分别为10L(91.2%)、4L(76.5%)、5(58.8)、4R(52.9%);当原发病灶位于右肺时,各组淋巴结区转移发生率超过50%的分别为10R(97.6%)、4R(83.3%)、2R(71.4%)、7(59.5%)。原发灶位于左肺时更倾向于转移到对侧纵隔淋巴结区。
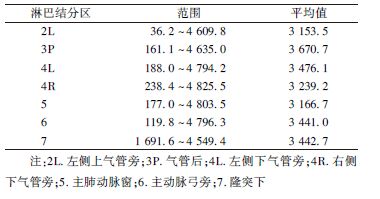
2. 各组淋巴结所受目的性照射及附带照射剂量:各组淋巴结区有阳性病灶时,均受到了处方剂量照射(第8组结区未达到处方照射剂量,是由于勾画时按照解剖学定义,从隆突下食管至贲门入口,而该组淋巴结实际照射时未包括完整结区)。而未发生转移时,淋巴结区受到的平均附带照射剂量超过3 000 cGy的有:3P、4L、7、6、4R、5、2L,具体剂量见表1。
| 表1 76例患者淋巴结区未转移时受到平均 >3 000 cGy附带照射区域所受剂量(cGy) |
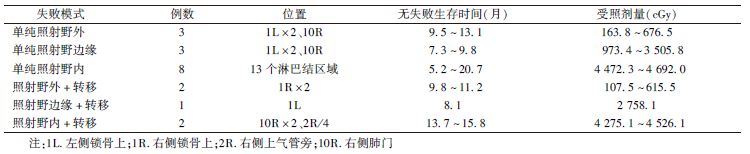
本研究中,根据淋巴结失败位置与处方剂量曲线的关系,可确定的淋巴结区域首次失败模式有:单纯照射野外、单纯照射野边缘、单纯照射野内、照射野外+远处转移、照射野边缘+远处转移、照射野内+远处转移。失败的位置及受照剂量、无失败生存时间(FFS)见表2。
| 表2 患者首次淋巴结区域失败模式及受照剂量 |
来自于SCLC及NSCLC的手术资料显示,术前临床分期为N0的患者在术后病理检查中多达9%~63%检测出纵隔微小淋巴结转移病灶,这些患者与真正N0的患者预后差别显著[6, 7, 10]。目前也认为NSCLC手术治疗时行纵隔淋巴结系统性清扫较纵隔淋巴结取样能够提高长期生存率[11]。此外,最近的研究表明,对术后Ⅲ\-a(N2)的NSCLC患者行辅助化疗及纵隔、肺门淋巴结区的辅助放疗较单纯辅助化疗可提高肿瘤局部控制率及长期生存率[12, 13, 14]。因此,这些研究间接表明影像学检查甚至术后常规病理阴性的纵隔淋巴结区域也可能已存在肿瘤细胞转移。而肿瘤学界目前公认SCLC恶性程度较NSCLC更高,更易于发生淋巴结转移。因此,对待纵隔淋巴结采用IFRT理论上会出现较多纵隔淋巴结照射野外失败,而选择性淋巴结照射(ENI)也应该较IFRT更有利于提高区域淋巴结的控制。
但不同于手术治疗肺癌的结果,本研究发现在全组患者均采用IFRT治疗方式的情况下,仅有1例患者在随访到70.2个月时发生病灶同侧纵隔淋巴结照射野外复发。Han等[15]的研究对比了采用IFRT或ENI治疗局限期SCLC患者80例,中位随访时间27个月,IFRT组患者中6%发生单独淋巴结失败,ENI组为0%,但IFRT组和ENI组3年总生存率和3年疾病无进展生存率差异无统计学意义。
由于本课题入组的局限期SCLC患者多为N2、N3,纵隔淋巴结存在多站转移灶,以IFRT方式应用3D-CRT或IMRT照射阳性淋巴结转移区域时,照射野从多个方向入射,周围未转移的淋巴结区实际上也受到了相当剂量的附带照射。Rosenzweig等[16]报道的NSCLC放疗的资料显示,在分期86%为Ⅲ期的NSCLC患者中,采用IFRT技术照射50.4~81 Gy(中位剂量68.4 Gy)时,分别有34%、64%及41%的患者病灶同侧上纵隔、同侧下纵隔、隆突下可受到超过40 Gy的附带照射剂量。该结果与本课题类似。
本研究中除第8组分组在淋巴结区,其他转移淋巴结所在结区均接受了处方剂量照射,同时,未发生转移的淋巴结区也受到了相当剂量的附带照射。其中转移概率最高的淋巴结区域中可接受到的附带照射剂量分别为:4R 3 239.2 cGy、4L 3 476.1 cGy、10R 1 933.2 cGy、2R 1 970.9 cGy、7区3 442.7 cGy。而3P、4L、7、6、4R、5、2L组淋巴结区受到的平均附带照射剂量超过3 000 cGy(即本研究中处方剂量的66%)。
Giuliani等[17]报道的回顾性研究设计与本研究相似。将随访中的局限期SCLC区域淋巴结失败部位的图像与原治疗计划匹配融合,根据该部位在治疗计划中的受照剂量来分析照射野内、[JP]野边缘或野外失败情况。照射野内失败、照射野边缘失败及照射野外失败分别定义为>95%、95%~20%及<20%的失败的病灶体积接受了95%的处方剂量。
但与本研究结果不同,Giuliani等[17]研究的70例患者中,淋巴结失败体积共39处,位于照射野内、照射野边缘、照射野外分别有12处、12处及15处,即27处(69.2%)淋巴结区域失败体积不在照射野内。而本研究76例患者中19例患者共27处出现区域淋巴结失败,同时伴或不伴原发灶局部/远处转移失败,单纯失败于照射野外的位置为5处(18.5%)。
出现这种明显差别的可能原因为:首先,两个研究中靶区的勾画原则不同:Giuliani等[17]勾画CTV-N时将淋巴结GTV直接外扩5 mm后沿解剖学屏障边界修回。而本研究中CTV-N为完整包括阳性淋巴结所在的整个结区,即使淋巴结在诱导化疗后达到CR也包括该结区。因此,本研究中[JP]CTV-N包括范围更充分,而Giuliani等[17]的靶区勾画范围可能明显不够。其次,该研究定义照射野内失败为>95%的失败体积接受95%以上处方剂量的照射,而本研究定义照射野内失败为失败体积位于处方剂量80%等剂量曲线以内,因此,Giuliani等[17]的研究中定义的照射野内失败较本研究定义的范围小,从而有较多机会出现照射野外失败。
总之,本研究中采用IFRT的治疗方式,仅1例患者在长期随访后出现照射野外失败。而多组阴性淋巴结区域受到的相当于“预防剂量”的附带照射可能已足够杀灭肉眼不可见的微小淋巴结转移病灶,使得照射野外失败率低。原发灶及区域淋巴结的失败都主要是位于照射野内,且接受了处方剂量的照射,因此,局限期SCLC胸部放疗的剂量递增临床研究值得进一步进行。
| [1] | Pignon JP, Arriagada R, Idhe D, et al. A meta-analysis of thoracic radiotherapy for small-cell lung cancer[J]. N Engl J Med, 1992, 327(23): 1618-1624. |
| [2] | Warde P, Payne D. Does thoracic irradiation improve survival and local control in limited-stage small-cell lung cancer? A meta-analysis[J]. J Clin Oncol, 1992, 10(6): 890-895. |
| [3] | Hu X, Bao Y, Zhang L, et al. Omitting elective nodal irradiation and irradiating postinduction versus preinduction chemotherapy tumor extent for limited-stage small cell lung cancer: interim analysis of a prospective randomized noninferiority trial[J]. Cancer, 2012, 118(1):278-287. |
| [4] | Xia B, Chen GY, Cai XW, et al. Is involved-field radiotherapy based on CT safe for patients with limited-stage small-cell lung cancer?[J]. Radiother Oncol, 2012, 102(2):258-262. |
| [5] | Colaco R, Sheikh H, Lorigan P, et al. Omitting elective nodal irradiation during thoracic irradiation in limited-stage small cell lung cancer—evidence from a phase II trial[J]. Lung Cancer, 2012, 76(1):72-77. |
| [6] | Iwata T, Nishiyama N, Nagano K, et al. Role of pulmonary resection in the diagnosis and treatment of limited-stage small cell lung cancer: revision of clinical diagnosis based on findings of resected specimen and its influence on survival[J]. Gen Thorac Cardiovasc Surg, 2012, 60(1):43-52. |
| [7] | Inoue M, Miyoshi S, Yasumitsu T, et al. Surgical results for small cell lung cancer based on the new TNM staging system[J]. Ann Thorac Surg, 2000, 70(5):1615-1619. |
| [8] | Rusch VW, Asamura H, Watanabe H, et al. The IASLC lung cancer staging project: a proposal for a new international lymph node map in the forthcoming seventh edition of the TNM classification for lung cancer[J]. J Thorac Oncol, 2009, 4(5):568-577. |
| [9] | Chapet O, Kong FM, Quint LE, et al. CT-based definition of thoracic lymph node stations: an atlas from the University of Michigan[J]. Int J Radiat Oncol Biol Phys, 2005, 63(1):170-178. |
| [10] | Rusch VW, Hawes D, Decker PA, et al. Occult metastases in lymph nodes predict survival in resectable non-small-cell lung cancer: report of the ACOSOG Z0040 trial[J]. J Clin Oncol, 2011, 29(32):4313-4319. |
| [11] | Keller SM, Adak S, Wagner H, et al. Eastern Cooperative Oncology Group. Mediastinal lymph node dissection improves survival in patients with stages II and IIIa non-small cell lung cancer[J]. Ann Thorac Surg, 2000, 70(2):358-366. |
| [12] | Shen WY, Ji J, Zuo YS, et al. Comparison of efficacy for postoperative chemotherapy and concurrent radiochemotherapy in patients with IIIA-pN2 non-small cell lung cancer: An early closed randomized controlled trial[J]. Radiother Oncol, 2014, 110(1):120-125. |
| [13] | Dai H, Hui Z, Ji W, et al. Postoperative radiotherapy for resected pathological stage IIIA-N2 non-small cell lung cancer: a retrospective study of 221 cases from a single institution[J]. Oncologist, 2011, 16(5): 641-650. |
| [14] | Zou B, Xu Y, Li T, et al. A Multicenter retrospective analysis of survival outcome following postoperative chemoradiotherapy in non-small-cell lung cancer patients with N2 nodal disease[J]. Int J Radiat Onco Biol Phys, 2010, 77(2): 321-328. |
| [15] | Han TJ, Kim HJ, Wu HG, et al. Comparison of treatment outcomes between involved-field and elective nodal irradiation in limited-stage small cell lung cancer[J]. Jpn J Clin Oncol, 2012, 42(10):948-954. |
| [16] | Rosenzweig KE, Sim SE, Mychalczak B, et al. Elective nodal irradiation in the treatment of non-small-cell lung cancer with 3-dimensional conformal radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2001, 50(3):681-685. |
| [17] | Giuliani ME, Lindsay PE, Sun A, et al. Locoregional failures following thoracic irradiation in patients with limited-stage small cell lung carcinoma[J]. Radiother Oncol, 2012, 102(2):263-267. |
 2015, Vol. 35
2015, Vol. 35