2. 东南大学医学院, 上海交通大学医学院附属瑞金医院卢湾分院;
3. 上海交通大学医学院附属同仁医院介入科;
4. 苏州大学医学部放射医学与防护学院
近年来,125I粒子持续低剂量率(CLDR)内照射治疗以其操作简单、定位精准、靶区内剂量高靶区外剂量低等优点逐渐应用于中晚期恶性肿瘤的局部治疗[1, 2],而传统的外照射治疗,如60Co γ射线高剂量率(HDR)照射局部,因其对周围正常组织的损伤较严重,一定程度上限制了它的临床应用。研究表明,125I粒子组织间植入治疗能有效抑制小鼠Lewis肿瘤生长[3]。另有研究表明,放射性125I粒子植入对犬的各组织有不同程度损伤,但这种损伤可以通过自身的修复能力修复,临床应用是安全的[4]。本研究采用非小细胞肺癌(NSCLC)细胞A549、正常支气管上皮细胞BEAS-2B,探讨两种照射方式对NSCLC细胞生物学效应影响的差异。
1. 细胞培养:肺腺癌细胞系A549、正常支气管上皮细胞BEAS-2B均由苏州大学放射生物学实验室刘芬菊教授惠赠,本研究所有实验均在苏州大学放射医学与防护学院省重点实验室完成。细胞在含有10%FBS[赛默飞世尔科技(中国)有限公司]、100 U/ml青霉素、100 g/ml链霉素(上海碧云天生物技术有限公司)的DMEM[赛默飞世尔科技(中国)有限公司]高糖培养基中培养,并置于37℃、5%CO2细胞培养箱中孵育。
2.细胞照射:本实验采用Gray实验室125I粒子照射模型[5 ,6],该模型由聚苯乙烯材料制成,分上下两层,上层为细胞培养板,下层为125I粒子板,整个照射模型外形如抽屉式结构。125I粒子板为6个直径35 mm的圆环,每个圆环上等距离排列着14个凹槽、一一对应可放置14枚125I粒子,共可装载84枚粒子。上层细胞培养板可放置6个直径35 mm的细胞培养皿。细胞培养平面的吸收剂量以及不同照射剂量所需的照射时间通过测量和计算得出[5]。125I粒子照射达到指定剂量所需时间计算公式为:Dc=D0(1.44T1/2)(1-e-0.693t/T1/2),式中,Dc为经过t时间照射后的累积剂量,cGy;D0为放射性125I粒子的初始剂量率,cGy/h;T1/2为125I粒子半衰期。本实验采用的BT-125-1 125I粒子购于上海欣科医药有限公司,T1/2为60.1 d,单颗粒子的平均活度为2.5 mCi(1 Ci=3.7×1010 Bq),细胞培养平面的初始剂量率为18.32 cGy/h,吸收剂量为2、4、6、8 Gy时的照射时间分别为10.97、22、33.08、44.23 h。CLDR照射期间,125I粒子模型一直置于四周有透气孔的铅盒内,同时放置于细胞培养箱中,在满足细胞生长所需的CO2、水分进出铅盒的同时也防止放射线泄漏。
60Co γ射线HDR照射采用苏州大学辐照中心GWXJ80型钴-60远距离治疗机(中国核动力研究设计院设备制造厂),输出能量分别为1.17 MeV和1.33 MeV的两种光子,平均能量为1.25 MeV[7],照射源距细胞培养平面约0.8 m,细胞培养平面的初始剂量率为0.5 Gy/min,吸收剂量为2、4、6、8 Gy时照射时间分别为4、8、12、16 min。所有实验均在细胞指数生长期进行,分别行不同剂量的125I粒子CLDR照射和60Co γ射线HDR照射,对照组照射剂量为0 Gy,其他实验条件与照射组相同,所有实验重复3次,同时设3个平行样。
3. 克隆存活实验:指数生长期的A549和BEAS-2B细胞经胰酶消化后,以不同的细胞数接种于35 mm培养皿中。接种24 h后分别行125I粒子CLDR照射和60Co γ射线HDR照射,吸收剂量为0、2、4、6、8 Gy,细胞照射后继续置于37℃、5% CO2细胞培养箱中孵育,直至克隆形成,约10~14 d。然后经甲醇固定、结晶紫染色,计算克隆数。
4. 流式细胞仪检测细胞周期:A549和BEAS-2B细胞分别行0、2、4、6、8 Gy 125I粒子CLDR照射和60Co γ射线HDR照射。照射后24 h,细胞经胰酶消化,离心半径16 cm,1 000 r/min,离心5 min,弃上清液,冰PBS清洗1~2次,70%乙醇4℃固定过夜,再次离心(条件同前次),弃固定液,冰PBS清洗1~2次后加10 mg/ml RNA酶及300 μl 500 μg/ml PI,室温避光染色15~30 min,行流式细胞仪检测。
5. 流式细胞仪检测细凋亡:A549和BEAS-2B细胞分别行0、2、4、8 Gy 125I粒子CLDR照射和60Co γ射线HDR照射。照射后48 h按照Annexin V-FITC/PI双染凋亡试剂盒(南京铂优生物技术有限公司 )说明书依次加入500 μl缓冲液重悬细胞、5 μl Annexin V-FITC、5 μl PI,室温避光染色15~30 min后行流式细胞仪检测。
6. 蛋白印迹实验:A549和BEAS-2B细胞分别行0、4、8 Gy 125I粒子CLDR照射和60Co γ射线HDR照射。照射后24 h,胰酶消化、离心(条件同方法4)、冰PBS清洗,裂解缓冲液 (上海碧云天生物技术有限公司)、1 mmol/L PMSF (上海碧云天生物技术有限公司)、1片蛋白磷酸酶抑制剂/10 ml裂解缓冲液(德国罗氏公司)配成的蛋白裂解液抽提总蛋白,BCA法测定白浓度。制备终体积20 μl含有50 μg蛋白的蛋白样品,经SDS-PAGE电泳,依次电转至PVDF膜,5%脱脂牛奶室温封1 h,4℃孵育一抗:β-肌动蛋白,Caspase-3,Bax,Bcl-2(武汉三鹰生物技术有限公司)过夜。继而TBST洗膜、室温孵育辣根过氧化物酶-山羊抗兔IgG (H+L) (上海碧云天生物技术有限公司),辣根过氧化物酶-山羊抗大鼠IgG二抗1 h、TBST洗膜,等比例涂A、B发光液最后行ECL发光系统检测蛋白分子条带。
7. 统计学处理:实验结果以 ±s形式表示。采用GraphPad Prism 5.0软件进行分析,两组间差异比较用t检验,多组间差异比较采用单因素方差分析。P<0.05为差异有统计学意义。
±s形式表示。采用GraphPad Prism 5.0软件进行分析,两组间差异比较用t检验,多组间差异比较采用单因素方差分析。P<0.05为差异有统计学意义。
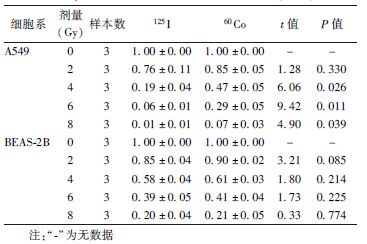
1. 克隆存活实验:如表1所示,A549细胞在125I粒子CLDR照射和60Co γ射线HDR照射后,克隆存活分数较对照组明显降低(F=262.1、254.2,P<0.05)。而A549细胞在4、6、8 Gy照射时,125I粒子CLDR照射细胞克隆存活分数较60Co γ射线HDR照射低(t=6.06、9.42、4.90,P<0.05),吸收剂量为2 Gy时两种电离辐射所致克隆存活分数之间差异无统计学意义。BEAS-2B细胞在125I粒子CLDR照射和60Co γ射线HDR照射后,克隆存活分数较对照组明显降低(F=225.2、249.9,P<0.05),但在同样照射条件下,两种电离辐射所致克隆存活分数之间差异无统计学意义。
表1 A549、BEAS-2B细胞在不同剂量125I粒子和
60Co γ射线照射后克隆存活分数的差异( ±s) ±s)
|
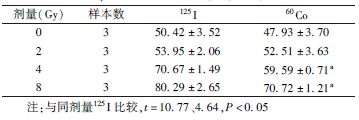
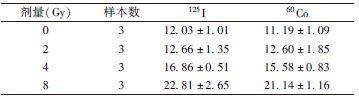
2. 细胞周期分析:如表2所示,A549细胞在4、8 Gy的125I粒子CLDR照射和60Co γ射线HDR照射后较对照组出现明显的G1期阻滞(F=163.8、39.0,P<0.05),并且125I粒子CLDR照射比60Co γ射线HDR照射导致G1期阻滞效应更明显(t=10.77、4.64,P<0.05),吸收剂量为2 Gy时细胞周期阻滞的差异并不明显。如表3所示,BEAS-2B细胞在125I粒子CLDR照射和60Co γ射线HDR照射后均出现G2/M期阻滞,但细胞周期阻滞的程度差异无统计学意义(表3)。
表2 A549细胞在不同剂量125I粒子与60Co γ射线照射后
G1期细胞比例变化(%, ±s) ±s)
|
表3 BEAS-2B细胞在不同剂量125I粒子与60Co γ射线照射后G2/M期细胞比例变化(%, ±s)
Table 3 英文名 ±s)
Table 3 英文名 |
3. 细胞凋亡分析:如表4所示,A549细胞在4和8 Gy 125I粒子CLDR照射和60Co γ射线HDR照射后细胞凋亡率较对照组明显升高(F=149.9、217.3,P<0.05),2 Gy照射时细胞凋亡率的差异无统计学意义。然而在同样的照射剂量下,125I粒子CLDR照射所致A549细胞凋亡率较60Co γ射线HDR照射更高(t=19.40、7.73,P<0.05)。但BEAS-2B细胞在两种辐射源照射后,细胞凋亡率之间差异无统计学意义。同时可以看出在125I粒子CLDR照射和60Co γ射线HDR照射后,A549细胞凋亡率明显高于BEAS-2B细胞(t=19.09、8.78、18.64、13.18,P<0.05)。
表4 A549、BEAS-2B细胞在125I粒子照射
和60Co γ射线照射后凋亡率的差异(%, ]±s) ]±s)
|
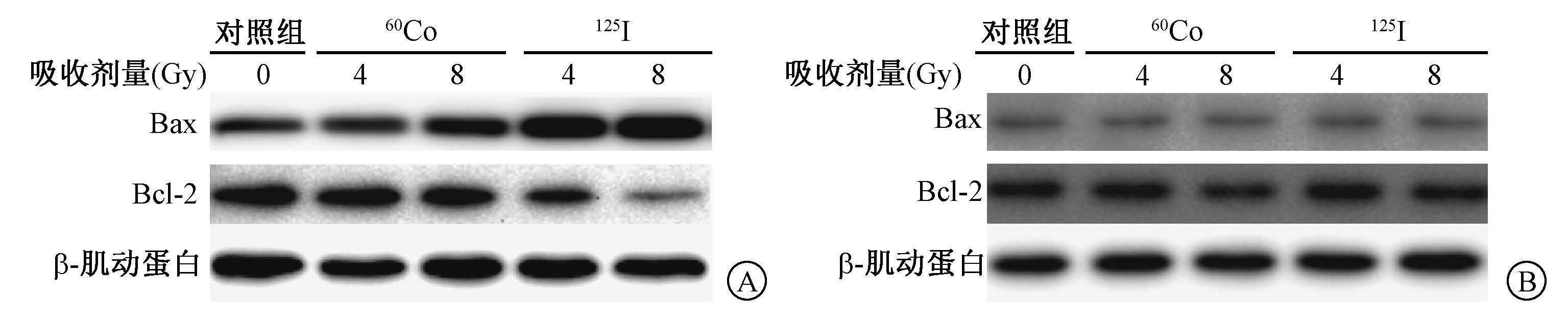
4. Bcl-2/Bax蛋白比的失衡:如图1A所示,A549细胞在4、8 Gy照射时与对照组相比Bax蛋白的表达明显上调,同时,Bcl-2蛋白的表达明显下调。并且图1A提示Bax蛋白表达上调、Bcl-2蛋白表达下调这一效应在125I粒子CLDR照射后更明显。但图1B提示同样的照射条件下,BEAS-2B细胞Bcl-2、Bax蛋白的表达均没有发生明显的变化(图1B)。
|
图1 A549、BEAS-2B细胞在125I粒子照射和60Co γ射线照射后Bax、Bcl-2蛋白表达水平 A. A549细胞;B. BEAS-2B细胞 |
5. Caspase-3蛋白的激活:如图2A所示,A549细胞在4、8 Gy的125I粒子CLDR照射和60Co γ射线HDR照射后cleaved Caspase-3蛋白的表达水平较对照组明显上调。此外,在同样的照射条件下125I粒子CLDR照射后cleaved Caspase-3蛋白的表达水平明显高于60Co γ射线HDR照射。但在BEAS-2B细胞中,与对照组相比两种辐射源照射后cleaved Caspase-3蛋白的表达水平均没有明显的变化(图2B)。

|
图2 A549、BEAS-2B细胞在125I粒子照射和60Co γ射线照射后cleaved Caspase-3蛋白表达水平 A. A549细胞;B. BEAS-2B细胞 |
125I粒子CLDR内照射治疗作为手术以及外照射治疗的备选或补充治疗措施,已逐渐应用于部分中晚期恶性肿瘤非手术患者的局部治疗[2]。本研究选用NSCLC中肺腺癌细胞系A549以及正常支气管上皮细胞系BEAS-2B探讨两种照射方式对NSCLC细胞生物学效应影响的差异。
本研究表明,125I粒子CLDR照射比60Co γ射线HDR照射抑制A549细胞增殖的效应更明显,这一趋势和其他研究结果是一致的[8]。同时正如Nishizaki等[9]研究中所表明,相对于NSCLC细胞A549而言,正常BEAS-2B细胞对两种电离辐射均表现出了一定的辐射抗拒。
众所周知,在DNA受到电离辐射损伤时,周期关卡效应会导致细胞周期阻滞,继而激活DNA损伤修复信号通路或启动死亡程序,从而导致细胞发生不同的命运[10]。本研究中,与60Co γ射线HDR照射相比125I粒子CLDR照射导致A549细胞发生更明显的G1期阻滞,并与Wang等[11]、Liao等[12]以胰腺癌细胞、前列腺癌细胞作为实验模型的研究结果趋势一致。但Wang等[11]的研究表明,在初始剂量率为2.77 cGy/h、吸收剂量为4 Gy时A549细胞发生长时程的G2/M期阻滞,而本研究中125I粒子初始剂量率为18.32 cGy/h,同样的照射剂量下A549细胞发生明显的G1期阻滞。初始剂量率、细胞状态等一系列因素的影响,可能是导致此差异的部分原因,但由于各方面的限制没有对该差异背后具体的机制进行深入的研究。同样的照射条件下,BEAS-2B细胞表现为G2/M阻滞,尽管两种电离辐射照射后细胞周期阻滞的程度并无明显差异。
当细胞受到电离辐射损伤时,尤其是DNA双链断裂损伤时,DNA损伤感受器毛细血管扩张性共济失调突变基因(ataxia telangiectasia-mutated,ATM)会在短时间内通过自身磷酸化方式激活,继而引起组蛋白H2AX以及DNA依赖蛋白激酶(DNA-dependent protein kinase,DNA-PK)等一些DNA损伤修复相关的信号通路被激活。一旦DNA DSB损伤修复失败或者是不可逆的损伤累积到一定程度,细胞将会发生凋亡或死亡[7]。其中Bcl-2蛋白主要发挥抑制凋亡、延长细胞存活的作用,在NSCLC患者中Bcl-2蛋白过 表达者对治疗多不敏感或者不理想[13]。Bax与Bcl-2蛋白作用相反,主要发挥促进凋亡的作用[4]。通常Bcl-2 蛋白和 Bax蛋白二者之间的比率决定了细胞是否发生凋亡[14]。凋亡过程中Caspase-3蛋白是最重要的凋亡执行分子,通常Caspase-3蛋白的活化,即cleaved Caspase-3蛋白的出现标志着凋亡事件的发生[15]。本研究表明,在A549细胞中,125I粒子CLDR照射比60Co γ射线HDR照射导致更多的A549细胞发生凋亡,明显上调Bax蛋白和cleaved Caspase-3蛋白的表达,下调Bcl-2蛋白的表达,表明Bcl-2蛋白与Bax蛋白比率的失衡可能促进A549细胞凋亡的发生。通常认为随着剂量率的降低,照射时间逐渐延长,细胞杀伤作用也会逐渐减弱,但针对本研究中125I粒子CLDR照射比60Co γ射线HDR照射导致更多的A549细胞发生凋亡这一结果可以用反剂量率效应和低剂量率高放射敏感性来解释,即当剂量率<1 Gy/h时,随着剂量率的降低细胞的放射敏感性会逐渐升高[16, 17]。Wéra等[16]和Collis等[18]的研究表明,反剂量率效应可能是由于低剂量率和低剂量照射时不能或不能有效的激活ATM,其下游的组蛋白H2AX和DNA PK等DNA损伤修复相关蛋白也不能被有效激活,最终导致Bcl-2蛋白与Bax蛋白比率的失衡以及Caspase-3蛋白的激活,从而表现为低剂量率或低剂量照射后细胞凋亡率的增加。然而,BEAS-2B在两种电离辐射照射后均产生细胞克隆存活分数轻微的降低、明显的G2/M期阻滞,但凋亡率没有发生明显变化,与A549细胞相比BEAS-2B细胞表现出了一定的辐射抗拒,这与其他学者的研究结果相符[9]。
125I粒子CLDR照射比60Co γ射线HDR照射抑制A549细胞增殖的效应更明显,与A549细胞相比,BEAS-2B细胞对两种电离辐射表现出了一定的辐射抗拒。Bcl-2/Bax蛋白比率的失衡、最终致Caspase-3蛋白的活化在125I粒子CLDR照射抑制肿瘤细胞增殖的效应中可能发挥重要的作用。但鉴于各方面的限制,本研究仅仅着重于研究凋亡,而没有更深入的研究DNA损伤修复以及细胞周期关卡效应。尽管如此,本研究仍为中晚期NSCLC患者的临床治疗提供了一些实验依据。
| [1] | Lehnert S, Reniers B, Verhaegen F. Relative biologic effectiveness in terms of tumor response of 125I implants compared with 60Co gamma rays[J]. Int J Radiat Oncol Biol Phys, 2005, 63(1):224-249. |
| [2] | Wang ZM, Lu J, Liu T, et al. CT-guided interstitial brachytherapy of inoperable non-small cell lung cancer[J]. Lung Cancer, 2011, 74(2):253-257. |
| [3] | 陈志国. 125I粒子近距离植入与常规放射治疗对小鼠肺癌移植瘤作用的实验研究[D]. 石家庄:河北医科大学,2007. |
| [4] | 戚良晨,韩振国,杨斌,等. 放射性125I粒子植入对犬正常支气管、食管、肺动脉、肺静脉和肺泡结构的影响及安全性[J]. 吉林大学学报(医学版),2008,34(5):821-824. |
| [5] | Aird EG, Folkard M, Mayes CR, et al. A purpose-built iodine-125 irradiation plaque for low dose rate low energy irradiation of cell lines in vitro[J]. Br J Radiol, 2001, 74(877):56-61. |
| [6] | 王济东,王俊杰,赵勇,等. 放射性125I粒子持续低剂量率照射胰腺癌细胞株PANC-1相对生物学效应的研究[J]. 中华放射医学与防护杂志,2008,28(3):252-255. |
| [7] | 苗利,李新民. 钴-60治疗机射野剂量的测量分析[J]. 苏州大学学报(医学版),2012,32(2):170-173. |
| [8] | Qu A, Wang H, Li J, et al. Biological effects of 125I seeds radiation on A549 lung cancer cells: G2/M arrest and enhanced cell death[J]. Cancer Invest, 2014, 32(6):209-217. |
| [9] | Nishizaki M, Meyn RE, Levy LB, et al. Synergistic inhibition of human lung cancer cell growth by adenovirus-mediated wild-type p53 gene transfer in combination with docetaxel and radiation therapeutics in vitro and in vivo[J]. Clin Cancer Res, 2001, 7(9):2887-2897. |
| [10] | Kastan MB, Bartek J. Cell-cycle checkpoints and cancer[J]. Nature, 2004, 432(7015):316-323. |
| [11] | Wang J, Wang J, Liao A, et al. The direct biologic effects of radioactive 125I seeds on pancreatic cancer cell PANC-1, at continuous low-dose rates[J]. Cancer Biother Radiopharm, 2009, 24(4):409-416. |
| [12] | Liao A, Wang J, Zhuang H, et al. Relative biological effectiveness and cell-killing efficacy of continuous low-dose-rate 125I seeds on prostate carcinoma cells in vitro[J]. Integr Cancer Ther, 2010,9(1):59-65. |
| [13] | Groeger AM, Esposito V, De Luca A, et al. Prognostic value of immunohistochemical expression of p53, BAX, Bcl-2 and BclxL in resected non-small-cell lung cancers[J]. Histopathology, 2004, 44(1): 54-63. |
| [14] | Walensky LD. Bcl-2 in the cross hairs: tipping the balance of life and death[J]. Cell Death Differ, 2006, 13(8):1339-1350. |
| [15] | Odonkor CA, Achilefu S. Modulation of effect or caspase cleavage determines response of breast and lung tumor cell lines to chemotherapy[J]. Cancer Invest, 2009, 27(4):417-429 |
| [16] | Wéra AC, Borlon C, Nuttens VE, et al. Comparison of the clonogenic survival of A549 non-small cell lung adenocarcinoma cells after irradiation with low-dose-rate beta particles and high-dose-rate X-rays [J]. Int J Radiat Biol,2012, 88(3):253-257. |
| [17] | Hall EJ, Giaccia AJ. Radiobiology for the radiologist[M]. Philadelphia:Lippincott Williams & Wilkins, 2011. |
| [18] | Collis SJ, Schwaninger JM, Ntambi AJ, et al. Evasion of early cellular response mechanisms following low level radiation-induced DNA damage[J]. J Biol Chem,2004, 279(48):49624-49632. |
 2015, Vol. 35
2015, Vol. 35