尽管放疗技术不断进步,但是颅内及头颈部肿瘤治疗时仍然有部分正常脑组织可能受到照射,随之而来会出现认知功能障碍[1],中枢神经系统(CNS)可能出现急性或迟发性损伤[2]。研究表明,辐射诱导的神经认知功能障碍的一个可能机制是由于海马神经功能障碍,包括神经发生的损伤和神经细胞的损耗[3, 4]。神经突起是神经细胞之间发生突触联系的主要功能结构,决定着神经元的不同功能作用,神经元轴突分支数目和类型的改变常常伴随着严重的认知功能障碍,影响学习和记忆[5, 6, 7]。已有大量在体情况下电离辐射所诱导的脑损伤研究,但只有一部分研究报道离体条件下电离辐射对神经元的影响[5, 8, 9]。本研究采用离体的方式,并排除其他的实验干扰因素,探讨电离辐射对神经突起的直接影响。
1.主要试剂与仪器:胰酶、神经元培养基、胎牛血清(FBS)均购于美国GIBCO公司;多聚赖氨酸、MTT、神经元特异性多克隆抗体β-tubulin、DAPI均购于美国Sigma公司;B27购于美国Invitrogen公司。神经元培养基由Neurobasal、1×B27、100 U/ml青霉素、0.1 mg/ml链霉素和1%谷氨酰胺组成。直线加速器购于瑞典Elekta公司。
2.实验动物:清洁健康C57BL/6J孕鼠由苏州大学动物实验中心提供,所有小鼠按标准实验条件饲养,每笼4只,自由饮食饮水,室温保持在(22±2)℃,每12小时昼夜循环1次。本研究所有实验通过苏州大学动物保护与伦理委员会的批准。
3.海马神经元原代培养:孕第18天胎鼠,断头,将脑组织浸泡于Hank′s平衡盐溶液中,放于冰上,在显微镜下剥离脑组织,取出海马,将海马组织剪碎后,放入0.125%的胰酶中37℃水浴消化10 min,用神经元培养基冲悬细胞,并以2×105和8×103~10×103的细胞数分别接种到用多聚赖氨酸包被的24孔板和96孔板中,放于37℃、5%CO2培养箱中培养。神经元细胞种板后6 h半换液,以后每隔1天换1次液。
4. 细胞照射:原代海马神经元细胞培养1 d后,采用6 MV X射线直线加速器进行照射,平均吸收剂量率为3.1 Gy/min,受照剂量分别为0、2、4、8、10和12 Gy。海马神经元在照射后第1天和第3天进行相关实验。
5. 细胞活性实验:海马神经元细胞受照后第1天和第3天,向96孔板每孔中加入10 μl四甲基偶氮唑盐(MTT)溶液,继续放于CO2培养箱中孵育4 h,然后终止培养,小心弃掉孔中的上清液,再向每孔中加入100 μl 二甲基亚砜(DMSO),放于摇床上振荡约30 min,使紫蓝色结晶充分溶解,然后检测波长为490 nm处的吸光度,计算细胞存活曲线。
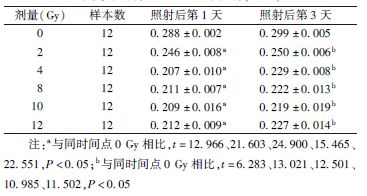
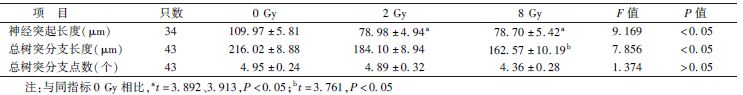
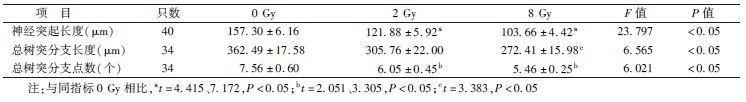
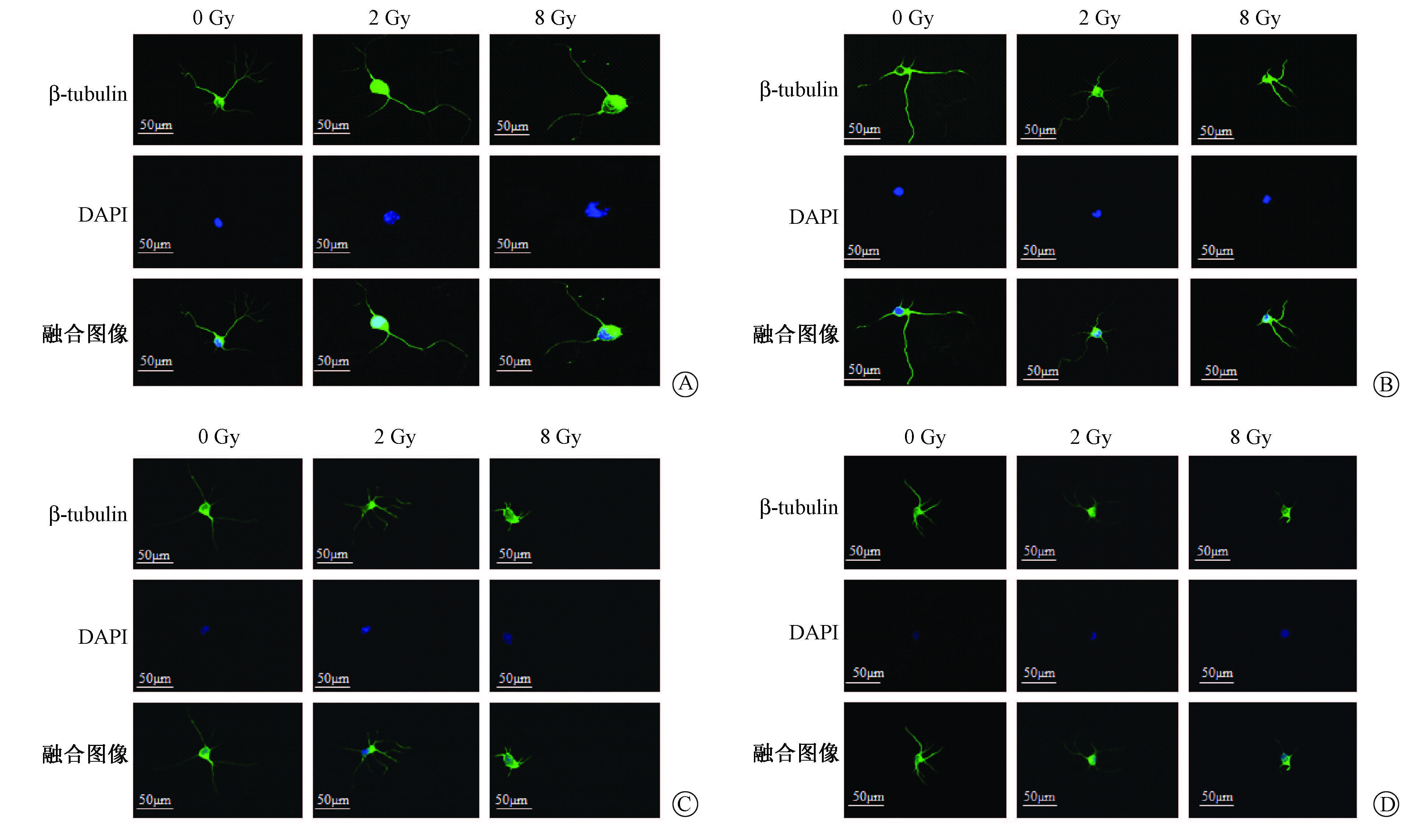
6. 免疫荧光染色:神经元细胞照射后第1天和第3天,PBS缓冲液洗涤后用4%多聚甲醛固定15 min,然后用PBS洗涤3次,再用0.1% Triton X-100打孔,5 min后再次用PBS洗涤3次后,在室温条件下用10%FBS封闭60 min。然后孵育一抗,β-tubulin(1[DK]∶500)室温孵育2 h。用PBS洗涤后,室温孵育二抗1 h,再次用PBS洗涤后,DAPI染核、封片。使用Zeiss荧光显微镜观察,图像放大40倍,随机选择5~7个视野,随机视野的选择以能观察细胞核为相对的细胞密度。定义双染了DAPI和β-tubulin为活的神经元细胞,且只有孤立的神经元细胞能用于分析。在每一个实验条件下,最少有30个神经元来分析其轴突形态。神经突起的长度定义为沿轴突方向尽可能远的长度,即从神经元胞体到最长的神经突起(如果有一个以上的神经突起存在)端部的距离或者到最长分支点端部的距离[10]。此外,神经突起的形态分析还包括总树突分支长度(total dendritic branch length,TDBL)和总树突分支点数(total dendritic branch tip number,TDBTN)[11]。神经突起长度测量采用Image J1.4.3.6软件。
7. 统计学处理:实验数据以[AKx-D]±s表示。采用SPSS 17.0 统计软件,对神经突起长度、总树突分支长度、总树突分支点数进行单因素方差分析和独立样本t检验。P<0.05为差异有统计学意义。
1. 电离辐射对原代海马神经元的影响:MTT结果显示,在照射后第1天和第3天,随着剂量的增加,海马神经元细胞死亡增多,差异有统计学意义(第1天:t=12.966~24.900,P<0.05;第3天:t=6.283~13.021,P<0.05);但4、8、10、12 Gy组间差异无统计学意义(P>0.05),即超过一定剂量后,海马神经元的死亡不具有剂量依赖性,见表1。
表1 不同剂量照射后不同时间X射线对
原代海马神经元死亡的影响( ±s) ±s)
|
2.电离辐射对原代海马神经元神经突起的影响:结果见图1,表2,表3。免疫荧光染色结果显示,随着时间的延长,神经突起长度、TDBL、TDBTN逐渐增加。神经突起长度0 Gy组在照射后第1天和第3天,与2、8 Gy组相比更长,且这种改变在照射后第3天更明显(第1天,t=3.892、3.913,P<0.05;第3天,t=4.145、7.172,P<0.05),而2 Gy组与8 Gy组相比,差异无统计学意义。TDBL与神经突起长度变化相一致,0 Gy组与8 Gy组比较,差异有统计学意义(t=3.761、3.383,P<0.05)。同样,电离辐射能够减少TDBTN,0 Gy组与2、8 Gy组相比,在照射后第3天差异有统计学意义(t=2.051、3.505,P<0.05)。
|
图1 不同时间点及剂量点下电离辐射对原代海马神经元神经突起长度、总树突分支长度(TDBL)和总树突分支点数(TDBTN)的影响 ×40 A、B分别为照射后第1天和第3天海马神经元神经突起长度;C、D分别为照射后第1天和第3天海马神经元TDBL和TDBTN |
表2 小鼠
神经突起、树突分支在不同剂量照射后第1天的变化( ±s) ±s)
|
表3 小鼠
神经突起、树突分支在不同剂量照射后第3天的变化( ±s) ±s)
|
以往有大量的研究报道都集中于在体情况下电离辐射对大脑组织的损伤,但是在体情况下的研究非常容易受到外界其他干扰因素的影响[5, 9, 12]。即使是培养海马神经元细胞,大部分的研究也是以观察电离辐射对成熟神经元的作用为目的或以细胞凋亡作为观察终点,缺乏关于电离辐射对原代海马神经元突起生长抑制作用的相关研究报道[8, 13, 14]。因此,本研究观察了电离辐射对原代海马神经元突起生长的直接抑制作用。
Shirai等[15]通过实验证实了在大剂量X射线照射下,成熟海马神经元较未成熟的具有更强的放射抵抗性,同时,对于未成熟神经元而言,在突触形成的不同阶段对射线的抵抗性也不同。Shirai等[13]同时还论证了成熟神经元经过X射线照射,降低了其细胞骨架蛋白的数量,如F-肌动蛋白、大脑调节蛋白,而导致其树突棘形态和密度的变化。Chakraborti等[9]通过实验论证了小鼠经过全颅照射后,在海马的不同区域,不同类型的神经元树突棘形态、密度的变化情况。但以上实验均采用了大剂量(10~90 Gy)电离辐射来进行研究,同时,其培养条件是海马神经元与胶质细胞共培养,而胶质细胞能够分泌一些细胞因子、生长因子等来促进神经元的存活和发育[16]。而本实验是在离体条件下,研究单纯海马神经元(未与胶质细胞共培养)电离辐射对其神经突起的直接作用。
MTT实验结果显示,电离辐射会导致原代海马神经元细胞的死亡,但是神经元作为一种不可再生细胞,其对电离辐射的抵抗力较星形胶质细胞、血管内皮细胞等可再生细胞强[8];且在经过4、8、10、12 Gy X射线照射后,原代海马神经元的死亡不会随着剂量的增大而增加,即表明超过一定的剂量,原代海马神经元细胞的死亡不会随着剂量的增大而增加,不具有剂量依赖性,因此,选取0、2、8 Gy作为免疫荧光染色实验照射剂量。
免疫荧光染色结果显示,原代海马神经元经过X射线照射后的第1天和第3天,与0 Gy组相比,2和8 Gy照射组的神经突起长度以及TDBL、TDBTN有了减少和降低,说明电离辐射对神经突起生长的抑制作用至少能持续到照射后第3天。但是,TDBL和TDBTN仅在部分照射组间差异有统计学意义,说明神经突起长度具有比TDBL、TDBTN更明显的变化,对射线的反应更加敏感。此外,无论是照射后第1天还是在照射后第3天,神经突起长度、TDBL、TDBTN,2 Gy与8 Gy组间差异均无统计学意义,说明8 Gy并不具有比2 Gy更强的对神经突起生长的抑制作用。而照射后第3 天是否为最佳检测时间点,以及8 Gy是否是导致神经突起抑制作用最明显的剂量,还需要进一步验证。
既往研究观察电离辐射导致的神经突起的改变都集中在树突棘形态和密度的变化[9, 13, 15],而神经突起的长度、TDBL、TDBTN,尤其是神经突起长度,是一个更为直观、敏感、简便的观察手段,更能帮助发觉电离辐射对神经元的影响,尤其在早期阶段。
综上所述,电离辐射对神经突起长度、TDBL、TDBTN有抑制作用,而神经突起的生长抑制又可能与中枢神经系统神经元功能障碍有直接关联。临床上,神经系统疾病包括阿尔茨海默病和唐氏综合征等已经有报道说明其与神经突起形态异常有关[17, 18]。同样,电离辐射所诱导的认知功能障碍部分原因可能也是因为神经突起生长受到抑制[9]。因而,推测电离辐射引起患者的神经功能障碍是由于神经突起的生长受到抑制,因此,可以进一步研究电离辐射抑制神经突起生长过程中的某一信号通路来深入了解其发生的可能机制,如NFATc4/3信号通路。在中枢神经系统,NFAT能够促进突起的生长、突触的形成、神经系统的发育和神经细胞的存活[19, 20, 21, 22, 23],而成年人海马齿状回能够表达NFATc4/3,其能够促进神经元的存活、树突的形成和突起的生长[24],这对于提高患者的远期生存率有着深远地影响。
| [1] | Maldaun MV, Aguiar PH, Lang F, et al. Radiosurgery in the treatment of brain metastases: critical review regarding complications[J]. Neurosurg Rev, 2008,31(1):1-8. |
| [2] | Chang EL, Wefel JS, Hess KR, et al. Neurocognition in patients with brain metastases treated with radiosurgery or radiosurgery plus whole-brain irradiation: a randomised controlled trial[J]. Lancet Oncol, 2009,10(11):1037-1044. |
| [3] | Monje ML, Vogel H, Masek M, et al. Impaired human hippocampal neurogenesis after treatment for central nervous system malignancies[J]. Ann Neurol, 2007,62(5):515-520. |
| [4] | Rola R, Raber J, Rizk A, et al. Radiation-induced impairment of hippocampal neurogenesis is associated with cognitive deficits in young mice[J]. Exp Neurol, 2004,188(2):316-330. |
| [5] | Parihar VK, Limoli CL. Cranial irradiation compromises neuronal architecture in the hippocampus[J]. Proc Natl Acad Sci USA, 2013,110(31):12822-12827. |
| [6] | Huttenlocher PR. Dendritic and synaptic pathology in mental retardation[J]. Pediatr Neurol, 1991,7(2):79-85. |
| [7] | Tronel S, Fabre A, Charrier V, et al. Spatial learning sculpts the dendritic arbor of adult-born hippocampal neurons[J]. Proc Natl Acad Sci USA, 2010,107(17):7963-7968. |
| [8] | Song MS, Kim JS, Yang M, et al. Gamma-ray susceptibility of immature and mature hippocampal cultured cells[J]. J Vet Med Sci, 2010,72(5):605-609. |
| [9] | Chakraborti A, Allen A, Allen B, et al. Cranial irradiation alters dendritic spine density and morphology in the hippocampus[J]. PLoS One, 2012,7(7):e40844. |
| [10] | Roehm PC, Xu N, Woodson EA, et al. Membrane depolarization inhibits spiral ganglion neurite growth via activation of multiple types of voltage sensitive calcium channels and calpain[J]. Mol Cell Neurosci, 2008,37(2):376-387. |
| [11] | Yu X, Malenka RC. Beta-catenin is critical for dendritic morphogenesis[J]. Nat Neurosci, 2003,6(11):1169-1177. |
| [12] | Wu PH, Coultrap S, Pinnix C, et al. Radiation induces acute alterations in neuronal function[J]. PLoS One, 2012,7(5):e37677. |
| [13] | Shirai K, Mizui T, Suzuki Y, et al. X irradiation changes dendritic spine morphology and density through reduction of cytoskeletal proteins in mature neurons[J]. Radiat Res, 2013,179(6):630-636. |
| [14] | Yang M, Song MS, Kim SH, et al. Cytotoxicity of gamma-ray in rat immature hippocampal neurons[J]. J Vet Sci, 2011,12(3):203-207. |
| [15] | Shirai K, Mizui T, Suzuki Y, et al. Differential effects of X-irradiation on immature and mature hippocampal neurons in vitro[J]. Neurosci Lett, 2006,399(1-2):57-60. |
| [16] | 王国卿,封丽芳,夏作理.星形胶质细胞的生物学功能与神经元修复[J].中国临床康复,2005,9(1):146-148. |
| [17] | Fiala JC, Spacek J, Harris KM. Dendritic spine pathology: cause or consequence of neurological disorders?[J]. Brain Res Brain Res Rev, 2002,39(1):29-54. |
| [18] | Kojima N, Shirao T. Synaptic dysfunction and disruption of postsynaptic drebrin-actin complex: a study of neurological disorders accompanied by cognitive deficits[J]. Neurosci Res, 2007,58(1):1-5. |
| [19] | Benedito AB, Lehtinen M, Massol R, et al. The transcription factor NFAT3 mediates neuronal survival[J]. J Biol Chem,2005,280(4):2818-2825. |
| [20] | Graef IA, Wang F, Charron F, et al. Neurotrophins and netrins require calcineurin/NFAT singaling to stimulate outgrowth of embryonic axons[J].Cell,2003,113(5):657-670. |
| [21] | Abdul HM, Sama MA, Furman JL, et al. Cognitive decline in Alzheimer's disease is associated with selective changes in calcineurin/NFAT signaling[J]. J Neurosci, 2009,29(41):12957-12969. |
| [22] | Schwartz N, Schohl A, Ruthazer ES. Neural activity regulates synaptic properties and dendritic structure in vivo through calcineurin/NFAT signaling[J]. Neuron, 2009,62(5):655-669. |
| [23] | Nguyen T, Di Giovanni S. NFAT signaling in neural development and axon growth[J]. Int J Dev Neurosci, 2008, 26(2):141-145. |
| [24] | Quadrato G, Benevento M, Alber S, et al. Nuclear factor of activated T cells (NFATc4) is required for BDNF-dependent survival of adult-born neurons and spatial memory formation in the hippocampus[J]. Proc Natl Acad Sci USA,2012,109(23):E1499-1508. |
 2015, Vol. 35
2015, Vol. 35