2. 佛山市第二人民医院超声科
CD45抗原是一种白细胞共同抗原,广泛分布于髓系和淋巴系前体细胞及淋巴结中的成熟细胞表面,在90%以上的急性髓细胞白血病、大多数急性淋巴细胞白血病与淋巴瘤患者中亦有所表达,选择抗CD45单抗可以用于急性髓细胞白血病、急性淋巴细胞白血病及淋巴瘤的治疗[1, 2, 3]。近年来,随着对CD45抗原的结构、功能及与疾病的关系研究的深入,CD45抗原在血液恶性肿瘤的诊断与治疗中的应用越来越受到重视,对抗CD45抗体特性的深入研究有望为血液系统恶性肿瘤提供新的治疗手段[4, 5, 6]。而188Re(Eβmax=2.12 MeV、Eγ=155 keV、T1/2=17.0 h)是近年出现的一种较理想的放射性核素,β射线能量较高,对肿瘤细胞有较强的杀伤力,而γ射线又可用于显像,便于临床上估算吸收剂量和进行药代动力学研究,可以同时进行显像与治疗[7, 8, 9]。本研究根据国内外研究现状,选择广谱表达的CD45抗原作为靶点,采用亲和素-生物素系统预定位技术[10, 11],将188Re 标记到CD45单抗及亲和素上,建立二步预定位方法,研究二步法预定位及188Re-CD45单抗对CD45高表达的Raji细胞系的靶向结合性及抗肿瘤作用,并对两者的抗肿瘤效应进行比较,探讨二步法预定位靶向治疗淋巴瘤的可行性。
1. 主要材料及仪器:抗人CD45单抗购于生工生物工程(上海)有限公司;亲和素(Avidin)、生物素活化酯、HABA/Avidin试剂、CCK-8试剂、DMSO购于美国Sigma公司;RPMI 1640培养基、胎牛血清、0.25%胰蛋白酶、青、链霉素双抗购于美国GIBCO公司;丙酮购于广东光华化学厂有限公司;2-巯基乙醇购于美国Amresco公司(广州市达晖生物技术有限公司分装);氯化亚锡(SnCl2)购于广东光华科技股份有限公司;葡庚糖酸钠及牛血清白蛋白购于上海伯奥生物科技有限公司;SN-682型放射免疫γ计数器购于上海核福光电仪器有限公司;紫外分光光度计购于上海光谱仪器有限公司;M5多功能酶标仪购于美国Molecular Devices公司。
2.细胞培养:B细胞淋巴瘤Raji细胞系由南方医科大学南方医院血液科提供。采用悬浮细胞培养法培养,用含10%胎牛血清的RPMI 1640培养基培养,在37℃、5%CO2和95%相对湿度的孵箱内孵育,每2天传代1次。在细胞对数生长期进行实验。
3.CD45单抗的生物素化及活性测定:将CD45单抗与生物素活化酯的摩尔比为1∶30~1∶50取样,生物素活化酯/二甲基亚砜(DMSO)溶液滴加至CD45单抗的碳酸氢钠溶液中,室温振荡反应1 h,取一定量生物素化CD45抗体反应液于PD-10柱中,4℃离心纯化,离心半径10 cm,2 000 r/min,离心5 min;采用ELISA法鉴定生物素化活性;采用HABA/Avidin试剂进行CD45单抗生物素化程度测定。
4. CD45单抗及Avidin的188Re标记方法和鉴定:按文献[5]方法,CD45单抗及Avidin的还原采用2-ME法,188Re的还原采用氯化亚锡法,分别将上述两种还原溶液混合均匀,室温反应2 h。纸层析法测定其标记率,固定相为新华1号滤纸,展开剂为混合物溶液(氨水∶乙醇∶水=1∶2∶5)和生理盐水。
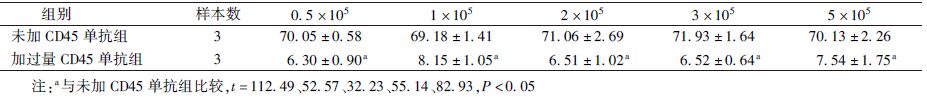
5. 188Re-CD45单抗与Raji细胞的体外结合实验及竞争结合抑制实验:待细胞增殖至对数生长期,以RPMI 1640培养基重悬,制成细胞数分别为0.5×105、1×105、2×105、3×105和5×105的细胞悬液。将不同浓度的细胞分别加入离心管,每个浓度3管,各管再加入20 μl(7.4×104 Bq)标记物。在37℃细胞培养箱中温育1 h,分别测各管总放射性计数(T);4℃离心5 min,离心半径10 cm,2 000 r/min,后去上清液,用PBS(0.01 mol/L,pH 7.4)洗涤2次,再测量结合在细胞上的放射性计数(B)并计算其结合率。同时做竞争结合实验,在各管细胞中先加入50 μg未标记的CD45单抗,然后再加入20 μl的标记物,余步骤同前,测量结合在细胞上的放射性计数(B)并计算其结合率。
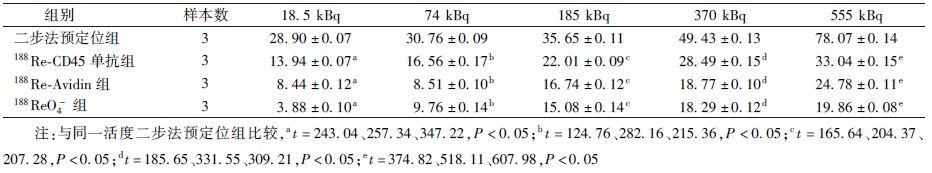
6. 体外培养Raji细胞增殖抑制试验:体外培养Raji细胞的增殖抑制效应采用CCK-8测定法进行评估,设置4个实验组:二步法预定位组、188Re-Avidin组、 188Re-CD45单抗组和188ReO-4组。将Raji细胞浓度调整为4×104/孔,接种于96孔板,37℃培养箱孵育1 h后,各组分别相应加入1.85×104、7.4×104、18.5×104、37×104和55.5×104Bq 5种剂量的放射性药物,每个剂量设3个复孔,以未加药(只有细胞和培养液)为对照组,并设空白调零组(只加药和培养液,没有细胞),于细胞孵育一定时间后取出96孔板,再加入10 μl CCK-8继续孵育1~2 h后,用酶标仪检测450 nm波长吸光度。计算Raji细胞存活率和抑制率。
7. 统计学处理:数据用x±s表示。采用SPSS 13.0统计软件分析。采用单因素方差分析和独立样本t检验分析数据;相关性检验采用Pearson积差相关。P<0.05为差异有统计学意义。
1.CD45单抗的生物素化程度及活性的测定:ELISA法测定生物素化CD45单抗(鼠源性)的免疫活性平均为 (90.57±8.13) %;采用HABA/Avidin试剂测定,平均每个CD45单抗分子可结合40个生物素分子。
2.188Re标记CD45单抗及Avidin的标记率测定:经多次标记实验得出,在最佳标记条件下,188Re-CD45单抗标记率平均为(82.52±2.92)%,188Re-Avidin标记率平均为(80.83±3.48)%,经PD-10柱纯化后,二者放化纯度均>90%,二者放射性比活度平均为(2.06±0.07)TBq/mmol。
3.188Re-CD45单抗与Raji细胞的体外结合实验和竞争结合抑制实验:188Re-CD45单抗与Raji细胞的总结合率平均为(78.88±1.62)%,表明CD45单抗经188Re标记后仍保持着较好的免疫活性。在竞争结合抑制实验中,同时加入标记物和过量的CD45单抗,细胞结合率平均仅为(7.96±0.87)%,而未加入过量的CD45单抗,其细胞结合率平均为(70.92±1.91)%,表明标记的CD45单抗与Raji细胞的结合可被未标记的CD45单抗竞争性抑制,提示标记CD45单抗与Raji细胞的结合具有特异性(表1)。
表1 188Re-CD45单抗与不同细胞数Raji细胞的体外竞争结合率比较(%, ±s) ±s)
|
4.188Re标记物不同处理组对体外培养的Raji细胞增殖抑制作用:采用CCK-8测定Raji细胞增殖抑制实验结果如表2所示。二步法预定位组、188Re-CD45单抗组、188Re-Avidin组和188ReO-4组对Raji细胞的增殖均有抑制作用,其抑制率与放射性活度呈正相关关系(r=0.907、0.992、0.968、0.976,P<0.05);在相同的放射性活度下,二步法预定位组抑制作用均强于188Re-CD45组、188Re-Avidin组和188ReO-4组(t=124.76~607.98,P<0.05);而188Re-Avidin组和188ReO-4组的抑制作用差异无统计学意义(P>0.05)。
表2 188Re标记物不同处理组在不同放射性活度下对体外培养Raji细胞的抑制率(%, ±s) ±s)
|
血液系统恶性肿瘤,包括急性白血病、慢性白血病、恶性淋巴瘤等,是严重威胁人类健康和生命的疾病,而传统的放化疗并不能彻底治愈血液系统恶性肿瘤以及延长患者的生存时间和降低其死亡率[12]。而基于单克隆抗体的放射免疫靶向治疗则具有靶向性强、特异性高和不良反应小等特点,将显著提高对血液系统恶性肿瘤的治愈率,极大地改善患者的生活质量[3, 6]。目前已经用于临床的有放射性标记抗CD20单抗[13],还有许多正在进行Ⅰ期、Ⅱ期临床试验。Pagel等[14]比较了抗CD20单抗和抗CD45单抗在小鼠B系淋巴瘤的放射免疫治疗中的疗效,同量放射性标记的抗CD45单抗在肿瘤组织中的吸收量是抗CD20单抗的1.2~1.4倍,肿瘤组织和正常组织的吸收比较,抗CD45单抗为1.5 ∶1(血液)~20 ∶1(小肠),抗CD20单抗为0.4 ∶1(血液)~9.8 ∶1(小肠)。CD45抗原在白细胞表面广泛表达,而在其他实体组织细胞上不表达,具有良好的靶向性。188Re具有良好的核物理与生物学行为,研究表明,高铼酸盐在各脏器吸收较少并很快地通过尿排泄,在人体内的生物半衰期<10 h,不会对人体造成严重的辐射损伤,有可能在肿瘤的治疗方面起到很好的作用[9]。
本研究将具有“广谱”抗肿瘤特性的CD45单抗作为放射性核素的靶向载体,选用诊治兼用的放射性核素188Re对其进行标记,制备具有特异性靶向作用的放射免疫药物,为进一步提高放射免疫治疗药物的疗效,又将亲和素-生物素系统的预定位技术应用于单抗的放免治疗中,利用亲和素-生物素高度特异性结合能力及信号放大作用,以及188Re优良的核素性质可把药物的不良反应降低到最低水平,而且基于CD45单抗的靶向放射免疫药物的研究国内外报道较少[15, 16]。预定位的概念是针对放射性核素标记抗体类药物而言的,其原理是将抗肿瘤抗体与放射性核素分开给药,延长抗体在肿瘤细胞上的滞留时间,使肿瘤结合与未结合抗体之比达最大值 [11, 12, 15],预定位技术的优点是增加了放射性药物在肿瘤组织的浓聚,提高了药物的有效性并减少了不良反应。与传统的放射性核素标记单抗相比,预定位技术显示了更好的治疗效果,显著地提高了肿瘤组织中的放射性剂量[15]。为此,本研究选择CD45高表达的Raji细胞系,利用体外细胞培养技术检测188Re-CD45单抗的靶向结合性及二步法预定位体外抗肿瘤作用。188Re-CD45单抗与Raji细胞的体外竞争结合实验表明:CD45单抗经188Re标记后仍保持着较好的免疫结合活性,且可被未标记的CD45单抗竞争性抑制,表明188Re标记的CD45单抗可特异性地结合Raji细胞,即对淋巴瘤Raji细胞具有靶向性。
目前,研究抗肿瘤药物对体外培养的肿瘤细胞抑制作用的常用方法是MTT法。其原理为活细胞线粒体中的琥珀脱氢酶能使黄色可溶的MTT还原为难溶性的蓝紫色的甲臜(formazam)结晶,而死细胞没有此功能。这种结晶物能溶解于二甲亚砜(DMSO)中,并能用酶联免疫检测仪测定溶液在490 nm处的吸光度,这个吸光度值在一定范围内和细胞数量成正比。而本实验采用的CCK-8试剂盒,是一种基于WST-8的广泛应用于细胞增殖和细胞毒性的快速高灵敏度检测试剂盒。WST-8是一种类似于MTT的化合物,在电子耦合试剂1-Methoxy PMS存在的情况下,可以被还原生成橙黄色水溶性的甲臜。细胞增殖越多越快,则颜色越深;细胞毒性越大,则颜色越浅。对于同样的细胞,颜色的深浅和细胞数目呈线性关系。本试剂盒与传统的MTT法相比具有明显的优势:①CCK-8法是一种灵敏度高、操作简便、使用安全的细胞增殖与毒性检测方法;②CCK-8法对细胞无毒,可以多次测定选取最佳测定时间,与MTT方法相比线性范围更宽,灵敏度更高;③CCK-8溶液不需配制,可以直接加入到细胞样品中,即开即用,比MTT更加稳定,实验结果重复性好;④MTT实验生成的formazam不是水溶性的,需要使用DMSO等有机溶剂溶解;而本方法产生的formazam是水溶性的,不仅省去了溶解步骤,更因此减少了该操作步骤带来的误差。基于上述原因,本实验中采用CCK-8法研究4种188Re标记物对体外培养的Raji细胞的抑制作用,结果表明二步法预定位组、188Re-CD45单抗组、188Re-Avidin组和188ReO-4组对Raji细胞的增殖均有不同程度的抑制作用,其抑制率与放射性活度呈正相关关系;在放射性活度相等的情况下,二步法预定位组在各时间点抑制作用均明显高于188Re-CD45单抗组、188Re-Avidin组和188ReO-4组;而188Re-Avidin组和188ReO-4组相比,抑制作用差异无统计学意义。实验结果表明,二步法预定位可以增强放射性核素对Raji细胞的杀伤与抑制作用。其原因可能与CD45单抗的特异性结合作用、预定位方式充分保留了生物素化CD45单抗的免疫结合活性以及放射性核素标记的亲和素可在肿瘤细胞内尽可能多的集聚,从而提高了杀伤Raji细胞的放射效应[17]。因此,CD45单抗介导的188Re-Avidin的二步法预定位对Raji细胞的杀伤作用应高于188Re-CD45单抗,本实验结果也证实了这一点。而188Re-Avidin和188ReO-4因均不能与Raji细胞发生特异性结合,当吸去药物时,其杀伤作用也随之停止,因而抑癌作用较弱。
总之,本研究结果证实二步法预定位对体外培养肿瘤细胞增殖的抑制效应方面取得了初步的成功,但考虑到体外细胞试验与荷瘤动物模型不完全相同,仍需在荷瘤小鼠动物模型中实施二步法预定位放免治疗的研究,以验证二步法预定位体内抗肿瘤作用的有效性。
| [1] | Ratei R, Sperling C, Karawajew L, et al. Immunophenotype and clinical characteristics of CD45-negative and CD45-positive childhood acute lymphoblastic leukemia[J]. Ann Hematol, 1998, 77(3): 107-114. |
| [2] | 郑文莉,李贵平. 亲和素-生物素系统预定位放免治疗白血病的研究[J]. 放射免疫学杂志, 2013, 26(4): 428-432. |
| [3] | 汪兵,李贵平. 放射性核素标记单克隆抗体靶向治疗血液系统恶性肿瘤[J]. 放射免疫学杂志, 2011, 24(2): 144-147. |
| [4] | 李贵平, 汪兵, 黄宝丹,等. CD45单抗介导的淋巴瘤荷瘤裸鼠三步法预定位放免显像[J]. 中山大学学报(医学科学版), 2014, 35(1):127-131. |
| [5] | 郑文莉, 李贵平, 黄宝丹,等. 188Re直接法标记CD45单抗及其体内生物分布研究[J]. 中华临床医师杂志(电子版), 2013, 7(18):135-138. |
| [6] | Pagel JM, Matthews DC, Kenoyer A, et al. Pretargeted radioimmunotherapy using anti-CD45 monoclonal antibodies to deliver radiation to murine hematolymphoid tissues and human myeloid leukemia[J]. Cancer Res, 2009, 69(1): 185-192. |
| [7] | Iznaga-Escobar N, Ramirez IL, Izquierdo JC, et al. 188Re-labeled anti-epidermal growth factor receptor humanized monoclonal antibody h-R3: labeling conditions, in vitro and in vivo stability[J]. Methods Find Exp Clin Pharmacol, 2003, 25(9): 703-711. |
| [8] | Luo TY, Cheng PC, Chiang PF, et al. 188Re-HYNIC-trastuzumab enhances the effect of apoptosis induced by trastuzumab in HER2-overexpressing breast cancer cells[J]. Ann Nucl Med, 2015, 29(1):52-62. |
| [9] | Pillai MR, Dash A, Knapp FF Jr. Rhenium-188: availability from the 188W/188Re generator and status of current applications[J]. Curr Radiopharm, 2012, 5(3): 228-243. |
| [10] | Lütje S, Rijpkema M, Goldenberg DM, et al. Pretargeted dual-modality immuno-SPECT and near-infrared fluorescence imaging for image-guided surgery of prostate cancer[J]. Cancer Res, 2014, 74(21):6216-6223. |
| [11] | Goldenberg DM, Chang CH, Rossi EA, et al. Pretargeted molecular imaging and radioimmunotherapy[J]. Theranostics, 2012, 2(5):523-540. |
| [12] | Green DJ, Pagel JM, Pantelias A, et al. Pretargeted radioimmunotherapy for B-cell lymphomas[J]. Clin Cancer Res, 2007, 13(18 Pt 2): 5598s-5603s. |
| [13] | Witzig TE, Wiseman GA, Maurer MJ, et al. A phase I trial of immunostimulatory CpG 7909 oligodeoxynucleotide and yttrium-90 ibritumomab tiuxetan radioimmunotherapy for relapsed B-cell non-Hodgkin lymphoma[J]. Am J Hematol, 2013, 88(7):589-593. |
| [14] | Pagel JM, Hedin N, Subbiah K, et al. Comparison of anti-CD20 and anti-CD45 antibodies for conventional and pretargeted radioimmunotherapy of B-cell lymphomas[J]. Blood, 2003, 101(6):2340-2348. |
| [15] | Paganelli G, Magnani P, Zito F, et al. Three-step monoclonal antibody tumor targeting in carcinoembryonic antigen-positive patients[J]. Cancer Res, 1991, 51(21): 5960-5966. |
| [16] | Schulz AS, Glatting G, Hoenig M, et al. Radioimmunotherapy-based conditioning for hematopoietic cell transplantation in children with malignant and nonmalignant diseases[J]. Blood, 2011,117(17): 4642-4650. |
| [17] | Chen Y, Kornblit B, Hamlin DK, et al. Durable donor engraftment after radioimmunotherapy using alpha-emitter astatine-211-labeled anti-CD45 antibody for conditioning in allogeneic hematopoietic cell transplantation[J]. Blood, 2012, 119(5): 1130-1138. |
 2015, Vol. 35
2015, Vol. 35